Nat Methods:何爱彬/舒绍坤团队开发同时检测药物基因组靶点与表观基因组的单细胞方法scEpiChem
2024-07-24 测序中国 测序中国
研究报道了一种称为“scEpiChem”的单细胞药物多组学技术,用于同时检测单细胞小分子药物-靶标结合及多模态表观基因组图谱,揭示药物反应和功能异质性。
导语
小分子可以调节细胞过程,并影响基因表达、染色质结构和信号通路功能。这些相互作用为包括传统疗法与靶向治疗等干预措施奠定了基础。虽然目前医学界已证实许多小分子药物可以与基因组相互作用起效,但其中具体机制仍不清楚。因此,绘制小分子结合DNA或染色质相关蛋白的图谱对于破译其在抗癌治疗中的作用至关重要。
目前为止,只有少数几种技术被报道可用于检测大样本中小分子和细胞DNA之间的相互作用,而这些技术动辄需要数百万个细胞。迄今为止,小分子靶点结合的单细胞分析尚未实现。Protein A-Tn5(pA-Tn5)将Protein A与经过工程学改造的超高活性Tn5转座酶进行融合,形成同时具备转座酶与Protein A活性的新型融合酶,可兼容单细胞,具有DNA片段化活性较高、纯度高等特点,常用于研究蛋白质-基因组互作。
2024年7月18日,北京大学何爱彬、舒绍坤团队合作在Nature Methods上发表了题为“Single-cell EpiChem jointly measures drug–chromatin binding and multimodal epigenome”的研究论文,报道了一种称为“scEpiChem”的单细胞药物多组学技术,用于同时检测单细胞小分子药物-靶标结合及多模态表观基因组图谱,揭示药物反应和功能异质性。

主要研究内容
01 scEpiChem技术特点
scEpiChem(1a)利用分裂池条形码和pA-Tn5抗体导向靶标来获得单细胞小分子结合位点(图1a)。具体过程如下:
①将经轻度固定和透化处理的细胞与生物素化(btn)小分子-抗生物素抗体复合物一起孵育;
②用6个预先加上PAT-T5接头的pA-Tn5标记细胞以靶向特定基因组区域;
③将具有转位染色质片段的细胞分布到96孔板中,与特定的条形码寡核苷酸进行两轮杂交;
④pooling全部细胞后再重新分配为每管1000~3000个细胞,加上96种条形码寡核苷酸接头,进行PCR;
⑤随后,对DNA片段进行扩增和测序。
研究人员在K562细胞系:HGC27细胞系:小鼠胚胎干细胞(mES)=1:1:2的混合细胞系体系中验证了scEpiChem的效果(图1b, c),人鼠染色质谱读数分离率良好(图1c),且不受测序深度影响。在来自两种生物素化小分子(JQ1-btn和THZ1-btn)数据集的非重复读取和峰读取分数(FRiP)中获得了一致的数据质量(图1e-g)。
因此,scEpiChem能够以高信噪比对小分子靶向的基因组结合位点进行高通量分析,进一步的优化实验可能通过降低重复率来提高每个细胞的读数。
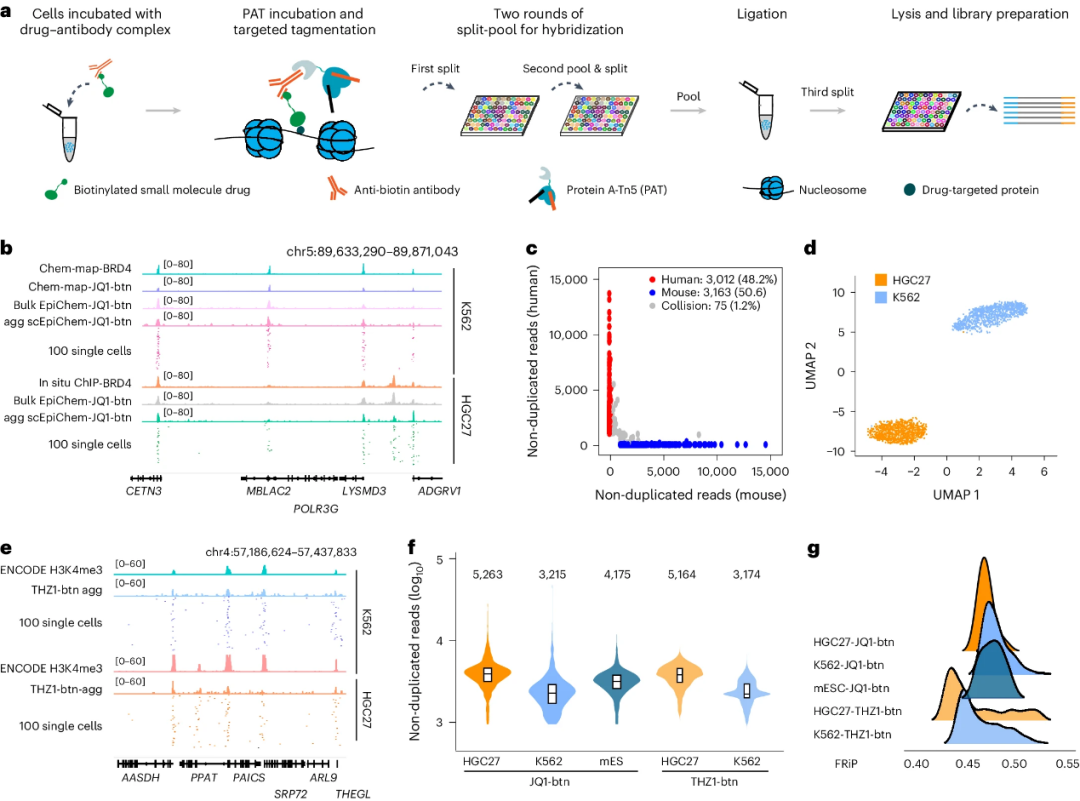
图1 scEpiChem靶向小分子药物基因组结合位点
02 scEpiChem联合检测
研究人员在K562细胞系:HGC27细胞系=1:1的混合细胞系体系中使用JQ1-btn验证了scEpiChem区分双模态细胞混合物的能力(图2a, b),计算了两种细胞中JQ1-btn与H3K27me3的单细胞非重复读数中位数(图2c)。根据5-kb全基因组信号计算相关性发现,JQ1-btn与H3K27me3信号之间存在明显分离,BRD4位点周围聚集单细胞JQ1-btn信号,而JQ1-btn与H3K27me3信号互斥(图2d),证实了JQ1-btn的靶标BRD4以高乙酰化组蛋白修饰且缺乏H3K27me3的特征与染色质区域结合。
随后,研究人员将scATAC-seq引入scEpiChem,证实了scEpiChem在同时检测药物-靶标结合与染色质可及性的能力(图2e-g),并能够识别出药物与靶蛋白结合之间的细微差异。
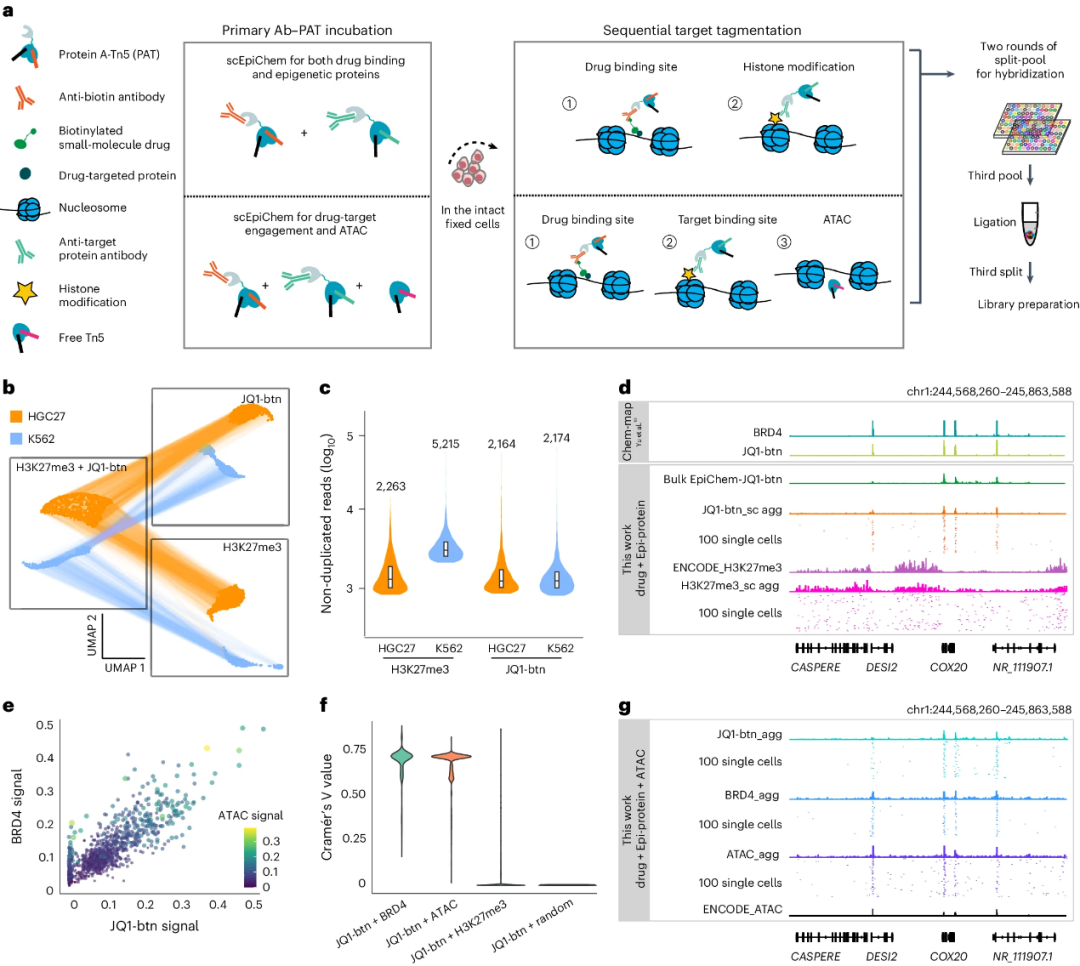
图2 scEpiChem联合检测流程
03 药物与肿瘤互作的多模态图谱
接下来,研究人员构建了H3K27ac和三种生物素化小分子(JQ1-btn、THZ1-btn和Dox-btn)在上皮-间质转化(EMT)过程中的单细胞动态基因组结合图谱,确定了上皮细胞和中间EMT细胞两个细胞群(图3a, b)。拟时序分析揭示,结直肠癌(CRC)类器官中存在从上皮细胞到中间EMT细胞的分化轨迹(图3c)。EMT期间富集到JQ1-btn、THZ1-btn和Dox-btn在GPN3上的信号(图3d, e)。沿分化轨迹的H3K27ac信号动态变化伴随不同小分子基因组分布及独特的基因功能(图3f)。
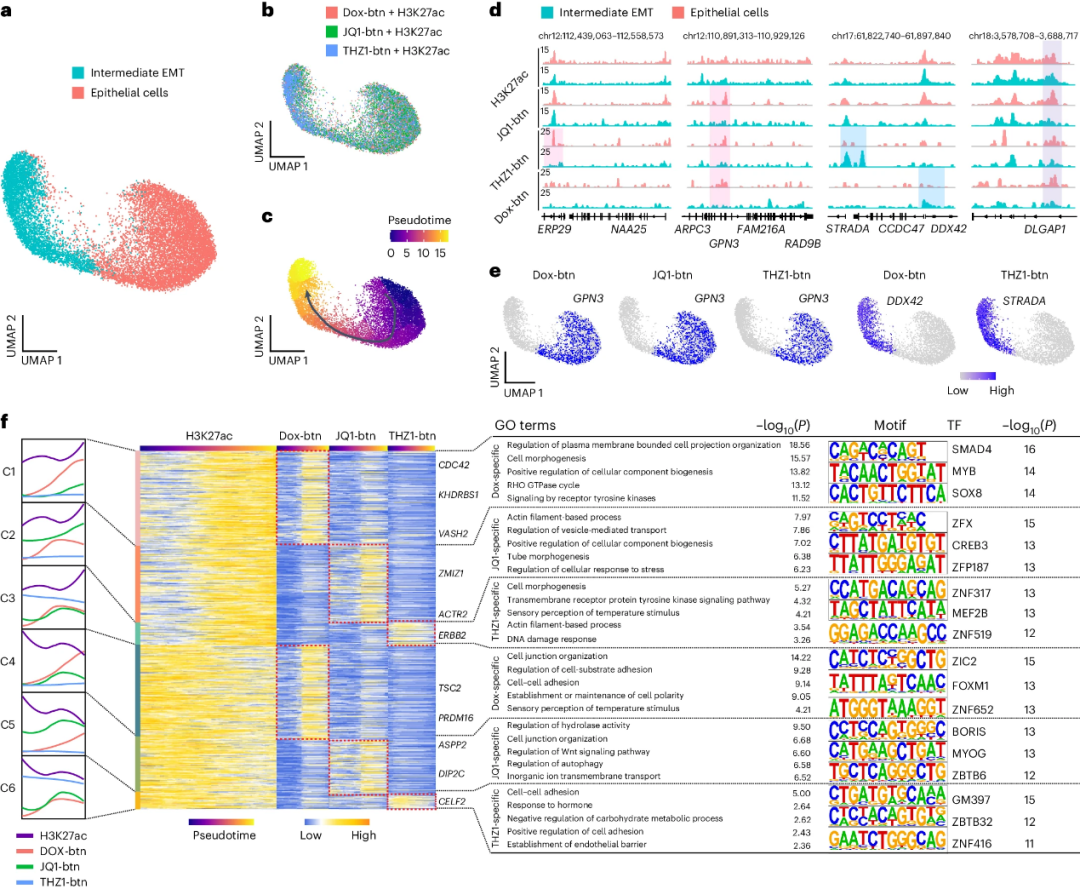
图3 scEpiChem检测人CRC类器官中三种小分子药物的细胞类型特异性基因组结合动力学
研究人员同时进行了CRC类器官的ATAC-seq,鉴定出两个主要群(图4a),并进行了拟时序分析(图4b)。在中间EMT细胞的VIM位点发现了显著的JQ1-btn、BRD4和ATAC信号,在上皮细胞发现了CDH1(图4c)。研究人员建立了7,916个与EMT相关的假定JQ1-BRD4靶向链接(图4d),并将这些链接按照ATAC信号分为三个簇(图4d)。各簇表现出JQ1-btn与BRD4协同信号的异质性与独特的信号传导通路(图4e, f),表明药物基因组结合的异质性。
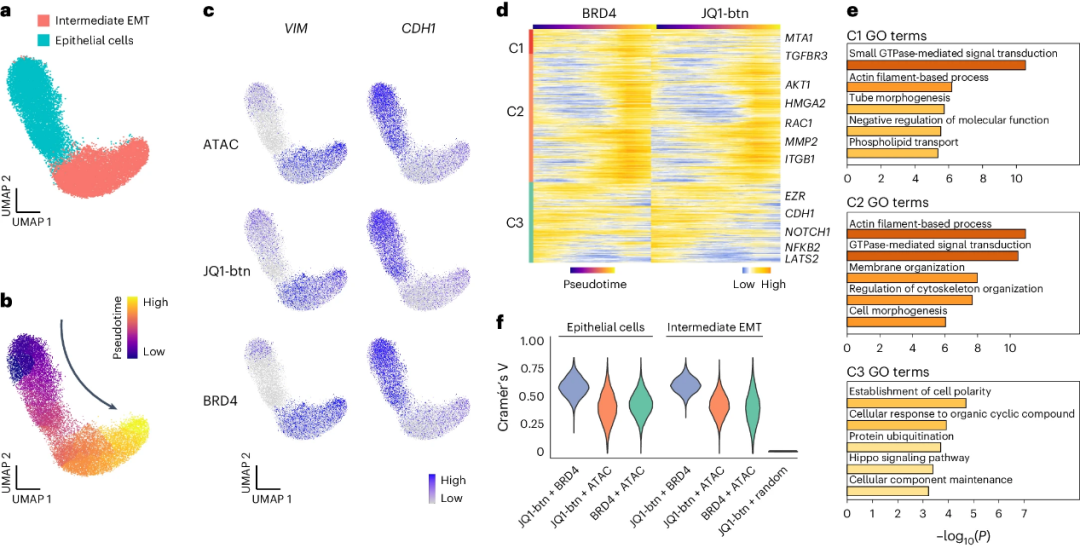
图4 scEpiChem动态定位人CRC类器官中JQ1-btn与基因组及其靶标BRD4的结合
最后,研究人员用JQ1、THZ1、Dox和DMSO在抑制浓IC5下处理CRC类器官5天,收集三个时间点(d0、d3、d5)的单细胞同时进行小分子和H3K27ac分析(图5a, b)。研究人员将未处理组(d0)与处理组(d3、d5)之间不同的H3K27ac峰区域与小分子峰区域重合,分为5个簇,GO揭示了各簇的特异信号通路(图5c-h)。研究人员进一步用chromVAR研究了EMT期间沿拟时序表达的转录因子(TF)活性,发现经Dox-btn处理的TF存在差异。
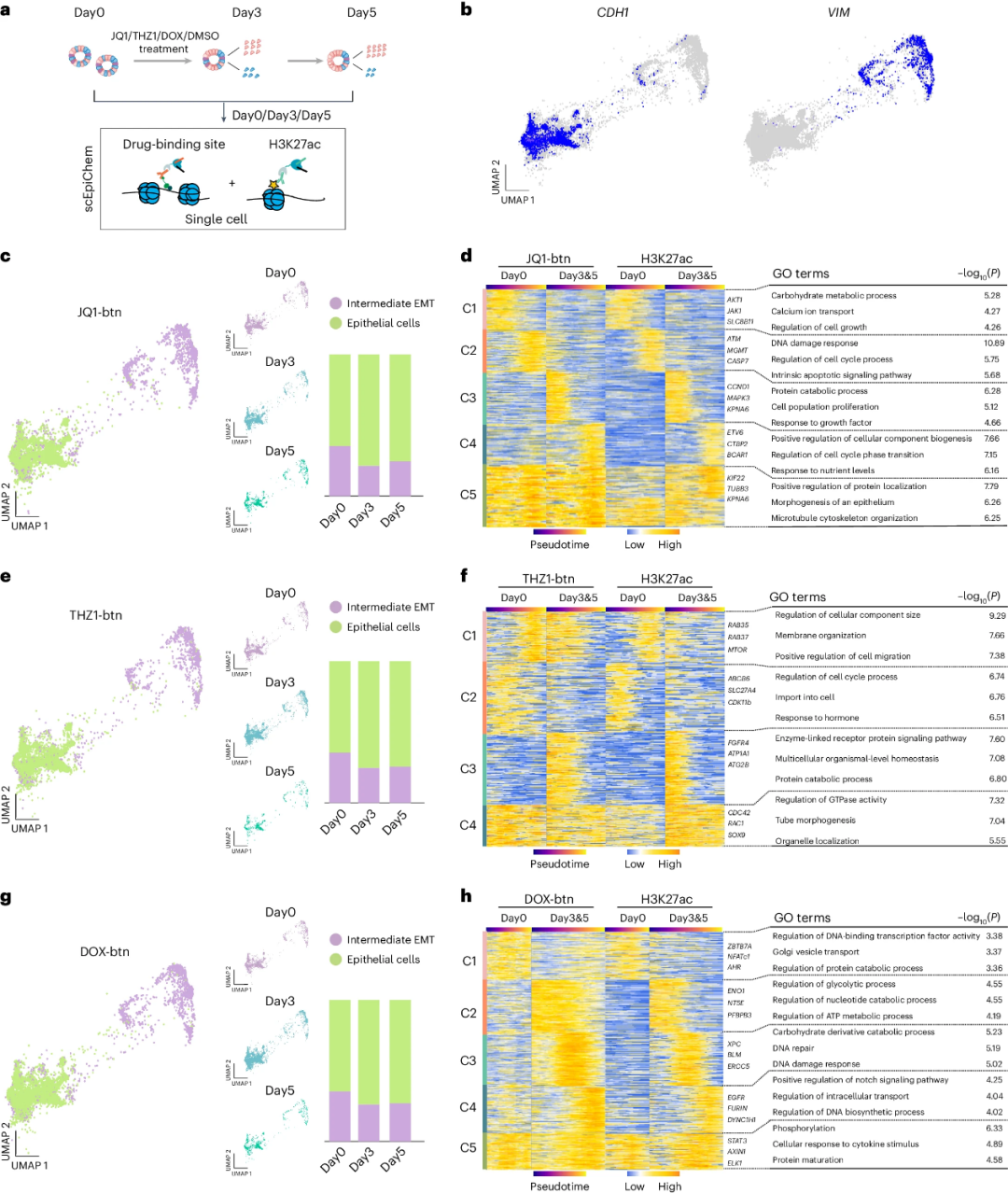
图5 scEpiChem通过人CRC类器官中的药物-基因组结合位点和染色质状态识别跨细胞类型药物敏感性
结 语
综上所述,研究团队开发了一种独特的scEpiChem技术,可以同时检测药物小分子与表观基因组的互作动力学,包括单细胞组蛋白修饰及染色质可及性。研究团队基于该技术阐明了人CRC类器官在上皮-间质转化过程中H3K27ac与三种生物素化小分子(JQ1-btn、THZ1-btn和Dox-btn)沿拟时序轨迹的信号富集差异,以及独特的信号传导通路。
研究团队在文中写道:“scEpiChem的一个显著优势在于它能够捕获肿瘤或组织内小分子药物与基因组结合的异质性,这是传统批量检测中经常被忽视的一个方面。利用患者类器官的scEpiChem数据进行分析,对于探索靶向基因组或表观基因组的抗癌小分子的细胞反应和耐药机制具有很大的前景。”
论文原文:
Dong, C., Meng, X., Zhang, T. et al. Single-cell EpiChem jointly measures drug–chromatin binding and multimodal epigenome. Nat Methods (2024). https://doi.org/10.1038/s41592-024-02360-0
作者:测序中国
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肿瘤# #表观基因组# #scEpiChem# #药物基因组#
64