Small:郑州大学王蕾团队通过鼻内递送自组装姜黄素纳米颗粒脂质体调节小胶质细胞极化以治疗阿尔茨海默病
2024-10-14 iNature iNature
该研究发现,与具有单价效应的游离姜黄素相比,姜黄素分子自组装成无载体姜黄素纳米颗粒(CNP)能够与Aβ的多价结合,从而对Aβ聚集产生更强的抑制作用。
活化的M1型小胶质细胞诱导的神经炎症是阿尔茨海默病(AD)的关键致病因素。小胶质细胞从促炎M1表型到抗炎M2表型的极化是一种有效方法,为实现这一目标,应根除活化M1型小胶质细胞的罪魁祸首——β淀粉样蛋白(Aβ)聚集体。
2024年10月6日,郑州大学王蕾唯一通讯在Small 在线发表题为“Intranasal Delivery of Pure Nanodrug Loaded Liposomes for Alzheimer's Disease Treatment by Efficiently Regulating Microglial Polarization”的研究论文。该研究发现,与具有单价效应的游离姜黄素相比,姜黄素分子自组装成无载体姜黄素纳米颗粒(CNP)能够与Aβ的多价结合,从而对Aβ聚集产生更强的抑制作用。
基于此,作者开发了负载CNP的心磷脂脂质体来高效极化小胶质细胞。鼻内给药后,脂质体响应AD的氧化微环境分解释放CNPs和心磷脂。CNPs抑制Aβ聚集并促进小胶质细胞中的Aβ吞噬或清除,消除小胶质细胞极化的障碍。随后,CNPs被小胶质细胞内吞并抑制小胶质细胞极化(M1→M2)的TLR4/NF-κB通路。同时,心磷脂促使小胶质细胞功能障碍正常化以预防促炎因子的释放。AD转基因小鼠中,给药治疗后神经炎症、Aβ聚集和记忆缺陷得到缓解。通过细胞外抑制Aβ聚集、细胞内抑制炎症相关通路,这一纳米级递送系统有效极化了小胶质细胞,为AD治疗提供了可靠方法。

阿尔茨海默病(AD)是最顽固和最常见的神经退行性疾病,已成为一种社会经济负担。小胶质细胞激活诱导的神经炎症是AD的特征性病理标志之一,调节小胶质细胞从促炎M1向抗炎M2表型的极化是一种有效的AD治疗方法。然而,因为功能失调的小胶质细胞和淀粉样蛋白β(Aβ)蛋白之间存在异常串扰,仅干预小胶质细胞的炎症相关通路远不足以实现有效极化。具体来说,Aβ聚集体(如原纤维)不仅是M1型小胶质细胞的诱导剂,也是小胶质细胞向M2型极化的障碍,导致临床研究中M2型小胶质细胞的极化效率低。因此,Aβ的重要性不容忽视,通过细胞外清除Aβ聚集、细胞内抑制炎症相关通路,联合极化小胶质细胞可能是一种潜在方法。
小胶质细胞是中枢神经系统的主要神经免疫细胞,负责调控神经炎症和Aβ吞噬。在响应不同的刺激时,静息小胶质细胞被激活成两种表型,可能会加重或抑制AD进展。具体来说,毒性Aβ聚集体在AD早期激活Toll样受体4(TLR4)/核因子kappa-B(NF-κB)通路,诱导促炎M1型小胶质细胞,导致Aβ吞噬障碍,释放促炎因子来损害神经元并加速AD进展。相比之下,抗炎M2型小胶质细胞分泌抗炎因子和脑源性神经营养因子(BDNF)以保护、修复和再生神经元。
越来越多的证据表明,天然化合物姜黄素(Cur)不仅可以通过非共价相互作用(如疏水相互作用、氢键相互作用)结合Aβ以限制Aβ-Aβ相互作用,预防Aβ单体聚集成有毒原纤维,还可以抑制小胶质细胞TLR4/NF-κB通路以调节小胶质细胞从M1向M2的极化,是一种有效的抗阿尔茨海默病药物。然而,Cur的临床应用仍面临巨大挑战:由于游离Cur和Aβ之间的单价相互作用(涉及单个配体和受体的相互作用),对Aβ聚集体无抑制作用;溶解度差和生物利用度低导致治疗剂量不足。随着纳米技术的发展,体外和体内条件下Cur分子的纳米颗粒形式可以解决上述问题。
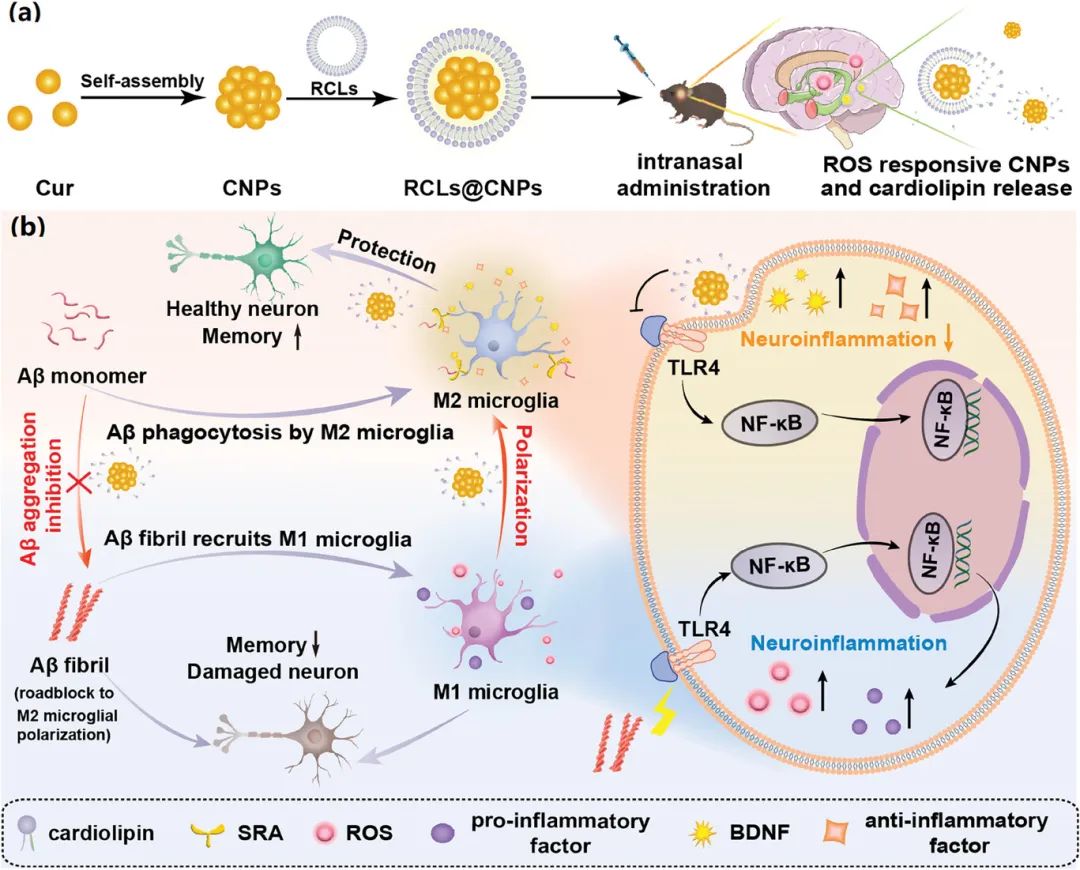
图1 RCLs@CNPs调控小胶质细胞极化示意图(摘自Small )
与单价相互作用相比,多价相互作用(涉及多个配体和受体的同时相互作用)对配体表现出更高的亲和力,广泛存在于识别和粘附过程等生物过程中。受多价效应的启发,将Cur分子自组装成无载体的纯Cur纳米颗粒(CNP)可能是应对上述挑战的一种有效选择。该研究中,CNPs表面暴露并提供多个Aβ结合位点,比游离Cur或载体辅助纳米药物的Aβ结合效应更强,对Aβ聚集表现出优异的抑制作用。更重要的是,自组装CNP具有纳米颗粒形成速率高、毒副作用小等优点。该研究发现CNP可以有效抑制Aβ聚集并进一步调节小胶质细胞从M1到M2的极化,并增强小胶质细胞的Aβ吞噬作用以去除Aβ。
为避免CNP与非靶蛋白在到达AD病变之前发生相互作用,使用活性氧(ROS)响应性心磷脂脂质体(RCL)负载CNP,得到RCLs@CNPs纳米颗粒。为解决口服或肠外给药血脑屏障(BBB)渗透性差的问题,采用鼻内给药,绕过BBB的嗅觉和三叉神经将RCLs@CNPs运输到大脑。更重要的是,鼻内给药具有易于自用、无创、起效快和脑生物利用度高等特点,成为中枢神经系统疾病给药的替代途径。在AD微环境中RCLs@CNPs响应氧化应激降解以释放CNP和心磷脂。与游离Cur相比,CNPs对Aβ聚集表现出更高的抑制作用,促进小胶质细胞极化为M2型。
随后,CNP被小胶质细胞吸收并进一步抑制小胶质细胞从M1到M2极化的TLR4/NF-κB通路。心磷脂最初是一种线粒体磷脂,当释放到细胞外时能够使小胶质细胞免疫功能障碍正常化,防止促炎因子的释放。结果显示,RCLs@CNPs减少了AD转基因小鼠的Aβ负荷,减轻了神经炎症,并改善了记忆缺陷。因此,通过细胞外促进Aβ聚集、细胞内抑制炎症相关途径,这种单一性纳米载药脂质体有效调节了M2型小胶质细胞极化,为AD治疗提供了一种可靠的新策略。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202405781
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#阿尔茨海默病# #姜黄素分子自组装成无载体姜黄素纳米颗粒#
36