Cancer Cell:细胞外囊泡是肿瘤转移中的通讯介质
2017-01-03 不详 外泌体之家
12月12日,来自美国威尔康奈尔医学院的研究人员在Cancer Cell上发表了一篇题为“Extracellular Vesicles in Cancer: Cell-to-Cell Mediators of Metastasis”的Perspective文章,介绍了肿瘤细胞外囊泡及其转移过程中的作用。肿瘤分泌的细胞外囊泡(extracellular vesicles, EVs)是介导在局部和远处
12月12日,来自美国威尔康奈尔医学院的研究人员在Cancer Cell上发表了一篇题为“Extracellular Vesicles in Cancer: Cell-to-Cell Mediators of Metastasis”的Perspective文章,介绍了肿瘤细胞外囊泡及其转移过程中的作用。肿瘤分泌的细胞外囊泡(extracellular vesicles, EVs)是介导在局部和远处微环境中肿瘤细胞和基质细胞之间的细胞间通讯的关键介质。
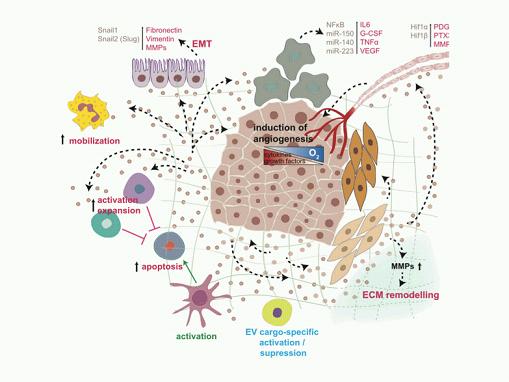
肿瘤细胞外囊泡在原发性肿瘤微环境的作用
肿瘤EVs会使成纤维细胞分化成肌成纤维细胞,其释放MMP并导致细胞外基质(extracellular matrix,ECM)的重塑。 ECM的分解会导致ECM中的生长因子的释放并促进实质细胞的侵袭能力。肿瘤EVs激活肿瘤相关巨噬细胞并分泌G-CSF、VEGF、IL-6和TNF-α,它们一起促进血管生成并产生炎性细胞。肿瘤EVs影响免疫系统稳态,主要是通过免疫抑制的变化来保护肿瘤。肿瘤EVs激活和增加Tregs和MDSCs,抑制CD8+ T细胞介导的靶向肿瘤的免疫作用。
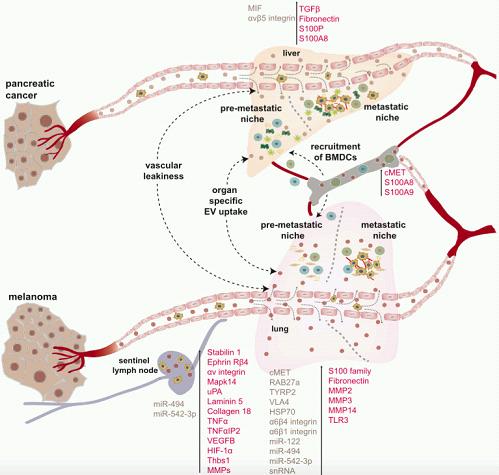
EVs在转移的远端位点转移前龛(Pre-metastatic Niche,PMN)形成中的多个步骤发挥独特的作用。根据来源的癌细胞不同,EV可以通过血液和淋巴管循环,以到达它们的PMN起始位置。通过某些未知的机制,肿瘤EVs可以诱导血管渗漏以及与远端器官的驻留细胞相互作用。根据其膜蛋白组成不同,例如特异性外泌体整合素(外泌体整合素avb5与肝转移、外泌体整合素α6b4和α6b1与肺转移),EVs会靶向特定器官内的特定常驻细胞类型。在它们被受体细胞摄取时,EVs可以诱导几种炎症因子(例如S100家族蛋白、TGF-b、IL-6、IL-8和TNF-α)的表达,导致基质细胞的激活和重塑,以及BMDCs在PMN的募集,这对肿瘤进展至关重要。
原始出处:
作者:不详
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Cell#
23
#cancer cell#
25
#CEL#
20
#肿瘤转移#
36
#细胞外囊泡#
48