科兴灭活疫苗巴西三期临床试验结果出炉!
2021-04-13 K.K MedSci原创
导语:国产新冠疫苗里科兴第一个完整披露三期临床试验结果,此前进展也一直排在全球新冠疫苗研发前列。
巴西圣保罗州布坦坦研究所11日公布了中国科兴公司新冠疫苗CoronaVac在巴西Ⅲ期临床试验的最终研究结果,将该疫苗对含不需就医的轻症病例在内的所有新冠病例的保护效力从今年1月初公布的50.38%修正为50.7%,对有明显症状且需就医的新冠病例的保护效力从1月的78%修正为83.7%。
这项研究由布坦坦研究所主导,目前已提交给医学杂志《柳叶刀》等待同行评审,研究的主要目的是为了评估CoronaVac疫苗对有症状的新冠患者的疗效,于2020年7月21日~12月16日在巴西进行Ⅲ期临床试验,12,408名参与者分布在巴西的16个研究地点。其中,12396名参与者至少注射了一剂CoronaVac或安慰剂,分为疫苗组6195人、安慰剂组6201人。

Palacios et al., (2021). Efficacy and safety of a COVID-19 inactivated vaccine in healthcare 2 professionals in Brazil: The PROFISCOV study. https://ssrn.com/abstract=3822780
60岁或60岁以上的老年参与者占5.1%、女性占64.2%、白人占75.3%。半数以上的参与者有基础疾病(55.9%),22.5%的参与者为肥胖者(BMI≥30 kg/m2)。参与者的平均年龄为39.5岁,BMI为26.8 kg/m2。
根据FDA标准,新冠阳性病例是指任意两天或两天以上出现其一种症状(发烧或发冷、咳嗽、呼吸急促或呼吸困难、疲劳、肌肉或身体疼痛、头痛、喉咙痛、鼻腔疼痛、呼吸困难、发烧或发冷、充血或流鼻涕、恶心或呕吐、腹泻),且SARS-CoV-2 RT-PCR结果呈阳性的人。据此,研究人员将确诊的新冠病例分为:
1)连续两天出现一种或多种特异性症状(如咳嗽、味觉或嗅觉新发障碍、呼吸急促或呼吸困难)。
2)有两个或两个以上非特异性症状(发热[腋下体温≥37-5℃]、寒战、咽痛、疲劳、鼻塞或流鼻涕、身体疼痛、肌肉疼痛、头痛、恶心或呕吐、腹泻。)
3)具有新冠病毒的影像学特征。
4)RT-PCR检测呼吸道拭子中存在SARS CoV-2病毒核酸片段。
除了将新冠病例的情况划分,研究还在不同亚组中评估疫苗的效果,这些亚组包含不同年龄组、不同种族组,有无基础疾病组、两剂疫苗接种间隔时间不同(<21天或≥21天)、根据WHO评估新冠症状的不同严重级别,纳入的所有病例的症状开始时间均在2020年12月16日之前,主要安全终点是指注射疫苗后7天内不良反应的发生率,并将中位随访时间定为第二剂接种后的两个月。通过基于细胞病理效应的病毒中和试验,采用了SARS-CoV-2野生型变异体,分析每个年龄组的参与者血清样本,用以确定中和滴度。
接种疫苗的不良反应高于未接种疫苗
直到截止日期,不良事件的概率和不良反应的发生率分别为78.8%和71.7%,一般来说,疫苗组的不良反应比安慰剂组要高(77.1% vs. 66.4%;p<0001)。疫苗组局部不良反应的发生率为61.5%,主要是注射部位疼痛,高于安慰剂组的34.6%(p<0.0001)。但是,针对全身不良反应来看(主要是头痛和疲劳),两组相似(48.4% vs 47.6%,p=0.3882)。而发热(≥37.8℃)的不良反应并不常见,疫苗组和安慰剂组分别只有0.2%和0.1%(p=0.2666)。震颤、潮红和给药部位局部不适在疫苗组中显示出较高的发生概率。
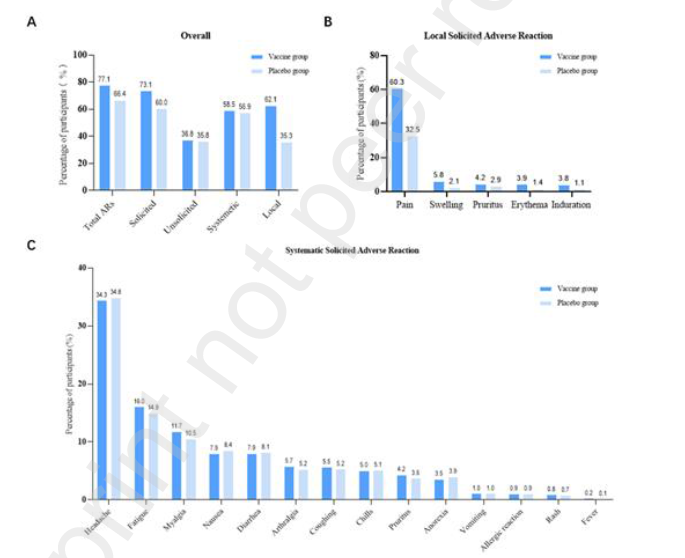
接种疫苗或安慰剂后,出现不良反应的受试者百分比。(A)出现任何不良反应的参与者百分比;(B)按不同症状出现局部不良反应的受试者百分比;(C)按不同症状出现不良反应的参受试者百分比。
本试验中报告了2例死亡:1例心肺骤停(安慰剂组),1例用药过量(疫苗组),均与疫苗无关。 另有一例因COVID-19(安慰剂组)导致的死亡。
为了更加详细的评估新冠疫苗的保护效力,研究人员又根据疾病的严重程度评估新冠疫苗保护效力,分为需就医的病例(评分≥3分)、中及重度病例(评分≥4分)。
在9823名参与者中,需就医病例有35例(疫苗组5例,安慰剂组30例),10例2分以上,6例重症(包括1例死亡)。需就医的新冠病例的保护效力为83.7%(95%CI 58.0-93.7)。中及重度病例有5例,均在安慰剂组。换句话说,对中、重度病例的疫苗有效率为100%(95%CI 56.4-100.0)。
此外,两剂间隔少于21天的参与者疗效为(49.1%;95%CI 33.0-61.4)。一小部分接受两剂疫苗或安慰剂间隔大于21天的参与者,疗效为62.3%(95%CI 13.9-83.5)。
其他年龄组之间存在疗效相似(18~59岁:50.7%;≥60岁:51.1%)。对于有基础疾病的130例参与者,疫苗疗效为48.9%(95%CI 26.6-64.5)。对于患有心血管疾病、糖尿病和肥胖症的参与者,疗效分别为39.5%(95%CI 66.4-78.0)、48.6%(95%CI 115.3-87.7)和74.9%(95%CI 19 53-7-86.4)。
对于首次接种或首次接种后14天的12396名参与者中,首剂后共有378例报告信息,其中疫苗组126例,安慰剂组252例,首剂后的疗效为50.8%(95%CI 39.0- 60.3)。首剂后14天,在11431名参与者中收集到313例病例报告,94例在疫苗组,219例在安慰剂组,结果疗效为57.9%(95%CI 46.4-66.9)。

A)注射第1剂疫苗后对新冠的保护效力 B)接种第1剂和第2剂后14天的病例数和疗效。
有109名参与者在接种疫苗前和接种第二剂疫苗后的两周内进行了检测。其中,6人在接种前样本呈阳性(疫苗组4人,安慰剂组2人),未进行血清评估。在4名接种疫苗的参与者中,有2名参与者之前的抗体滴度增加了4倍或更高。
而安慰剂组58名参与者中,有3名(5.2%)血清检测有B.1.1.28变异体,它是一种野生型新冠病毒。疫苗组45名参与者中,有32名血清检测有B.1.1.28变异体(71.1%),36名有P.2病毒株(80.0% ),31名有P.1病毒株(68.9%),这一毒株携带多种产生免疫逃逸的基因突变。
在22名18~59岁的成年人接种疫苗组中,21人血清检测有B.1.1.28变异体(95.5%),17人为P.1(77.3%),21人为P.2(95.5%)。60岁或以上的参与者的23份样本中,11份血清检测有B.1.1.28变异体(47.8%),14份有P.1(60.9%),15份有P.2(65.2%)。 B.1.1.28变异体和P.2变异体的血清转换率与年龄有显着关系,但P.1变异体无显着性(p=0.337)。
研究人员在讨论环节中指出,虽然突变病毒株携带与免疫逃逸相关的多种基因突变,但是由于灭活疫苗使用完整新冠病毒作为抗原,它可能激发更为多样的抗体免疫反应。目前的实验数据显示,疫苗接种者血清对不同新冠突变体具有一致的中和效力。
作者:K.K
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#三期临床试验#
47
#活疫苗#
43
#三期临床#
42
#基层医生#
89
#巴西#
37