《以患者为中心的药物临床试验设计技术指导原则》(试行)解读
2023-08-15 药融圈 药融圈
“以患者为中心”的药物研发是以患者的需求为出发点,让患者参与药物研发,该理念已经成为目前药物研发的核心指导思想,因此为了指导以患者为中心的临床试验设计, CDE于20
“以患者为中心”的药物研发是以患者的需求为出发点,让患者参与药物研发,该理念已经成为目前药物研发的核心指导思想,因此为了指导以患者为中心的临床试验设计, CDE于2023年7月27日发布了该指导原则。

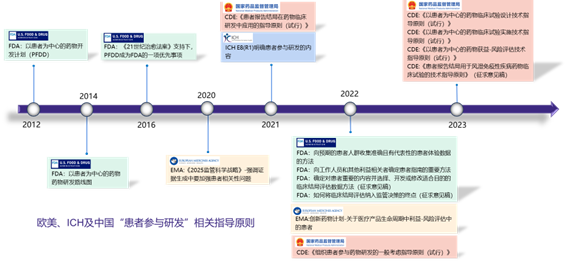
实际上 “以患者为中心”的理念一直贯穿在临床诊疗实践以及临床试验中,如诊疗实践中强调的“以人为本”,临床试验中的基石“赫尔辛基宣言”,以及反复强调的“获益风险比”,都体现了“以患者为中心”的理念。但是真正将“以患者为中心”纳入法规、指导原则是从近年来才开始的,从2012年开始FDA发布了一系列的患者参与研发的指导原则,到2020年EMA在2025监管科学战略中强调证据生成中要加强患者相关性问题,再到2021年ICH 发布了E8(R1) 明确了患者参与研发的内容,此后FDA、EMA及CDE先后发布了多个“患者参与研发”的指导原则,标志着“以患者为中心”的药物研发策略进入了新的阶段,上升到法规指南的层面。
本指导原则的目的有以下三点:
1、阐明以患者为中心的药物临床试验设计的总体原则和关键要素
2、说明如何收集并将患者体验数据纳入整体临床研发计划和试验设计
3、说明与审评机构沟通交流的重点内容
总体原则
以患者为中心的药物临床试验设计的前提是仍应满足药物临床试验设计的一般原则。建议同时参考 ICH E8(R1)和国家药监局发布的《药物临床试验的一般考虑指导原则》,以及针对特定疾病药物研发的技术指导原则等。除此之外,从以患者为中心的角度出发,应重点关注的原则有以下4点:
(一)将患者需求贯穿药物研发全过程
(二)临床试验设计应该体现患者需求
(三)应该改善受试者体验、减轻受试者负担
(四)加强早期和全过程沟通交流
“以患者为中心”的原则应该贯穿药物研发的全生命周期,充分了解患者的“经验、观点、需求和偏好”。粗略的将药物研发分为“临床前”、“临床”和“上市后”:
从药物开发的临床前阶段甚至更早期就应该根据拟定的适应症来确定产品的治疗目标,针对这个适应症的治疗现状,以及治疗药物能够让患者达到治疗结局,以及当前治疗的不足,来确定新研发的产品的临床定位,根据临床定位拟定潜在的优势。此外,根据未来的临床定位,适应症人群,来设计产品的剂型和递送方式。比如对于儿童患者人群,通常会将口服给药剂型设计为溶液剂、颗粒剂;对于重症疾病患者,无法经口给药的,设计成注射剂更符合患者的实际需求。
在临床阶段,需要考虑参加临床试验是否给患者带来了额外的风险或者不适。例如在NASH(非酒精性脂肪肝炎)的临床试验中,诊断和疗效确认都需要对患者做肝穿活检,该操作可能对患者参加临床试验的意愿造成影响。
对于临床试验终点指标的选择,应该关注患者对疾病带来的不良影响的体验,例如对于眩晕的治疗,对于患者而言更想达到的临床终点是快速缓解眩晕的症状,而不是缩短眩晕持续时间(如从眩晕5天缩短到4天)。
在临床试验过程中,应该尽可能的优化试验的流程,减轻患者的负担。如优化采样时间,提供交通服务等。
药品上市后,患者需要对产品具有知情选择权,才有助于做出选择。而确保药物的可及性也相当重要。
综上所述,药物开发中需要“以终为始”,在研发的全生命周期中考虑患者需求,改善患者的体验,减轻患者的负担,尽早与审评机构进行沟通交流。
以患者为中心的临床试验设计的考虑
(一)以患者为中心的临床整体研发计划。
药物研发的终极目标是使患者以最小的风险获得最大的治疗获益,因此整体的研发计划应该以终为始,在全流程中贯穿“以患者为中心”的原则。
重要的是,从临床实践中挖掘特定疾病未满足的临床需求,根据已有信息,在充分调研的基础上评估是否需要开展收集患者体验数据的研究以及研究内容,以解决临床研发中重要的科学问题。例如,对于某些发病率低、表型复杂、临床诊疗认知有限的罕见疾病,在开展药物研发之初,可以先对拟开发适应症开展临床调研和疾病自然史研究。
在整体研发计划中应该采取阶段性的研究决策考虑和动态调整。例如,为了支持在关键研究阶段入选人群范围更接近临床目标人群(如在某个成人与儿童共患适应症的成人研究中同时纳入 12 岁以上青少年),需要在早期阶段,结合临床需求和药物特点,获得相应的非临床和临床证据。拟用于后期的临床结局评估工具应在早期阶段完成探索和初步验证。
在符合科学性的原则下,优化临床研发策略,从而提高研发效率。例如基于成人数据的儿科适应症外推、建模模拟辅助药物研发、适应性设计等,避免不必要的患者暴露。
(二)收集患者体验数据的研究
在本指导原则中对“患者体验数据”的解释是:所有由患者、患者的家属、监护者、看护者提供的对疾病和相关治疗的经验、观点、需求和偏好等信息。
FDA在2021年发布的《新药和生物制品的获益-风险评估供企业用的指导原则》中术语患者体验数据(patient experience data)包括:(1)是指由患者、患者家属成员和家庭护理员、患者权益组织、疾病研究基金会、研究人员和药物生产商收集的数据。(2)旨在提供患者对疾病或状况体验的信息,包括:(a)这类疾病或状态或相关治疗对患者生活的影响(包括身体和心理影响),以及(b)患者对这类疾病或状态的治疗偏好。
收集患者体验数据的研究,就是指收集上述患者信息的研究,为药物研发提供支持,不同于具体的药物临床试验。患者体验数据研究的基本要素如下图所示:

(三)以患者为中心的临床试验设计要素

第1条要素:以患者需求为导向的研究目的
在确定研究目的时,需考虑疾病的自然史、试验药物的治疗目标、患者偏好信息等。
例如,治疗慢性胆汁淤积性肝病的药物一般以改善疾病进展为目的;但是这种疾病常常伴有瘙痒症状,严重瘙痒会显著影响患者的生活质量,在这种情况下,以改善瘙痒症状作为目标适应症进行新药研发,也可以为患者带来临床获益。
第2条要素:选择合适的目标人群
在药物研发过程中,申办者应当结合疾病特点、药物作用机制、已知安全性与有效性特征以及现有治疗等,纳入获益-风险比最优的受试者,并尽量促进受试者人群的代表性。
一方面,纳入最有可能从试验中获益的患者,以保障受试者的安全和权益。
例如,对于缺乏有效的后线治疗手段的疾病,若试验药物疗效尚不明确,则后线治疗患者相较一线治疗患者更有可能从中获益。
例如,如果作用机制或已有数据表明,试验药物在生物标志物阳性的患者中有明显的疗效,而在标志物阴性的患者中疗效较小甚至没有疗效,则标志物阳性的患者最有可能从试验中获益;而在用于富集受试者的标志物把握度不足、标志物阴性患者的治疗手段受限的情况下,也可考虑纳入标志物阴性患者。
另一方面,不应没有任何科学理由地排除特定人群,比如儿童、老年人、孕妇、肝肾功能不全的患者等,如果同样存在临床需求,那么应该在前期研究数据支持的前提下尽量纳入,除非存在明显安全性隐患,或有证据表明不太可能获益。
前瞻性地积累必要的支持性数据,可以避免在后期临床试验中对研究人群做不必要的限制。
例如,对于可能合并肝功能不全的慢性肝病适应症、或疾病本身常会对患者肝功能产生影响的罕见疾病,在前期肝功能损害研究数据支持的前提下,在后期临床试验中可考虑纳入肝功能不全患者,但要做好风险管理。
第3个要素:选择对于受试者最佳且可及的对照
临床试验中的对照组选择应充分保障受试者获得治疗的权益,符合伦理原则,例如某适应症已有上市且可及的标准治疗药物,则不能选择安慰剂做对照。
由于公认的标准治疗方案会不断修订,预期适当的对照组选择将随着时间的推移而发生变化。因此,建议在结合患者体验数据,选择当前临床实践中最佳且可及的治疗的基础上,关注其他可用治疗,评估未来一段时间内治疗需求的动态变化,前瞻性地选择对照组。
总体而言,应避免将次优治疗作为对照,从而影响受试者的治疗选择。
若在临床试验开展过程中,目标适应症的标准治疗发生变化,应及时告知受试者,保障受试者充分了解其它可选择的治疗手段,并保障受试者自主选择是否退出试验的权利。
第4个要素:基于临床结局评估的有效性评价
临床结局评估的定义:它是指来自患者及其看护者、医生或其他评估人员,用于评价患者个体感受、功能或生存状态的评估工具或手段,通常需要主观评估而非直接的事实呈现。
根据不同报告者,临床结局评估分为:医生报告结局(ClinRO)、患者报告结局(PRO)、观察者报告结局( ObsRO),还包括基于测试评估患者表现的功能结局(PerfO)。
患者报告结局PRO 是直接由患者本人报告的症状、体征、功能或其他方面的测量,未经医生或其他人的外部修正和解释。测PRO的工具通常为量表、问卷调查、数字评分或患者日志等。例如,患者整体评估(PGA)、数字评分量表(NRS)等。
医生报告结局ClinRO 是专业医护人员基于检查或观察到的患者疾病和健康状态的测量结果,多涉及对于患者体征、症状、行为或疾病相关的其他现象的临床判断或基于实验室指标的临床判断。例如,银屑病面积和严重程度指数(PASI)等。
观察者报告结局 ObsRO 是由日常生活照护者报告的患者健康状况结果的测量。例如,照护者记录的儿童癫痫发作频率日记等。
基于测试评估患者表现的功能结局PerfO 是患者完成一项标准化的功能任务时,由经过适当培训的人员或患者独自评估的测量值。例如,6分钟步行试验, 6MWT,即患者6分钟内的步行距离,用于分析心血管和肺部疾病患者功能能力。
此外,复合型临床结局评估工具中可能包含多种类型的临床结局评估,如 ClinRO 和 PRO 的组合等。
如何选择与目的相符的临床结局评估工具?:
•对于有症状或功能障碍的病症,一般采用 PRO评估,因为它们提供了患者感受和功能体验的直接证据。
•当患者不能提供自我报告时,往往需要基于观察体征、事件的报告或反映患者感受和功能的行为来报告(例如 ClinRO、 ObsRO),不鼓励由其他人代替患者从患者视角进行报告的间接测量方法。
•在需要临床判断来解释观察结果的情况下,应该使用 ClinRO 评估,例如评估斑块型银屑病的银屑病皮损面积及严重性指数( PASI)。
•PerfO 测量可用于通过一项或一系列的标准化任务,以标准化的方式评估患者的功能(例如:测量运动功能和认知功能等)。
第5个要素:在安全性监测中纳入患者体验数据
药物的安全性风险是患者选择药物时考虑的重要因素之一。
通过前期收集患者体验数据的结果,可以了解患者对于特定不良反应的看法和耐受程度,在临床试验设计中重点收集患者关注、耐受度较差从而影响其依从性的事件,尤其对于毒性较大、用药疗程长的药物。例如,在评价治疗慢性肾病贫血药物的安全性风险时,纳入主要心血管不良事件(心血管死亡、心肌梗死和卒中)作为安全性终点。关注症状性不良事件的评估(如恶心、疼痛等),可以选择 PRO 测量,以直接反映患者的感受。
临床试验设计中应体现有效的风险管理,以保障受试者安全。尤其对于特殊人群和安全性风险较高的受试者,必要时考虑制定针对性的风险管理措施,包括完善必要的评估检查,在给药和随访过程中设置适当的监测项目与频率(或在必要时进行非计划监测),以及针对性的预防/处理方法和随访计划等。例如在CART项目中,CRS和ICANS是最应关注的AE,那么在细胞回输以后,会持续的进行生命体征监测、心电监护、血氧饱和度,提前备好托珠单抗这类药品。
如何与审评机构的进行沟通交流?
审评机构鼓励申请人从药物研发的早期阶段积极的进行沟通交流。CDE鼓励沟通的内容如下:

综合来讲,如果在临床开发过程中选择临床结局评估终点,那么申请人需要证明这个临床结局评估是合理的、可行的,并具有度量性、信度,并据此与监管进行沟通。
参考文献:
1.以患者为中心的药物临床试验设计技术指导原则(试行),国家药监局药审中心,2023年7月27日。
2.以患者为中心的药物临床试验实施技术指导原则(试行),国家药监局药审中心,2023年7月27日。
3.以患者为中心的药物获益-风险评估技术指导原则(试行) ,国家药监局药审中心,2023年7月27日。
4. 组织患者参与药物研发的一般考虑指导原则(试行),国家药监局药审中心,2022 年 11 月。
5.患者报告结局在药物临床研发中应用的指导原则(试行),国家药监局药审中心,2021 年 12 月。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






不错学习了
89