Leukemia:TP53突变AML异基因移植后预测长期生存的因素:多中心研究结果
2023-03-02 聊聊血液 网络
TP53m AML患者在首次诱导或挽救治疗后进行allo-HSCT可改善长期结局。
TP53 突变 (TP53m) 急性髓系白血病 (AML) 患者具有高复发率和低总生存率 (OS),原因在于细胞毒性化疗的反应高度依赖于完整 p53 的存在以诱导细胞凋亡,因TP53突变髓系肿瘤对细胞毒化疗反应差。新型分子靶向治疗的出现为 AML 管理的个体化、风险适应性策略提供了机会,但它们在改善 TP53m AML 患者缓解率方面的成功率有限,包括维奈克拉和阿扎胞苷,中位OS仅有5-10个月。
虽然异基因造血干细胞移植 (allo-HSCT) 是高危 AML 的潜在治愈选择,但早期报告显示TP53突变 AML患者接受 allo-HSCT 缺乏获益,可能与移植前缓解深度和移植后TP53突变克隆持续存在相关,而首次缓解 (CR1) 时 allo-HSCT可显著降低复发风险和死亡率。
2022年《American Journal of Hematology》发表了一项多中心研究,作者分析了过去十年TP53m AML 患者一线治疗的结局,认为尽管TP53突变 AML 患者中维奈克拉的使用增加,但似乎改善生存率的唯一因素是allo-HSCT。后续作者又专门评估了TP53突变 AML患者在诱导或挽救性化疗后接受allo-HSCT的结局,以及TP53突变 AML患者接受allo-HSCT后预测长期生存的因素,发表于近日的《Leukemia》。


本研究为骨髓恶性肿瘤和肿瘤疾病联盟 (COMMAND) 开展的多中心、回顾性研究,涉及来自10个学术中心的急性白血病专家,目的是描述真实世界中急性白血病患者的结局。研究纳入2012年11月至2021年12月期间接受治疗的TP53m AML成人(≥18岁)患者,作者分析了预测接受 allo-HSCT 的 TP53m AML 患者长期生存的因素。
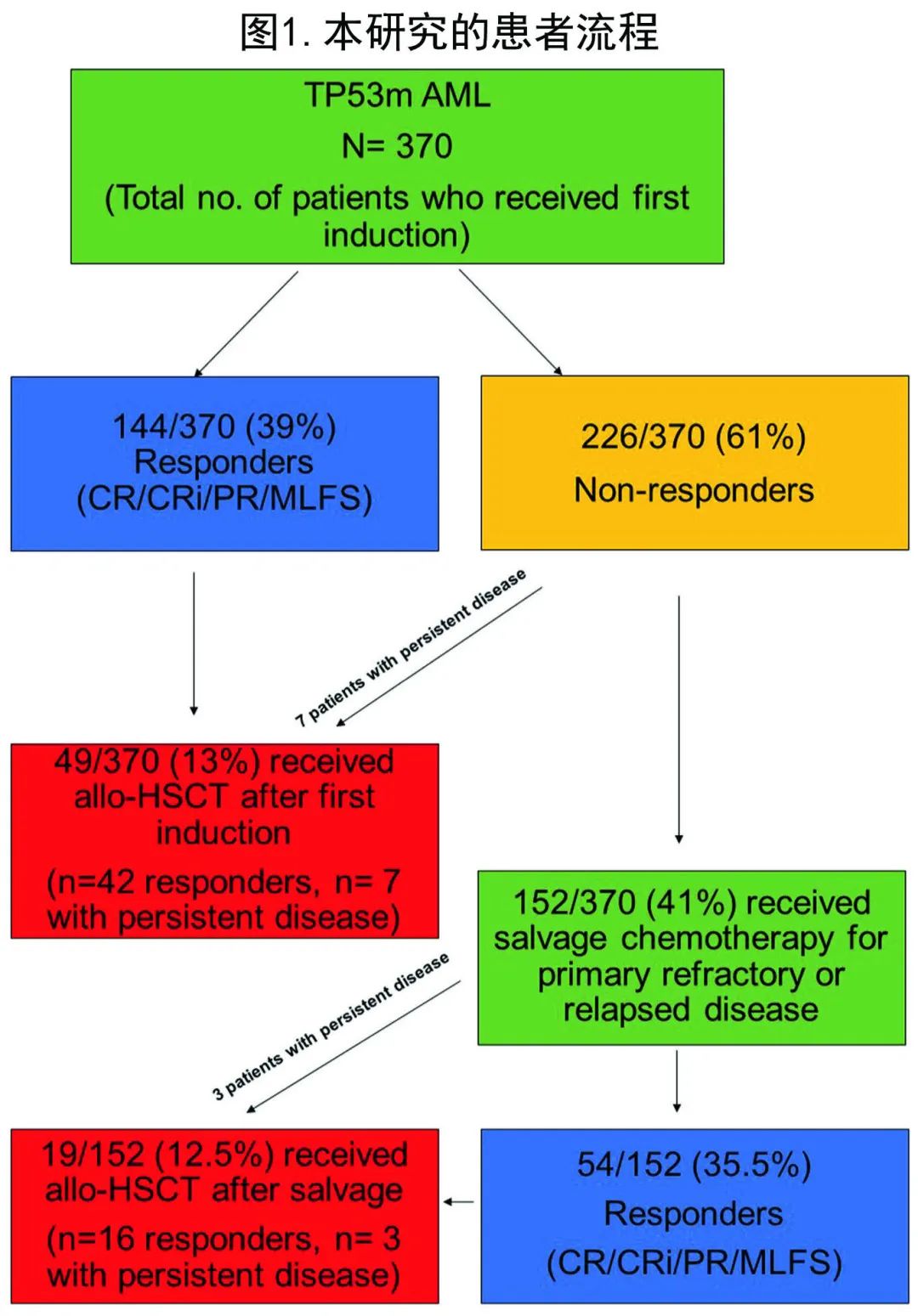
在接受白血病靶向治疗的370例 TP53m AML 患者中,共68例 (18%) 患者桥接allo-HSCT。首次诱导治疗后的 ORR (CR/CRi/PR/MLFS) 为39% (144/370),49/370例 (13%) 患者在首次诱导后接受了allo-HSCT(42例缓解者和7例疾病持续存在)。其余102/144例首次诱导后获得缓解的患者由于高龄/合并症或缺乏干细胞供者而未接受allo-HSCT。在370例患者的原始队列中,152例 (41%)原发难治性或复发性疾病接受挽救治疗,其中54例 (35.5%) 患者对挽救治疗有反应 (CR/CRi/PR/MLFS),19例 (12.5%) 在挽救治疗后接受了allo-HSCT(16例缓解者,3例疾病持续)(图1)。
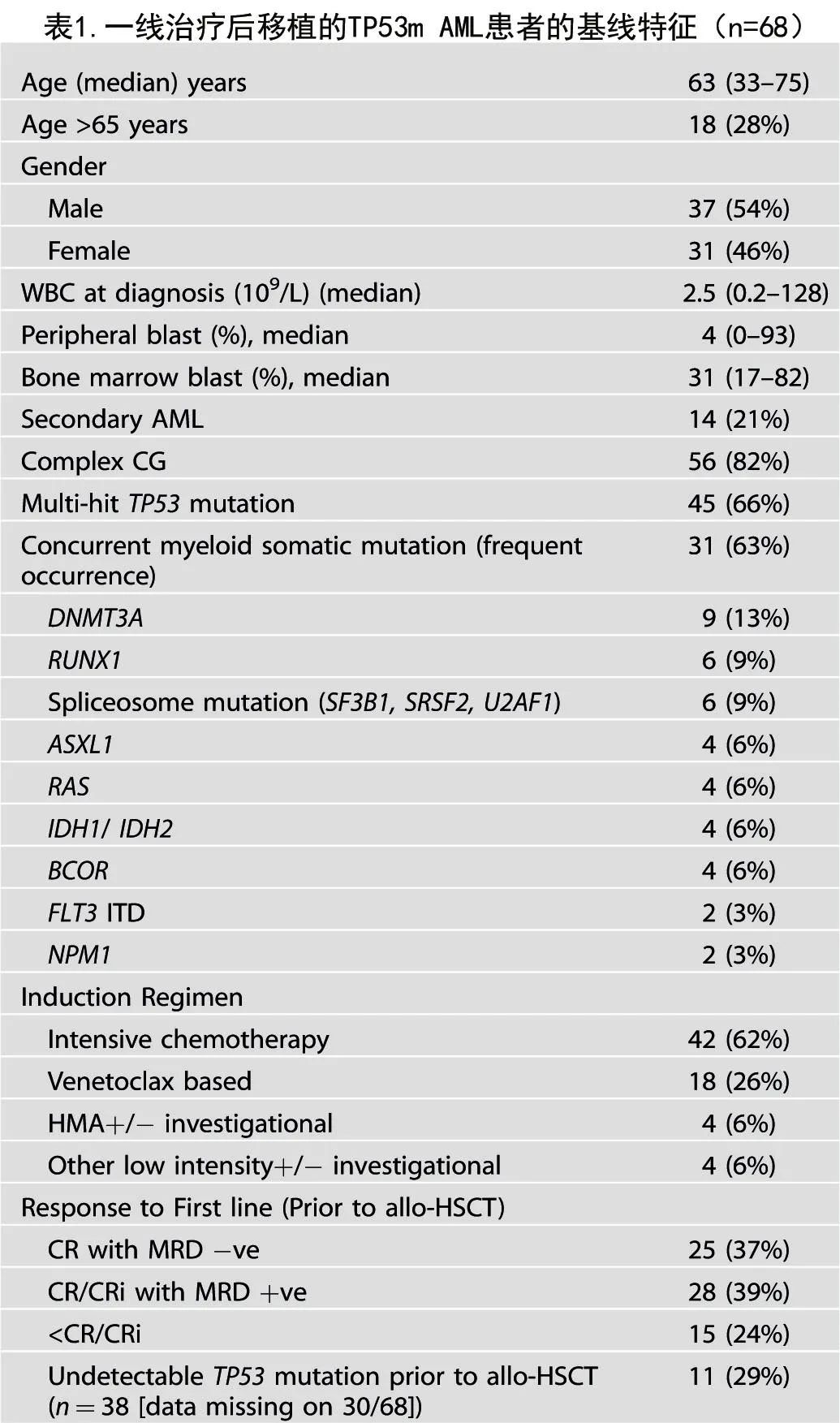
移植患者的基线特征
患者中位年龄为63岁,28%的患者年龄≥65岁(表1)。21% (n=14) 的患者为继发性AML,82% (n=56) 为复杂细胞遗传学,66% (n=45) 伴多打击TP53m。在 allo-HSCT 前的治疗方面,62%的患者接受了强化化疗,26%接受了去甲基化药物 (HMA) 加维奈克拉,6%接受了HMA +/-试验用药物,6%接受了其他低强度治疗+/-试验用药物。53例 (76%) 患者在CR/CRi接受allo-HSCT,11例 (29%) 在 allo-HSCT 时 TP53m 未检测到(30/68例 [44%] 患者的系列突变数据缺失)。
移植特征和D100缓解
25% (n=17) 的患者的异基因移植物来源来自匹配亲缘供者 (MRD),56%(n = 38) 的患者来自匹配无关供者 (MUD),18%(n = 12) 的患者来自单倍体相合(单倍型)供者,1%的患者来自脐带血 (n=1)。43%接受清髓性预处理 (MAC),57%接受低强度预处理 (RIC)。18% (n=12) 的患者在 allo-HSCT 后接受去甲基化药物维持治疗。急性移植物抗宿主病 (GVHD) 发生率为37%,慢性 GVHD 为44%。7% (n=5) 的患者发生3-4级急性GVHD,16% (n=11) 的患者发生中-重度慢性GVHD(表2)。在 allo-HSCT 后D100,78% (n=53) 的患者达到CR/CRi。
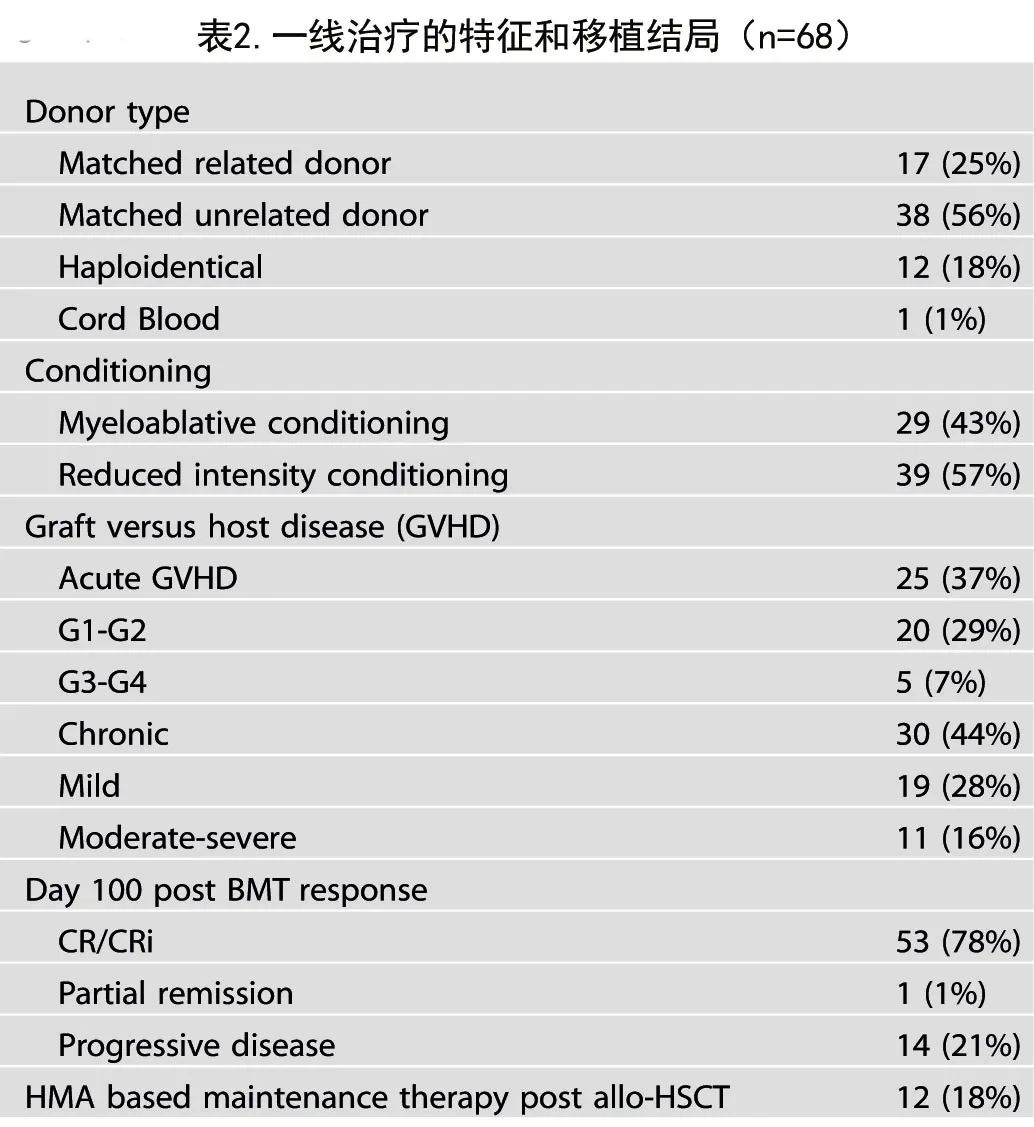
生存
中位无事件生存期 (EFS) 为12.4个月,中位总生存期 (OS) 为24.5个月。首次诱导后接受allo-HSCT的患者中位 EFS 为14.6个月,而挽救后接受allo-HSCT的患者为8.9个月(p=0.19;图2),对应的中位OS分别为30.5个月和20.2个月(p=0.01;图2)。
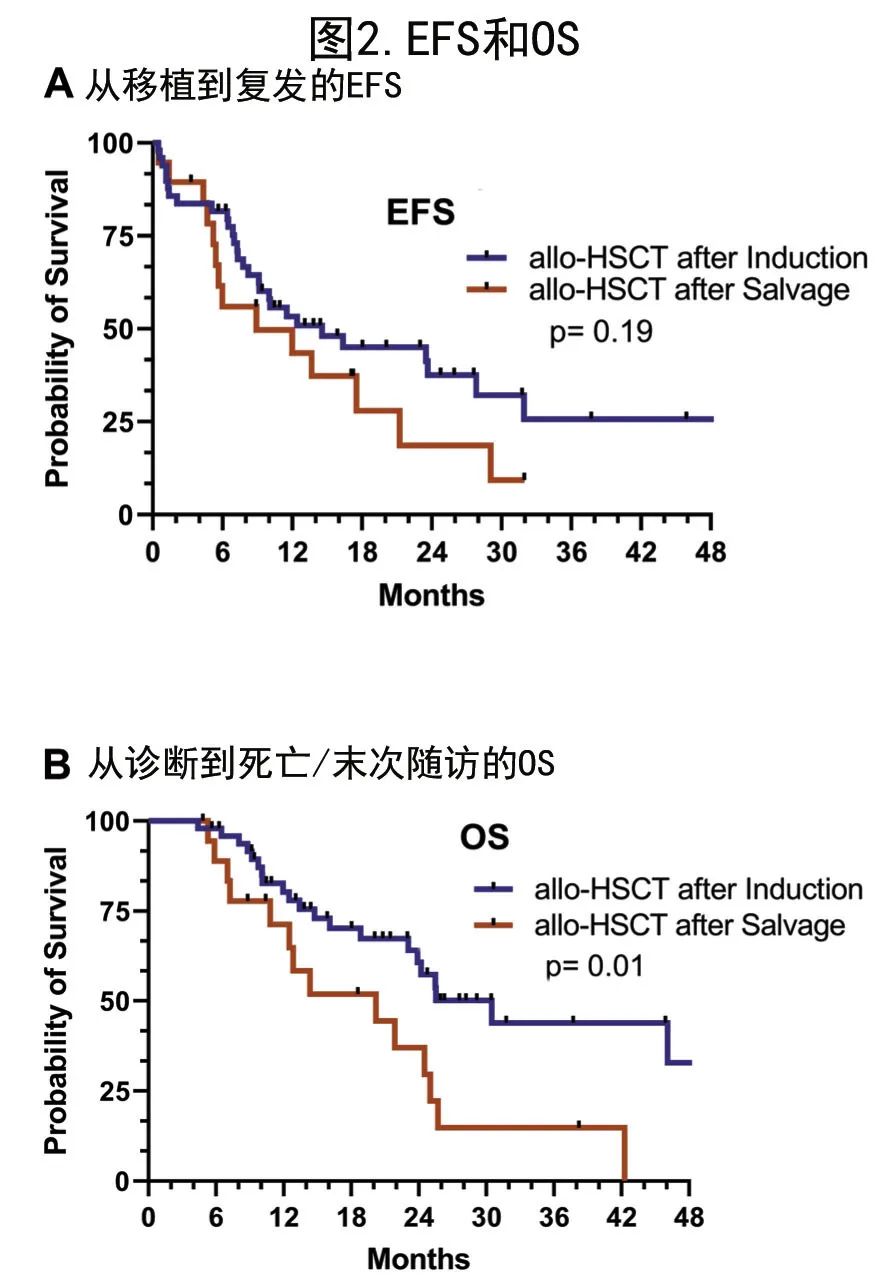
EFS的单变量和多变量分析
在 EFS 的单变量分析中,allo-HSCT前达到MRD阴性CR具有EFS 更好的趋势(16.37 vs 4.62个月,p=0.07);而下列因素与EFS(月)数值更长相关未达到统计学显著性:无白血病证据的移植 vs 持续性疾病 (14.57 vs 5.07,p=0.62)、allo-HSCT前TP53m状态未检测到(16.37 vs 5.07个月,p=0.38)、首次诱导后 allo-HSCT vs 挽救治疗后移植 (14.57 vs 8.93,p=0.19)、RIC vs MAC(16.37 vs 10.0个月,p=0.61)、治疗相关AML(22.1 vs 12.0,p=0.22)和发生急性GVHD (23.67 vs 9.30,p=0.11)。此外allo-HSCT 后D100评估处于CR/CRi(vs 疾病复发)(17.53 vs 5.55个月,p≤0.001)或发生慢性GVHD(23.67 vs 7.0个月,p=0.001)的患者中位 EFS 显著更好(图3)。
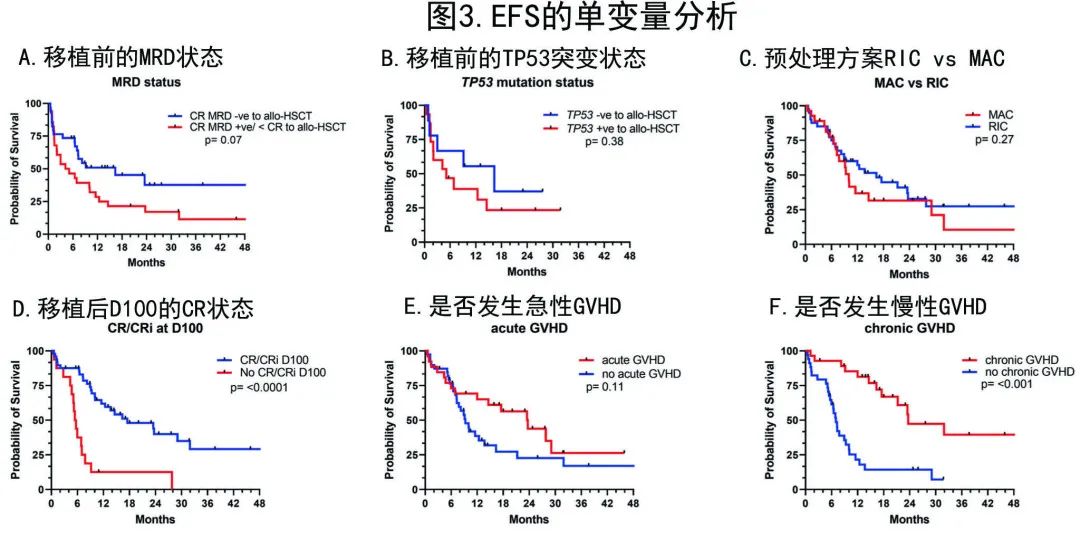
在 EFS 的多变量分析中,allo-HSCT后D100的CR/CRi (HR=0.24,p=0.001) 和发生慢性GVHD (HR=0.21,p≤0.001) 仍保留利于EFS的显著性(表3A)。
OS的单变量和多变量分析
首次诱导后接受 alloHSCT 的患者的中位 OS 显著优于挽救治疗的患者(30.5个月vs 20.2个月,p=0.01),allo-HSCT后D100评估CR/CRi vs疾病复发(25.73个月vs 12.87个月,p = 0.003)或发生慢性 GVHD 的患者(46.1个月vs 14.37个月,p=0.0001)的OS同样显著更优,而下列因素未显示OS改善的显著性:治疗相关AML(未达到vs 25.0个月,p=0.93)、allo-HSCT前MRD阴性CR(25.47 vs 24.53个月,p=0.71)、移植前无白血病证据vs 持续性疾病 (25.03 vs 13.43,p=0.32)、allo-HSCT前TP53m状态未检测到(30.5 vs 25.03个月,p=0.53)、RIC vs MAC(24.47 vs 18.83个月,p=0.21)和发生急性GVHD (30.50 vs 23.07,p=0.20)(图4)。
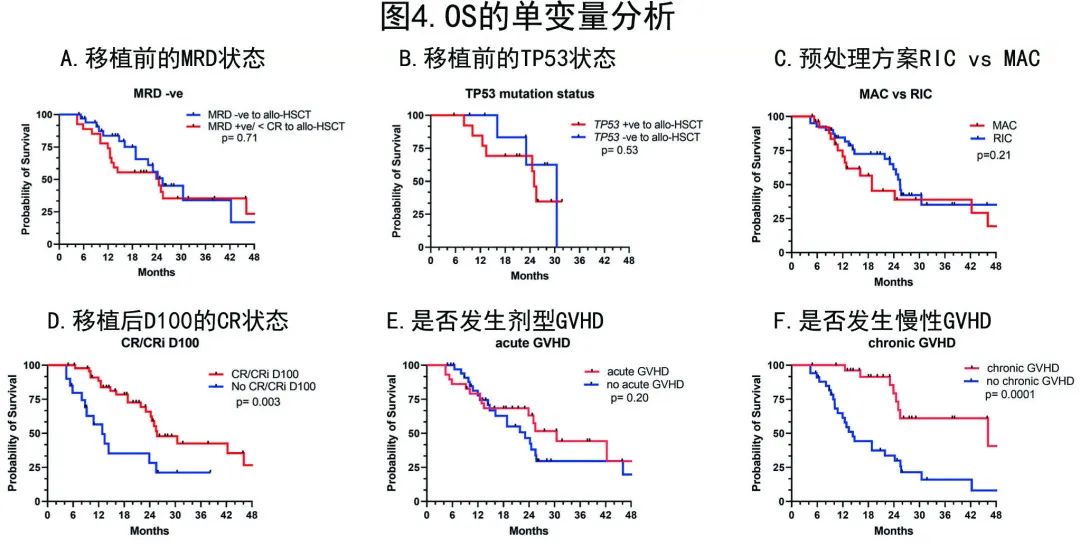
在 OS 的多变量分析中,allo-HSCT后D100 CR/CRi (HR=0.22,p≤0.001) 和发生慢性GVHD (HR=0.34,p≤0.007) 仍保留利于OS的显著性。而首次诱导后 allo-HSCT 与挽救治疗后移植相比的OS不具有显著性 (HR=1.41,p=0.34)(表3B)。

本研究表明,TP53m AML患者在首次诱导或挽救治疗后进行allo-HSCT可改善长期结局。在多变量分析中,allo-HSCT后D100完全缓解或发生慢性GVHD的患者可观察到生存期显著改善。应适当选择患者接受有效的诱导策略以达到缓解而无明显毒性,并在allo-HSCT后进行密切监测。
参考文献
Talha Badar ,et al. Survival of TP53-mutated acute myeloid leukemia patients receiving allogeneic stem cell transplantation after first induction or salvage therapy: results from the Consortium on Myeloid Malignancies and Neoplastic Diseases (COMMAND).Leukemia . 2023 Feb 18. doi: 10.1038/s41375-023-01847-7.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言