降脂近50%!JACC:siRNA长效疗法,打四针,疗效维持近1年
2024-08-29 医学新视点 医学新视点
olpasiran可持久降低Lp(a)水平。接受每12周一次≥75 mg剂量的参与者在末次给药后近一年内,Lp(a)水平仍显著降低约40%-50%。
脂蛋白(a)[即Lp(a)]由低密度脂蛋白样颗粒和载脂蛋白a[Apo(a)]组成。Lp(a)水平与动脉粥样硬化以及钙化性主动脉瓣狭窄具有因果关联。Lp(a)全球截点值为50 mg/dL,有14亿人(约1/5)的Lp(a)高于≥50 mg/dL。《中国血脂管理指南(2023年)》推荐以30 mg/dL作为中国人群Lp(a)的风险截点值。中国的Lp(a)相关流调与人群分布数据显示,30.6%的人群≥30 mg/dl,其中>50 mg/dl的比例更低。然而,目前尚无疗法获批用于降低Lp(a)。
Olpasiran是一种小干扰RNA(siRNA)分子,可通过破坏载脂蛋白(a)基因的表达,从而阻止脂蛋白(a)颗粒在肝细胞中的生成。2期OCEAN(a)-DOSE研究结果显示,每12周一次(共给药4次)使用较高剂量的olpasiran可使Lp(a)水平在治疗第36周时降低超过95%,且在治疗期第48周时维持这种治疗效果。然而,使用olpasira后,Lp(a)水平的长期控制效果尚不明确。
近日,OCEAN(a)-DOSE研究的长期数据发表于JACC。结果显示,olpasiran可持久降低Lp(a)水平。接受每12周一次≥75 mg剂量的参与者在末次给药后近一年内,Lp(a)水平仍显著降低约40%-50%。

截图来源:JACC
该研究报告了2期OCEAN(a)-DOSE停药期延长随访数据。OCEAN(a)-DOSE是一项关于olpasiran的多中心、随机、双盲、安慰剂对照、剂量探索研究,在7个国家的34家医学中心进行,纳入了281例年龄在18-80岁、伴有动脉粥样硬化性心血管疾病史、Lp(a)水平超标(>150 nmol/L[该指标的另一种报告单位])的参与者。基线时参与者的中位Lp(a)水平为260 nmol/L。
符合条件的参与者以1:1:1:1的比例被随机分配接受不同剂量的olpasiran皮下注射(每12周一次10 mg、75 mg、225 mg,共4次,最后一次注射为第36周;或每24周一次225 mg,共2次,最后一次注射为第24周)或安慰剂治疗。治疗期为48周,治疗期结束后再对参与者进行至少24周的延长随访。
共有272例参与者在第72周或84周的随访中完成了研究。研究的中位暴露时间(治疗期结合停药期)为86周。数据分析显示:
对于每12周一次不同剂量的给药方案,olpasiran对Lp(a)水平的影响在第36周末次给药时和第48周治疗结束时相似。10 mg、75 mg、225 mg(每12周1次)剂量组参与者经安慰剂校正的Lp(a)水平降低幅度分别为68.5%~70.5%、97.4%~96.1%和101.1%~100.9%(P值均<0.001)。
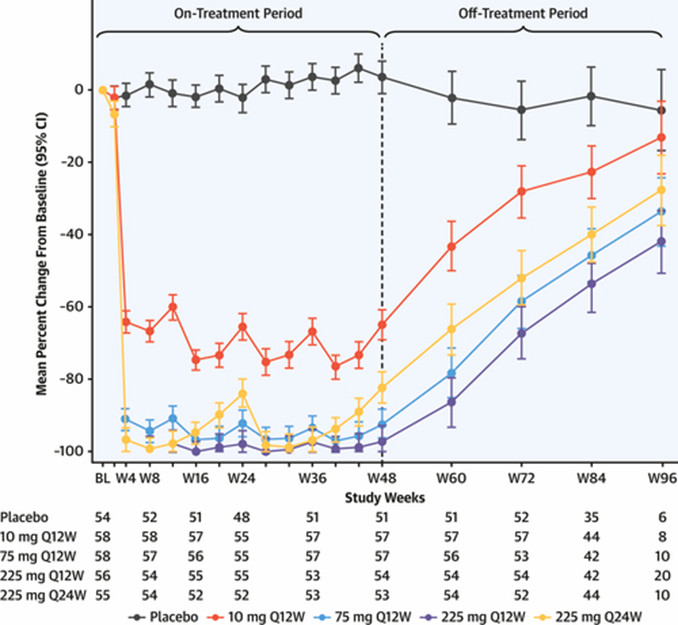
▲Olpasiran治疗开始和结束时Lp(a)水平的变化(图片来源:参考资料[1])
第60、72、84和96周时,相较于基线,安慰剂组Lp(a)水平仅略有降低约2%~5%。相比之下,停药后olpasiran组的Lp(a)水平显著降低。具体来看:
-
对于每12周一次10 mg剂量组,参与者停药后在第60、72、84和96周时,经安慰剂校正的Lp(a)水平降低幅度分别为41.0%、22.7%、21.0%和7.6%(P值均<0.001)。
-
对于每12周一次75 mg剂量组,上述指标水平降低幅度分别为76.2%、53.0%、44.0%和27.9%(P值均<0.001)。
-
对于每12周一次225 g剂量组,上述指标水平降低幅度分别为84.4%、61.6%、52.2%和36.4%(P值均<0.001)。
-
对于每24周一次225 g剂量组,上述指标水平降低幅度分别为64.2%、46.5%、38.3%和22.1%(P值均<0.001)。
从安全性方面来看,在延长期随访阶段,没有发现新的安全问题。Olpasiran各剂量组和安慰剂组之间参与者不良事件和严重不良事件的总体发生率相似。Olpasiran的不良药物反应主要为注射部位轻度至中度的局部疼痛、瘀伤和红斑。此外,未观察到全身性过敏反应。
总之,在停药1年后,各剂量组的Lp(a)水平均保持了降低效果并逐渐恢复至基线,且长期安全性良好。在最后一次给药6个月后(第60周),每12周一次接受较高剂量(75 mg/225 mg)olpasiran治疗的参与者Lp(a)水平仍比安慰剂组低75%以上;和停药近1年时(第84周),这些患者的Lp(a)水平仍显著降低约40%-50%。
近年来,区别于传统降脂药物、通过靶向核酸调节基因表达的降脂疗法蓬勃发展,目前全球已有2款核酸类降脂疗法获批上市,近10款已处于临床中后期研发阶段。其中4款疗法针对新兴降脂靶点Lp(a),大多通过调节Apo(a)来起作用;此外,通过调节载脂蛋白C3(APOC3)来降低甘油三酯、通过调节血管生成素样蛋白3(ANGPTL3)降低多种脂质,也是常见策略。此外,相较于传统小分子药物,这些核酸类降脂疗法普遍更长效,有助于在一定程度上简化患者血脂管理。
全球已上市、处于临床试验2期及以后且研发状态活跃的核酸类降脂疗法
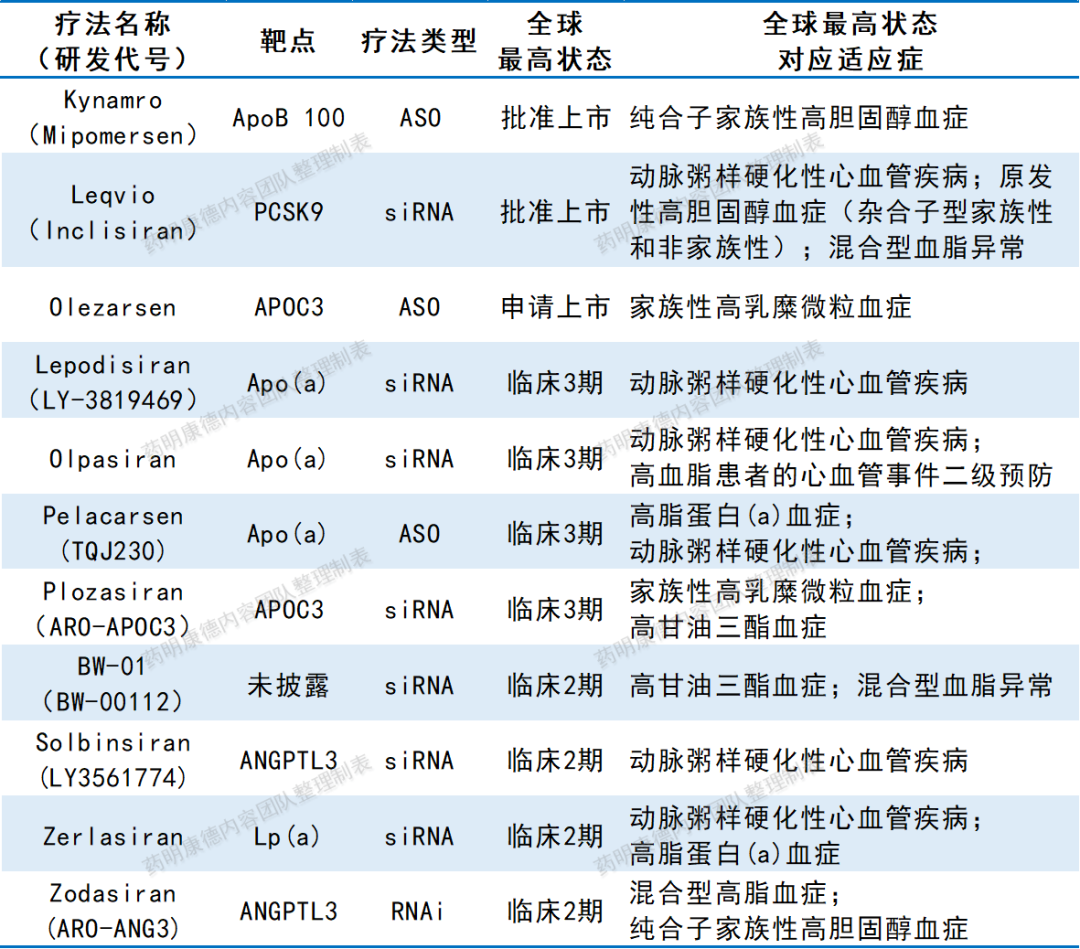
注:本表由药明康德内容团队根据公开资料梳理,为不完全统计,数据截至2024年8月26日。如有遗漏,欢迎补充。
期待这些疗法的积极研发进展将帮助更多患者血脂达标,改善心血管疾病风险。
参考资料
[1] O’Donoghue, et al. The Off-Treatment Effects of Olpasiran on Lipoprotein(a) Lowering: OCEAN(a)-DOSE Extension Period Results. JACC. 2024 Aug, 84 (9) 790–797.https://doi.org/10.1016/j.jacc.2024.05.058
[2] 中国血脂管理指南修订联合专家委员会.中国血脂管理指南(2023年)[J]. 中华心血管病杂志,2023,51(3):221-255.
作者:医学新视点
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#动脉粥样硬化# #脂蛋白(a)# #Olpasiran#
41