天价神药“CAR-T”首例患者已出院,第二款也获批!
2021-09-05 MedSci原创 MedSci原创
9月3日,国家药监局(NMPA)官网公示,药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)已正式获批。
9月3日,国家药监局(NMPA)官网公示,药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)已正式获批。瑞基奥仑赛注射液此次获批的适应症为:用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。
这是药明巨诺首款获批上市的创新产品,成为中国第二款获批的CAR-T产品,也是中国首款1类生物制品的CAR-T产品。
今年以来,国内CAR-T产品发展迅速,在短短3个月之间,已有2款CAR-T产品获批上市。
中国第一款获批的CAR-T产品是复星凯特公司的奕凯达(阿基仑赛注射液),在今年6月份刚上市。用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤的成人患者。
据网传药品销售订单显示,奕凯达零售价为120万元/袋(约68ml)。
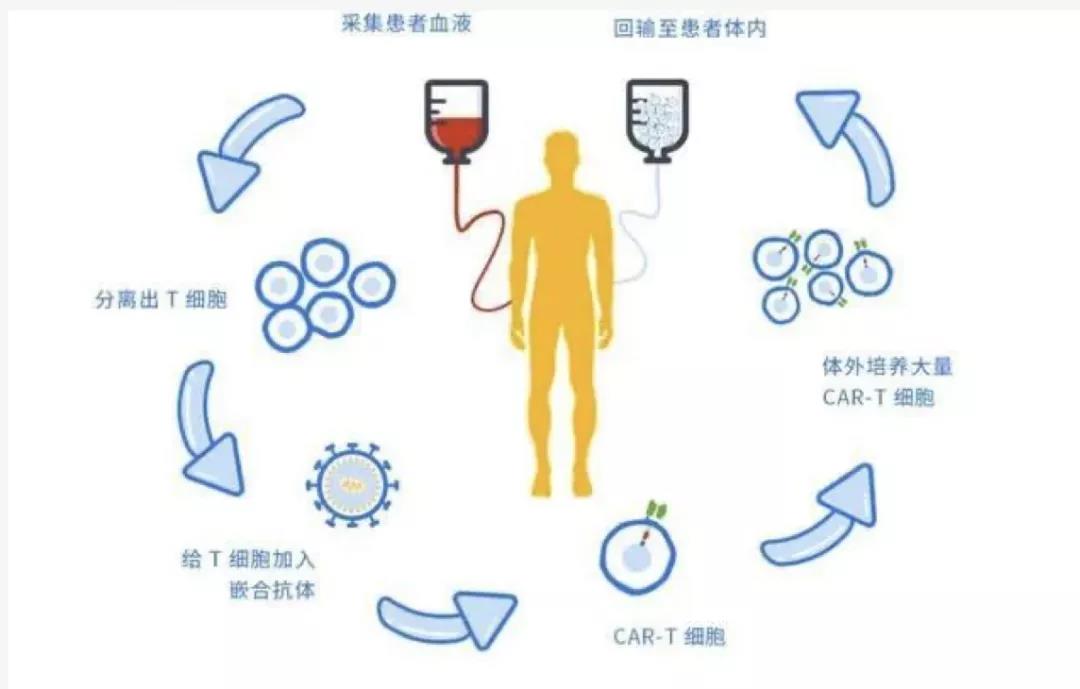
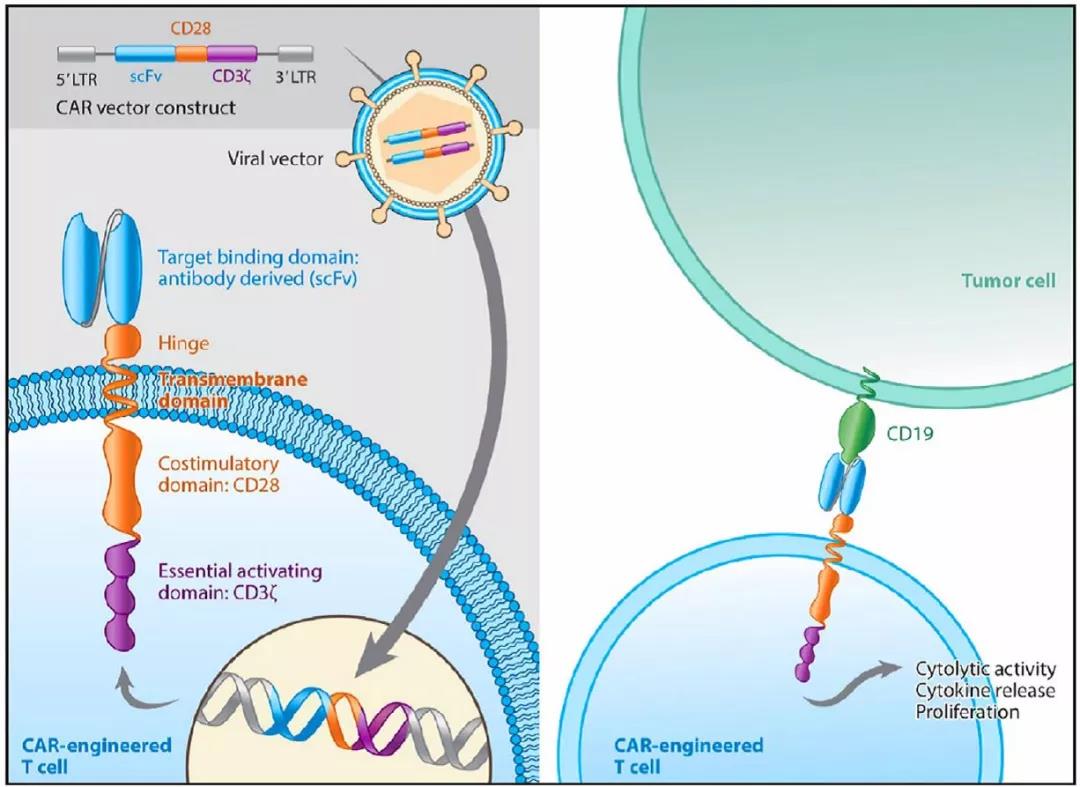
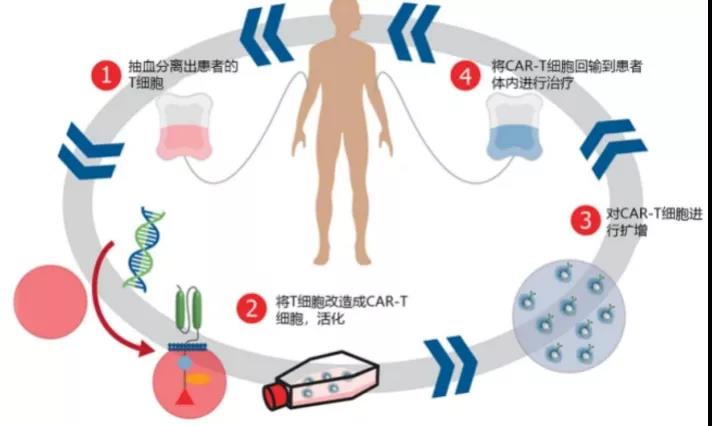
120万的天价药,效果如何?

版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#CAR-#
27
吼吼吼
51
阅读打卡
60
认真学习了
63
感谢分享
58