科济药业发布2021年中期业绩 自主研发 CAR-T候选品进入海外关键II期临床试验
2021-08-24 科济药业 科济药业
科济药业已在中国、美国和加拿大获得7项CAR-T疗法的IND许可,在中国所有CAR-T公司中排名第一。除了国际化的产品研发布局,公司也在海外积极建设自有产能。
2021年8月23日,科济药业(02171.HK)公布2021年上半年度业绩,就公司近期重要进展和业绩成果进行了分享。上半年,公司全球化布局取得了诸多成果,例如公司CT053顺利进入美国临床II期试验,是少数进入该阶段的中国药企自主研发的CAR-T产品;今年7月,公司首次完成两款CAR-T候选产品对外授权,成功开启国际化合作;公司美国生产设施获得当地政府批准启动建设,自有产能加速落地。
科济药业创始人、董事会主席、首席执行官、首席科学官李宗海博士表示:“这是科济药业继2021年6月18日在香港交易所成功上市后的第一个中期业绩报告。2021年上半年,科济药业在全社会各方的鼎力支持下,在产品管线推进、技术开发、对外合作、生产设施建设等方面取得多项重要进展。科济将一如既往地努力在全球范围内推进临床候选产品,持续开发自主创新技术,为全球癌症患者带来更多创新和差异化的细胞疗法,也为广大投资者和社会创造更多价值”
作为CAR-T细胞疗法领域的主要参与者,科济药业自主开发了11款差异化候选产品,并拥有全球权益。
另一款CT041为全球唯一靶向CLDN18.2的且已获得美国FDA和国家药监局的IND批准并正在进行临床试验研究的CAR-T候选产品,用于治疗胃癌和胰腺癌等实体瘤,已获得FDA及EMA孤儿药产品认定。有望实现CAR-T疗法在实体瘤治疗领域的突破。科济药业将于9月19日ESMO大会上对CT041 中国研究者发起试验(IIT)数据进展进行口头报告。此外,2021年上半年,科济药业已在中国向NMPA提交关键II期研究的咨询申请,并计划于2021年下半年启动关键II期临床试验,2022年下半年就先前至少接受两线系统治疗失败的胃癌患者的治疗提交NDA。在美国,公司计划于2022年对胃癌╱食管胃结合部癌或胰腺癌患者进行关键的II期试验,2023年向美国FDA提交BLA。CT041已获得美国FDA授予「孤儿药」认定,用于治疗胃癌/胃食管结合部癌,并获得EMA授予「孤儿药产品」认定,用于治疗胃癌。
此次对外授权合作是海外市场对科济药业CAR-T产品的肯定,也为公司未来在全球范围内展开更多产品和技术合作打开了良好开端。
目前公司拥有11款候选产品,均为自主研发且拥有全球权益,涵盖常规型、新一代CAR-T 技术及同种异体疗法,布局全面且富有前瞻性。
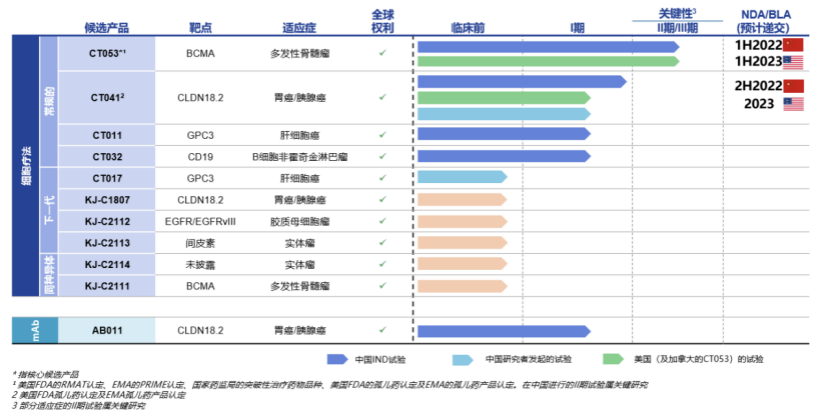
此外,本次中期业绩发布,公司透露,在现有产品管线基础之上,科济将围绕“实体瘤疗效、安全性、患者可及性、靶点可用性”四大研发战略方向,持续开发创新专有技术 (CycloCAR, THANK-uCAR等), 以解决CAR-T疗法领域的主要挑战。例如针对实体瘤疗效问题,公司正在开发下一代CAR-T技术CycloCAR,该技术共同表达细胞因子IL-7和趋化因子CCL21,可能具有更高的临床疗效,并减少对清淋化疗预处理的要求。未来,这些技术平台也将为临床阶段持续提供更多自主研发候选产品。
科济药业已在中国、美国和加拿大获得7项CAR-T疗法的IND许可,在中国所有CAR-T公司中排名第一。除了国际化的产品研发布局,公司也在海外积极建设自有产能。
已经建立了符合GMP标准的内部制造能力,包括质粒、慢病毒载体和CAR-T细胞产品的端到端生产。位于中国上海金山区的商业化生产厂房,取得了中国第一张CAR-T细胞疗法的药品生产许可证,预计每年可支持多达2,000名患者的CAR-T治疗。
2021年上半年,在美国北卡罗来纳州达勒姆市,科济药业已启动生产设施建设,用于临床试验和早期商业化的生产设施建设。
凭借丰富的自研产品管线、自有CAR-T产能及全球化市场布局,公司将持续提高CAR-T产品的生产规模效应,进一步降低每个患者的用药成本,改善CAR-T疗法可及性,最终为全球癌症患者带去创新、差异化、可负担的的细胞疗法。
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#I期临床#
42
#CAR-#
32
#II期临床试验#
38
#海外#
40
#I期临床试验#
37