Bone Marrow Transplant:供体源性抗CD19的CAR-T细胞疗法可安全有效的治疗异体造血干细胞移植后复发的B-ALL
2021-05-02 MedSci原创 MedSci原创
当前,与DLI相比,供体源性抗CD19 CAR T细胞治疗异体造血干细胞移植(HSCT)后复发的B细胞急性淋巴细胞白血病(B-ALL)的有效性和安全性仍不清楚。为此,研究人员进行了一项临床研究,结果已
当前,与DLI相比,供体源性抗CD19 CAR T细胞治疗异体造血干细胞移植(HSCT)后复发的B细胞急性淋巴细胞白血病(B-ALL)的有效性和安全性仍不清楚。为此,研究人员进行了一项临床研究,结果已发表于Bone Marrow Transplant。

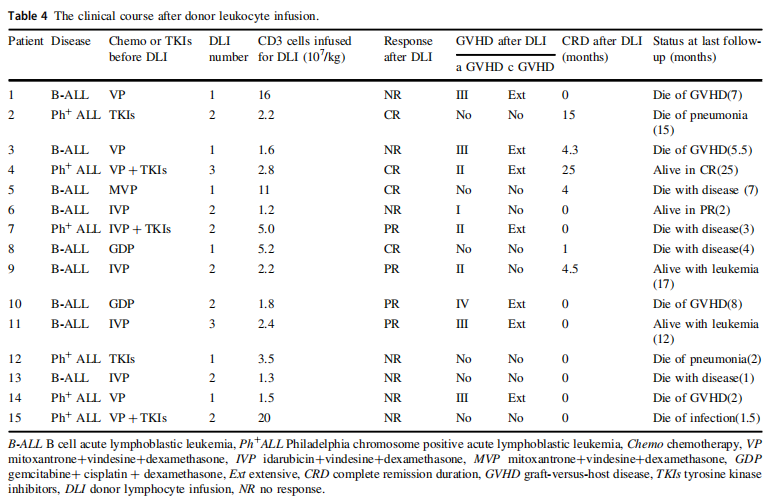
研究中,13名B-ALL患者在异体造血干细胞移植后复发,接受了供体来源的抗CD19 CAR T细胞治疗(研究组),15名B-ALL患者在Allo-HSCT后复发,接受了DLI治疗(DLI组)。
结果显示,研究组的MRD阴性完全缓解率(61.5%)明显高于DLI组(13.3%)(P = 0.02)。研究组和DLI组的完全缓解时间中位数分别为8.0个月(范围为3-25个月)和4.4个月(范围为1-25个月;P = 0.026)。研究组患者的总生存期明显优于DLI组:9.5个月(范围,3-25个月)VS. 5.5个月(范围,1-25个月;P = 0.030)。研究组中有一名患者患有一级急性移植物抗宿主疾病(aGVHD)。而DLI组有5名(33.3%)患者出现III-IV级aGVHD。研究组中有3名患者(23.07%)出现3级或4级细胞因子释放综合征。
综上所述,这项研究表明,供体源性抗CD19的CAR T细胞疗法是治疗异体造血干细胞移植后复发的B-ALL的一种安全有效的疗法,并可能优于DLI。
原始出处:
Jingsheng Hua, et al., Donor-derived anti-CD19 CAR T cells compared with donor lymphocyte infusion for recurrent B-ALL after allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant. 2020 Nov 24. doi: 10.1038/s41409-020-01140-6.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#CAR-#
33
#供体#
38
#Bone#
37
#TRA#
24
#Transplant#
39