山东大学李春霞/澳门大学代云路《AM》:肿瘤细胞内多胺耗竭诱导增强型细胞焦亡与铜死亡用于癌症免疫治疗
2024-09-26 BioMed科技 BioMed科技
山东大学李春霞团队联合澳门大学代云路团队设计了一种基于铜、白皮杉醇和透明质酸的多功能纳米材料。
肿瘤细胞内存在复杂的氧化还原平衡用于提高自身氧化应激的耐受性。鲜为人知的是,多胺(包括腐胺、精胺、亚精胺)作为肿瘤细胞内大量存在的自由基清除剂广泛参与调控细胞内氧化还原平衡。肿瘤细胞高表达多胺会带来很多负面影响,如调节基因表达、逃避免疫检测、促进恶性增殖等。不仅如此,与正常细胞以及免疫细胞相比,肿瘤微环境特异性的缺氧条件下致使肿瘤细胞表现出更强的多胺摄取能力。同时,肿瘤细胞内多胺代谢经常失调,肿瘤细胞内的精氨酸酶2往往高表达可以催化精氨酸反应生成大量鸟氨酸和尿素,鸟氨酸的增加进一步促进多胺的合成。尽管已有临床药物如二氟甲基鸟氨酸用于抑制多胺合成并取得了一定的研究进展,但临床结果仍不尽如人意。
为了克服这一难点,山东大学李春霞团队联合澳门大学代云路团队设计了一种基于铜、白皮杉醇和透明质酸的多功能纳米材料。该材料通过减少肿瘤细胞多胺摄取、抑制多胺合成与增强细胞内多胺消耗全方位实现了细胞内多胺耗竭。一方面,多胺全面耗竭可以造成细胞内线粒体功能障碍和能量供应不足,导致毒性蛋白聚集触发铜死亡。另一方面,多胺耗竭引发的氧化应激可以激活Caspase-1/GSDMD通路以及上调GSDMD的S-棕榈酰化从而诱导增强型细胞焦亡。增强型细胞焦亡以及铜死亡的发生导致肿瘤相关损伤分子模式泄漏,有效逆转肿瘤免疫抑制微环境并激活体内抗肿瘤免疫反应,免疫细胞的募集进一步抑制肿瘤的转移与增殖,具有优异的抗肿瘤治疗效果。该研究以题为“Multifunctional Copper-Phenolic Nanopills Achieve Comprehensive Polyamines Depletion to Provoke Enhanced Pyroptosis and Cuproptosis for Cancer Immunotherapy”的论文发表在最新一期《Advanced Materials》上。

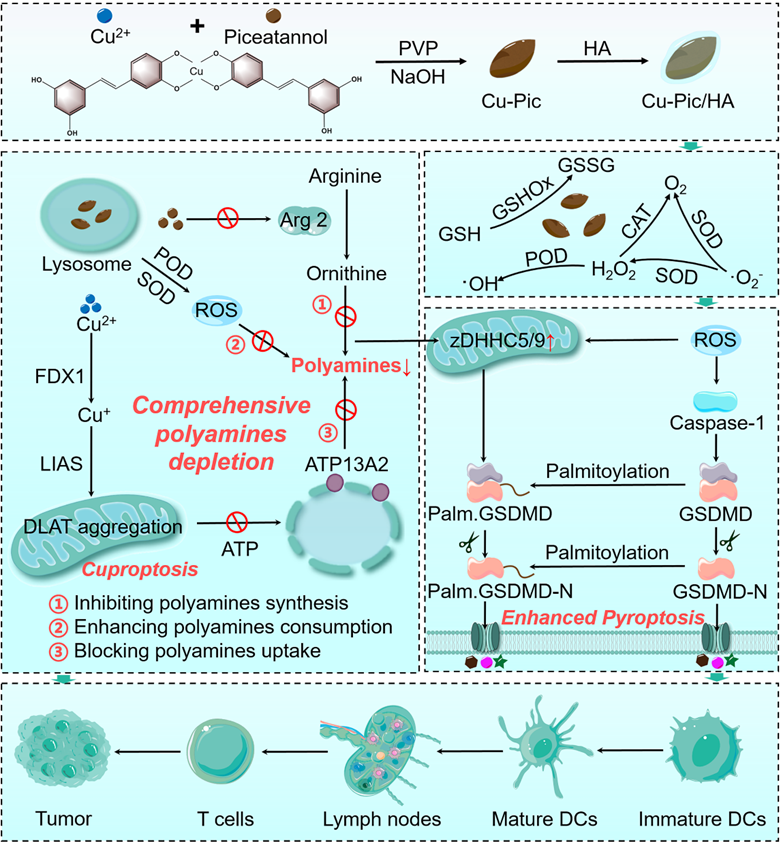
Cu-Pic/HA NPs造成肿瘤细胞内多胺全面耗竭从而诱导增强型细胞焦亡和铜死亡并激活抗肿瘤免疫治疗的示意图。
作者采用一锅法制备Cu-Pic纳米颗粒,表面修饰透明质酸成功合成了Cu-Pic/HA NPs,并通过透射电子显微镜、X射线衍射、X射线光电子能谱、能量散射谱和傅里叶变换红外光谱等技术对材料进行表征,证明材料的成功合成。同时验证了材料的生物可降解特性,表明在抗肿瘤治疗中具备一定的研究潜力。
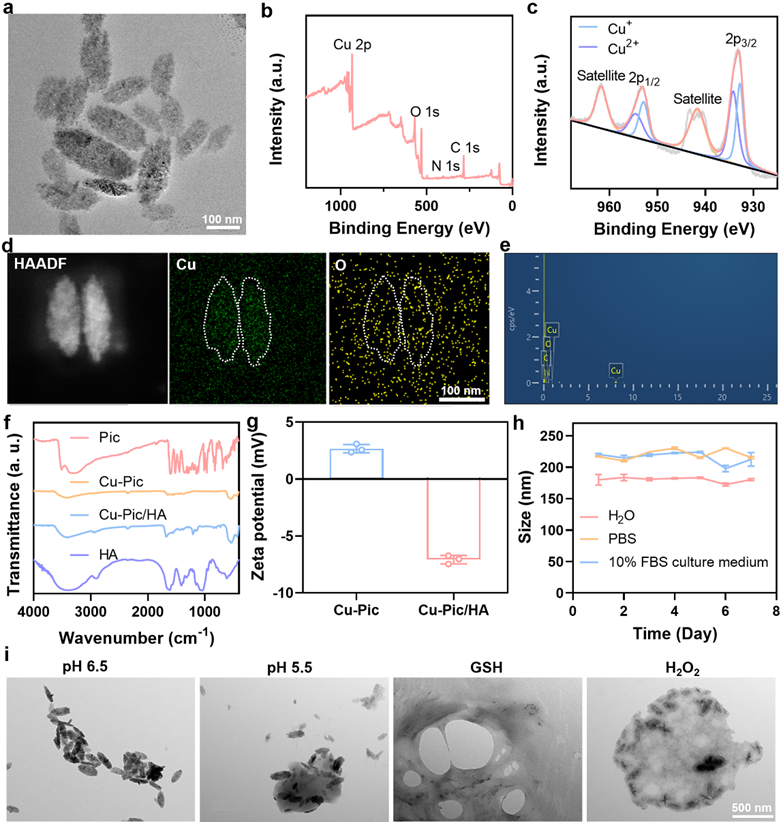
图1. Cu-Pic/HA NPs的材料表征。
Cu-Pic/HA NPs同时具备类超氧化物歧化酶、类过氧化氢酶、类过氧化物酶以及类谷胱甘肽氧化酶等类酶活性,通过一系列级联催化反应,将低毒O2•-和H2O2转化为高毒•OH,放大氧化应激。不仅如此,氧化应激的提高可以消耗还原性的多胺,为实现肿瘤细胞内多胺耗竭提供了支撑。
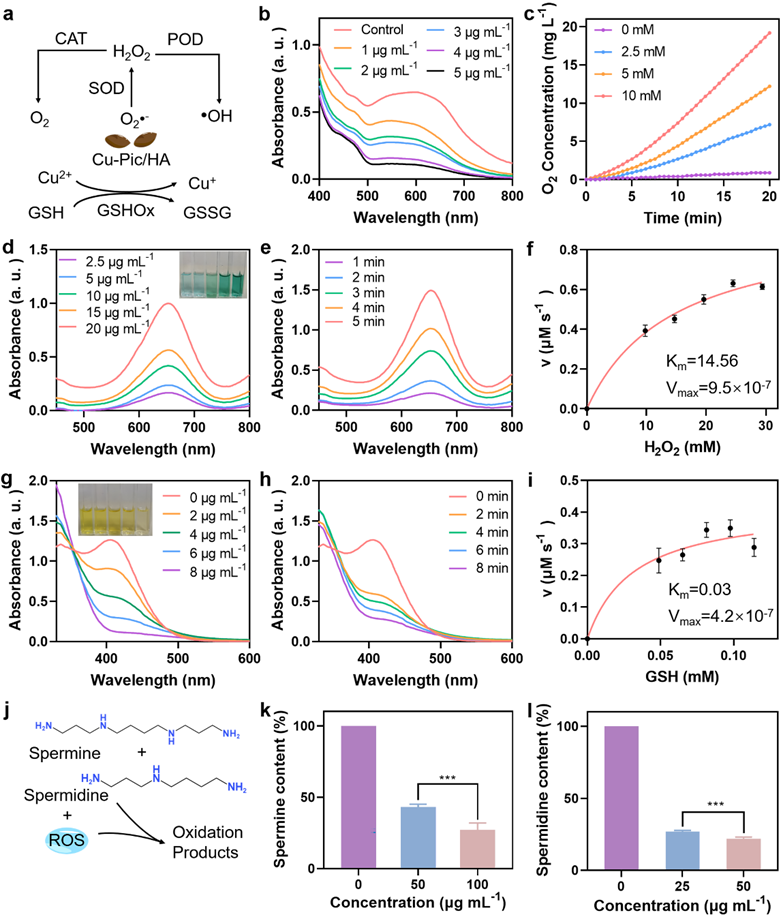
图2. Cu-Pic/HA NPs的多种酶模拟活性以及多胺的氧化。
Cu-Pic/HA NPs可以实现阻断多胺摄取、消耗细胞内多胺和抑制多胺合成从而造成细胞内多胺全面耗竭,严重破坏肿瘤细胞内氧化还原平衡并对肿瘤细胞造成杀伤。首先实验验证Cu-Pic/HA NPs可以被4T1细胞有效内吞。共定位实验证明材料进入细胞先进入溶酶体,随着时间积累,因材料的生物可降解特性导致溶酶体会受到严重破坏。位于溶酶体上的多胺转运蛋白ATP13A2负责将多胺从溶酶体输入到细胞质中。溶酶体的破坏降低ATP13A2的表达从而对细胞内多胺的运输造成沉重的打击,肿瘤细胞多胺摄取能力的减弱为实现细胞内多胺全面耗竭迈出坚实的第一步。其次,Cu-Pic/HA NPs可以产生大量ROS造成细胞内氧化还原平衡失衡从而消耗细胞内大量的多胺。最后,线粒体内的精氨酸酶2作为细胞内合成多胺的上游关键性催化酶,可以催化精氨酸反应生成鸟氨酸和尿素。鸟氨酸是直接催化合成细胞内多胺的唯一底物,白皮杉醇可以有效抑制精氨酸酶2的活性,间接抑制了多胺的合成。线粒体内多胺含量的减少造成线粒体内ROS的积累为后续铜死亡以及增强型细胞焦亡的发生埋下伏笔。
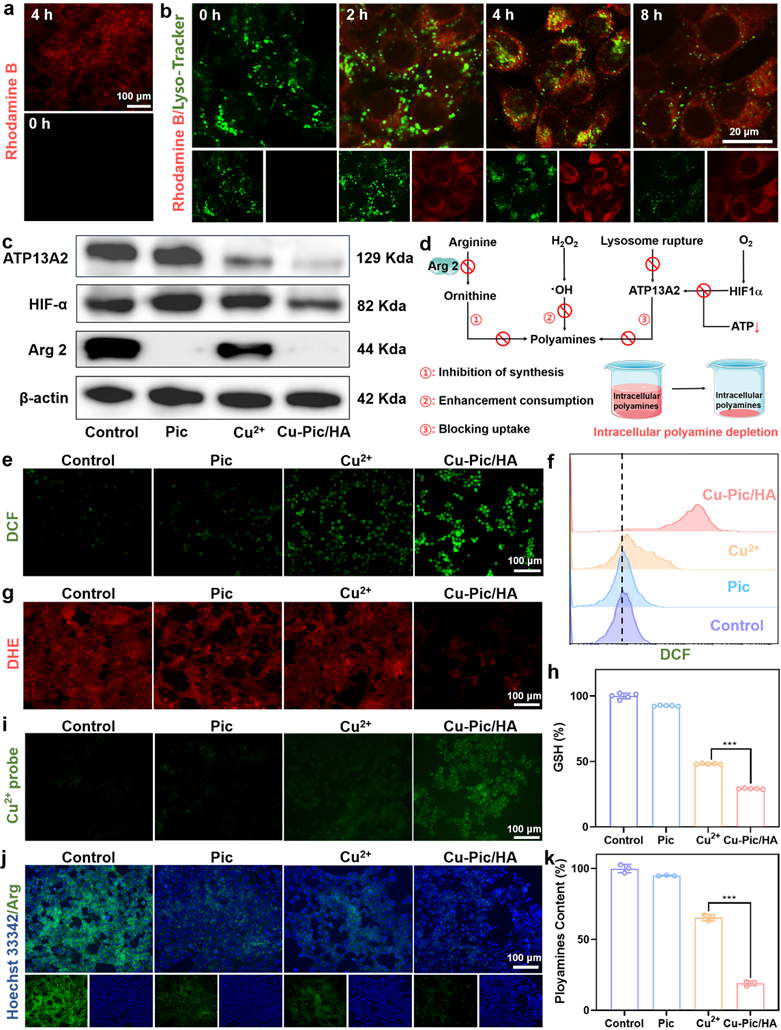
图3. 细胞内多胺全面耗竭的机制。
Cu-Pic/HA NPs抑制线粒体内多胺的合成造成线粒体内ROS积累,导致线粒体功能受损。铜离子进入线粒体会干扰三羧酸循环的正常运行,首先会降低硫辛酸合成酶和铁氧还蛋白1的表达。然后铜离子与硫酰化的二氢硫代酰胺S-乙酰转移酶相连,导致细胞内毒性蛋白聚集,触发铜死亡。
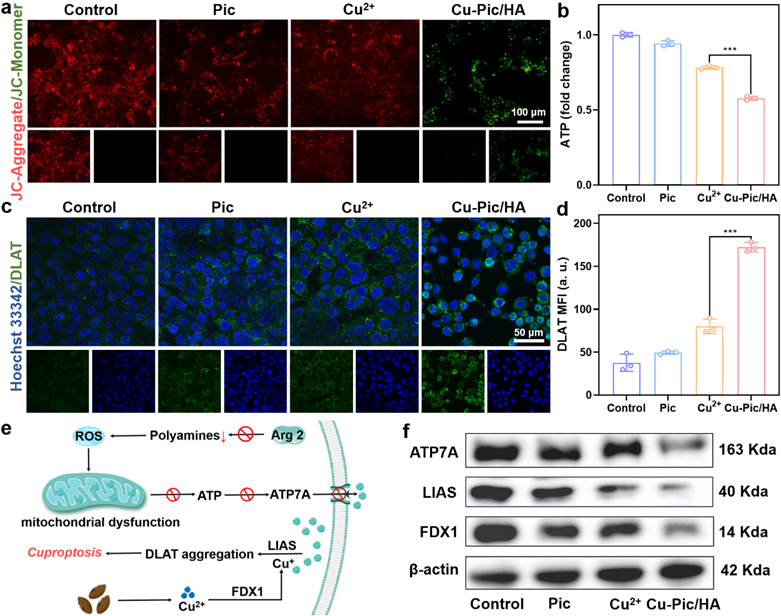
图4. 铜死亡发生的机制。
Cu-Pic/HA NPs与4T1细胞共孵育出现明显的细胞膜破裂并伴随鼓泡产生。Cu-Pic/HA NPs造成细胞内氧化应激升高从而募集炎症小体NLRP3并激活Caspase-1裂解GSDMD,造成细胞膜穿孔。不仅如此,Cu-Pic/HA NPs通过抑制线粒体内多胺的合成,造成线粒体内多胺含量的下降促进线粒体内ROS的积累,提高zDHHC5和zDHHC9的表达从而诱导GSDMD和GSDMD-N的棕榈酰化增强细胞焦亡。
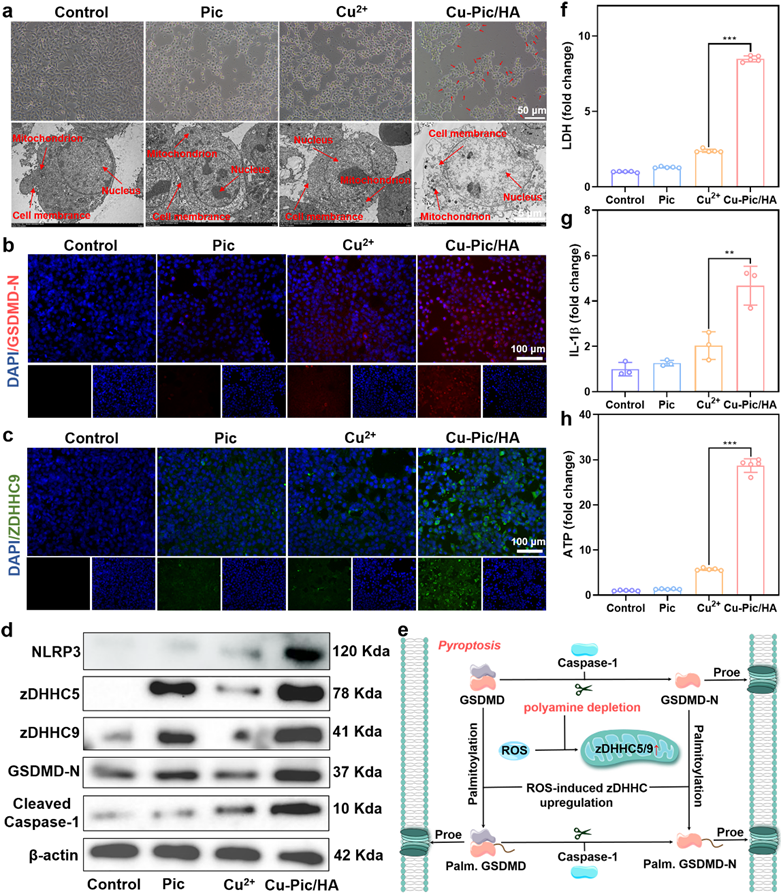
图4. 增强型细胞焦亡发生的机制。
Cu-Pic/HA NPs造成细胞内多胺全面耗竭诱导增强型细胞焦亡和铜死亡的发生,可以有效杀死肿瘤细胞并逆转肿瘤免疫抑制微环境从而激活免疫反应。
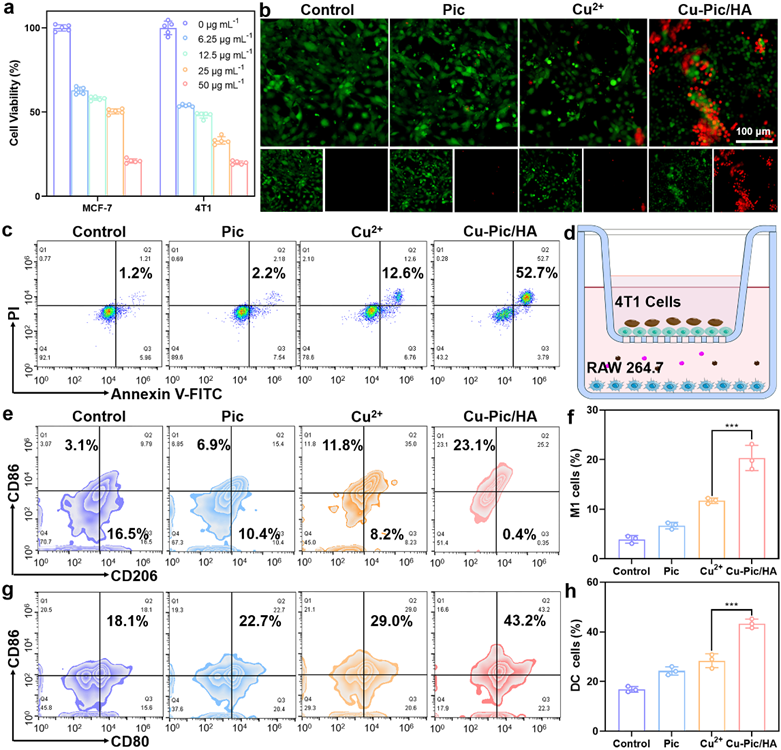
图6. 细胞毒性、巨噬细胞极化和树突细胞成熟。
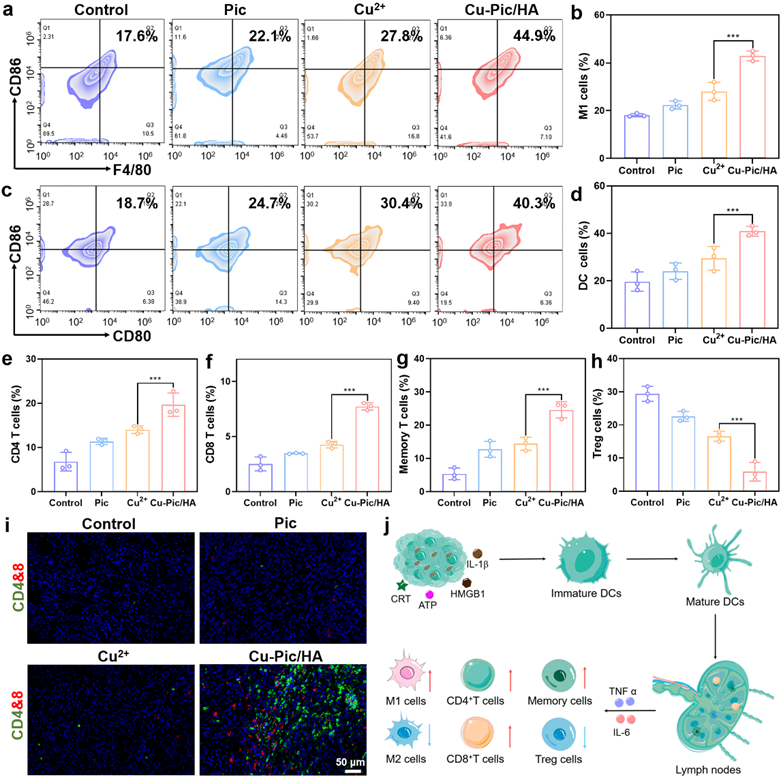
图7. 激活体内免疫反应。
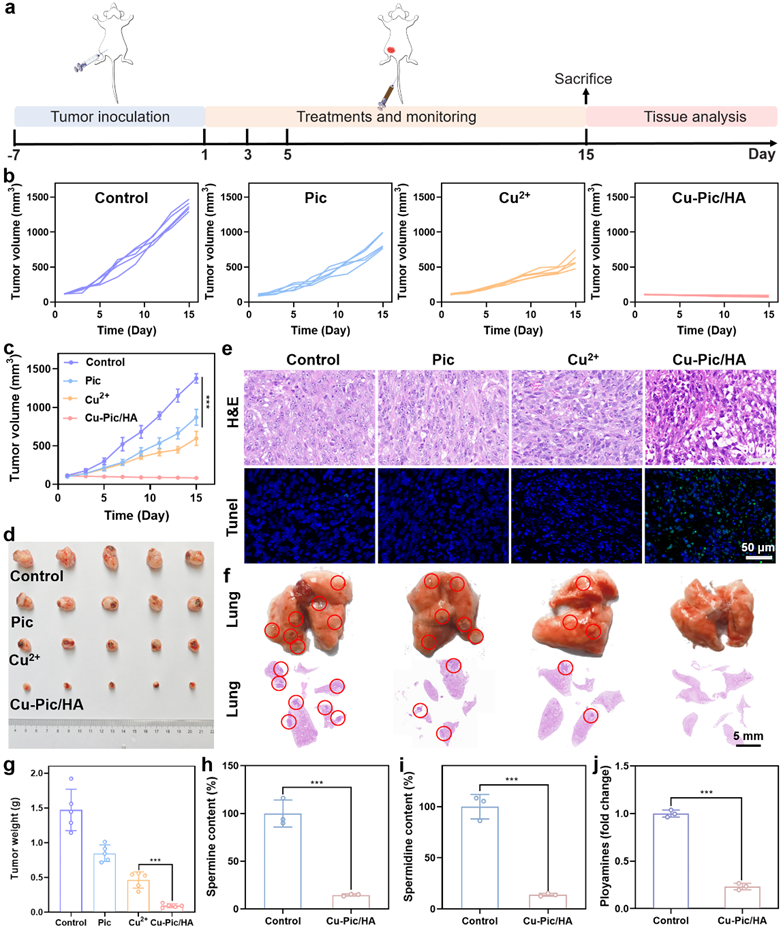
图8. 抗肿瘤治疗效果。
总结:作者设计并合成了铜-白皮杉醇纳米材料,通过抑制细胞内多胺合成,增强多胺消耗以及减少多胺摄取三位一体实现细胞内多胺全面耗竭。细胞内多胺全面耗竭不仅造成线粒体功能障碍,导致毒性蛋白聚集触发铜死亡;而且激活Caspase-1/GSDMD通路以及上调GSDMD的S-棕榈酰化从而诱导增强型细胞焦亡。这种由细胞内多胺全面耗竭引起的增强型细胞焦亡和铜死亡的治疗策略为癌症免疫治疗提供了一种新的切入点。
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#免疫治疗# #多胺#
88