CD47单克隆抗体初露锋芒!天镜生物多项研发管线产品齐头并进
2021-04-09 K.K MedSci原创
2020年11月,天境生物被《麻省理工科技评论》评选为“50家最聪明的公司”之一。
2020年,一家本土生物制药企业与全球前十大药企艾伯维达成了价值近30亿美元的战略合作,这项“惊动”医药圈的合作,刷新了中国生物制药企业向海外授权交易金额纪录。正是这项合作的达成也让立足中国的天境生物进入到了大众的视野。
天境生物(纳斯达克股票代码:IMAB),致力于创新生物药的靶点生物学研究、抗体工艺及中美临床开发和产品商业化,它为全球范围内需求迫切的癌症治疗领域,提供新型有效的治疗手段。2020年11月,天境生物被《麻省理工科技评论》评选为“50家最聪明的公司”之一。
2021年4月7日,天境生物举办了2021投资人研发日活动,天境生物众多管理层在本次活动中分享了多项重要研发管线的最新进展,并公布了未来的研发策略。
- 首款产品CD38抗体菲泽妥单抗(TJ202)有望于2021年第四季度提交新药上市申请,这是一款用于三线或二线多发性骨髓瘤的治疗的创新药物
- 与艾伯维(AbbVie)共同开发并商业化高度差异化的CD47抗体lemzoparlimab及相关双抗项目
- Lemzoparlimab(TJC4)和Uliledlimab(TJD5)也将在今年迎来多个关键临床里程碑
- 为了保证未来临床供药和符合全球GMP标准的商业化生产,公司已动工建设杭州生产基地
- 为继续保持高速增长的态势,天境生物正在评估在上海证券交易所科创板或香港联交所主板第二上市的可能性
此外,在本次研发日上,天境也着重向大家介绍了TJC4、TJD5和TJ-CD4B 三条管线。
Lemzoparlimab是由天境生物自主研发的、用于治疗多种癌症的创新型CD47单克隆抗体。CD47是一种广泛表达于多种癌细胞表面的糖蛋白,通过与肿瘤吞噬细胞表面SIRPα连接释放“别吃我”信号,阻止巨噬细胞吞噬作用。
Lemzoparlimab(TJC4)通过阻断CD47通路使肿瘤得以被巨噬细胞吞噬,促进抗肿瘤T细胞免疫反应,具有成为肿瘤免疫领域治疗方案的潜力。2020年11月9日,天境生物在第35届癌症免疫治疗学会年会(SITC 2020)线上大会公布了lemzoparlimab的早期临床数据:在实体瘤中观察到单药疗效,且剂量爬坡到30mg/kg仍无血液毒性,表现极佳。
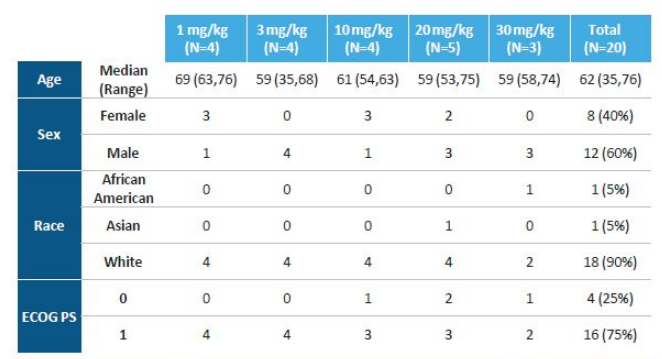
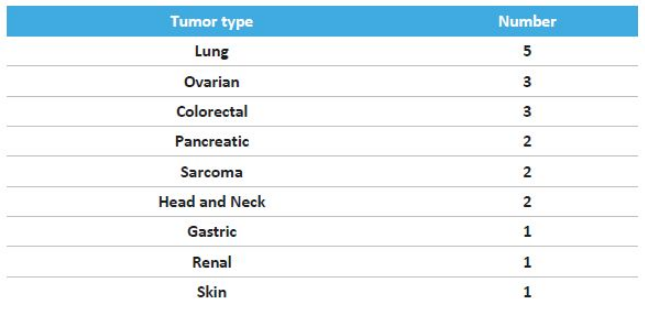
SITC 2020会上, 天境生物公布了lemzoparlimab单药治疗实体瘤初步数据(20例患者),覆盖9个瘤种
在谈到Lemzoparlimab时,天境生物创始人兼董事长臧敬五博士向生物谷的用户们介绍道:“CD47是继PD-1、PD-L1之后最有潜力的靶点之一。但是,这个靶点有一个天然的副作用,就是会引起红细胞的破坏。在临床可以看到,很多病人用药后会有严重贫血。天境生物从2016年成立之初就开始做CD47抗体项目,并力求攻克这一难点。因为公司的定位是做创新药,所以我们并不是简单地做了一个CD47。从创新的角度,我们找到了一个很重要的创新点,就是要做一个不结合红细胞的CD47抗体。我们通过研发团队的努力,决定做一款有差异化优势的CD47抗体,它只会轻微地结合红细胞,最大程度上能够减少贫血的发生,这和大多数的CD47抗体都不一样。我们在美国的临床试验证明了它的优势,证明了这是一个非常有创新特点的CD47抗体,这也促进了我们跟艾伯维的这次合作。我们对这个产品给予很高期望。”
而Uliledlimab(TJD5),它是天境生物自主研发的一款高度差异化的CD73人源化单克隆抗体。CD73在肿瘤细胞上表达,是一种催化单磷酸腺苷(AMP)向腺苷转化的限速酶,而腺苷在肿瘤微环境中有免疫抑制作用。Uliledlimab以非底物竞争的方式有效的与CD73结合,从而起到降低腺苷水平和提升抗肿瘤免疫细胞活性的作用。目前,天境生物已完成Uliledlimab单药导入及与阿替利珠单抗(泰圣奇®)联用治疗实体瘤的美国Ⅰ期临床研究,并将在2021年美国临床肿瘤学会(ASCO)年会上公布该临床研究的详细数据。
TJ-CD4B,又称ABL111,是一种Claudin 18.2和4-1BB双特异性抗体,能够与表达Claudin 18.2的肿瘤细胞(即胃癌和胰腺癌细胞)结合,并通过4-1BB臂刺激肿瘤内T细胞,其实验设计只在肿瘤参与时激活。TJ-CD4B有效地保持了强大的肿瘤结合特性和抗肿瘤活性,归因于Claudin 18.2抗体和4-1BB抗体的协同作用,同时它最大限度地降低了4-1BB抗体作为药物产生的肝脏毒性和全身免疫毒性。TJ-CD4B由天境和韩国ABL Bio合作开发,2021年3月30日,FDA已批准启动TJ-CD4B/ABL111的Ⅰ期临床试验的研究性新药申请,该Ⅰ期临床试验将评估TJ-CD4B/ABL111在晚期或转移性实体瘤中的安全性、耐受性、药代动力学(PK)和药效学(PD)。
出席本次活动的还有天镜生物首席执行官申华琼博士、首席商务官朱益飞等众多管理层人员,知名业内专家中国科学院院士董晨教授、中国临床肿瘤学会马军教授、北京大学肿瘤医院副院长沈琳教授一并受邀出席并发表重要讲话。
作者:K.K
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CD4#
34
#克隆#
32
#CD47#
96
好
68
#研发#
20