Gastroenterology:釜底抽薪:改变饮食让癌细胞“挨饿”,克服癌症治疗耐药性
2022-12-05 nagashi “生物世界”公众号
此前有研究显示,mTORC1在结直肠癌中高度活跃,但科学家们对于结肠癌是否劫持了营养传感通路来激活主调控因子仍未有结论。
人是铁,饭是钢,一顿不吃饿得慌。而对于“众病之王”——癌症来说,“吃饭”也是它们头等大事,饥饿处理可能成为增强癌症治疗效果的关键。
与人类一样,癌细胞也需要营养才能存活和生长,而mTORC1是细胞中最重要的营养传感分子之一,被称为细胞生长的主调节剂。mTORC1使细胞能够感知不同的营养物质,进而促进细胞生长和增殖,但当营养物质不足时,细胞就会关闭mTORC1、调低营养感应级联,以应对“困难时期”。
值得一提的是,此前有研究显示,mTORC1在结直肠癌中高度活跃,但科学家们对于结肠癌是否劫持了营养传感通路来激活主调控因子仍未有结论。
近日,美国密歇根大学的研究人员在胃肠病学顶级学术期刊 Gastroenterology 上发表了题为:Dysregulated amino acid sensing drives colorectal cancer growth and metabolic reprogramming leading to chemoresistance 的研究论文。
该研究发现,低蛋白饮食阻断了激活癌症生长的主要调节因子的营养信号通路,使得癌细胞进入“虚弱状态”,对化疗和放疗更为敏感,增强癌症疗法的治疗效果。

结直肠癌(CRC)是一种与膳食营养高度相关的恶性肿瘤,而mTORC1有助于肿瘤生长并限制治疗反应。其中,生长因子信号是mTORC1激活的主要机制,但靶向癌源性生长因子信号的治疗耐药表明,细胞中存在着维持mTORC1活性的代偿通路。
一类感应氨基酸的、名为GATOR的复合物可以维持mTORC1的正常运行:当细胞有充足的营养物质时,GATOR2会激活mTORC1;当营养不足时,GATOR1会使mTORC1失活。因此,低蛋白饮食可以通过GATOR复合物阻断mTORC1介导的营养信号通路。
因此,研究团队利用人结肠癌细胞系、临床前肠上皮特异性GATOR1和GATOR2敲除小鼠的结肠炎诱导或散发性结肠肿瘤模型、靶向mTORC1调控因子的siRNA筛选和结直肠癌患者组织来评估氨基酸感应通路在结直肠癌中的作用。
研究团队在细胞和小鼠模型中发现,当GATOR1发生功能缺失突变时,失调的氨基酸感应诱导的mTORC1激活驱动结肠肿瘤的发生,癌细胞生长速度更快。此外,结肠癌患者的组织活检显示,化疗耐药的结肠癌患者往往表现出氨基酸感应失调。
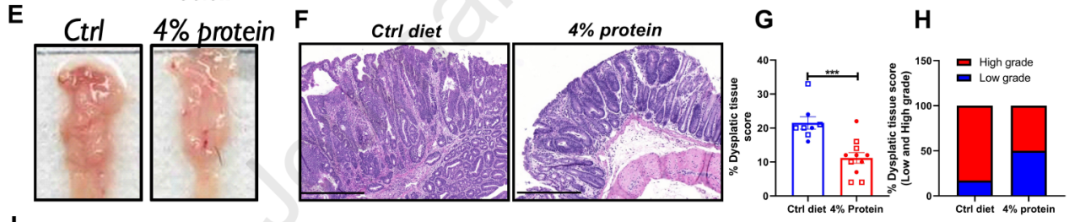
低蛋白饮食抑制结直肠癌生长
这些结果表明,氨基酸感应通路在化疗耐药的细胞重编程中是必不可少的,其表达改变与结直肠癌患者预后不良密切相关,而mTORC的高标记与更多的化疗耐药性和更糟糕的结果相关。
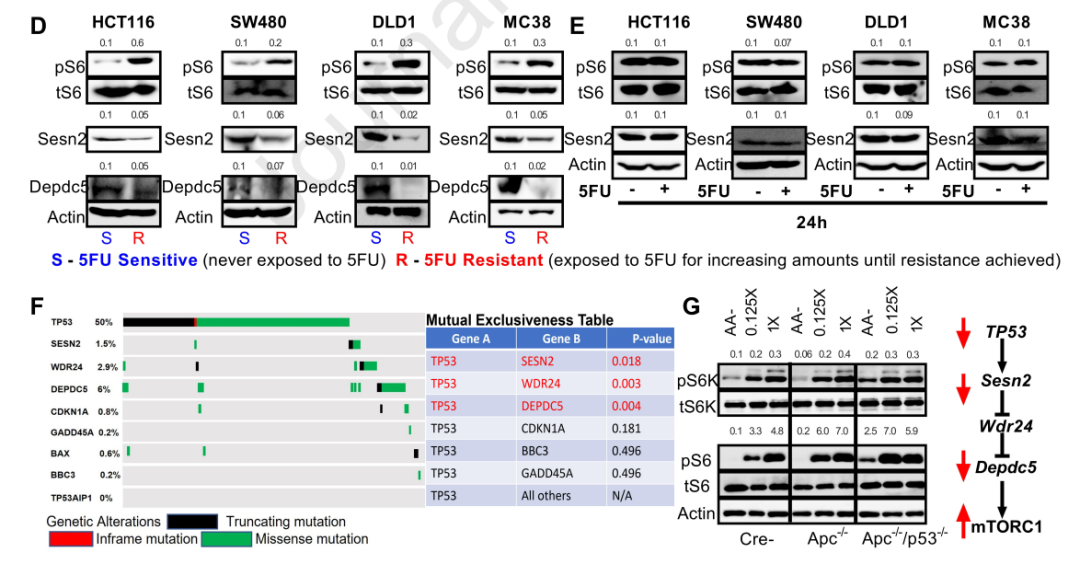
mTORC的高标记与更多的化疗耐药性和更糟糕的结果相关
更有趣的是,当给予细胞和小鼠低蛋白饮食时,限制氨基酸摄入逆转了结直肠癌耐药,由此揭示了结直肠癌细胞的代谢脆弱性。这也为耐药性结直肠癌患者提供了新的治疗机会——“低蛋白饮食+化疗/放疗”的联合治疗方案。
该论文的通讯作者 Yatrik Shah 教授表示:在结直肠癌中,当减少肿瘤中可用的营养时,癌细胞就会变得不知所措,失去生长所必须的营养物质后,它们会经历一种危机,而这会导致大量的癌细胞死亡。
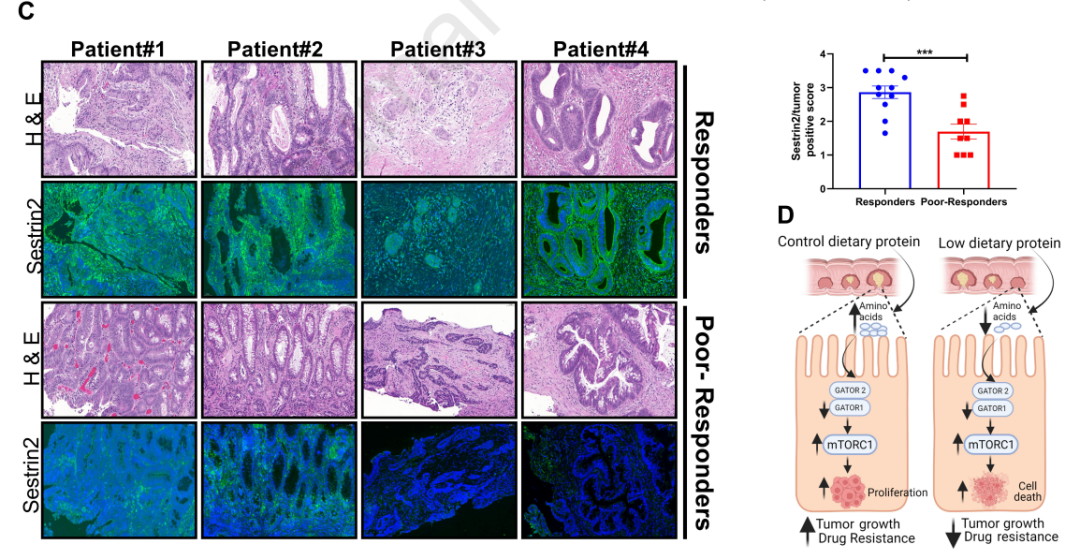
氨基酸感应通路的表达改变与结直肠癌患者预后不良密切相关
但需要注意的,低蛋白饮食也会带来新的风险,即癌症患者通常会出现肌肉无力和体重减轻的情况,而限制蛋白质摄入可能会进一步加剧这种情况。因此,联合治疗方案应当找到合适的、关键的治疗窗口,比如在化疗或放疗开始前,让患者进行一到两周的低蛋白饮食,就有可能提高这些治疗的疗效。
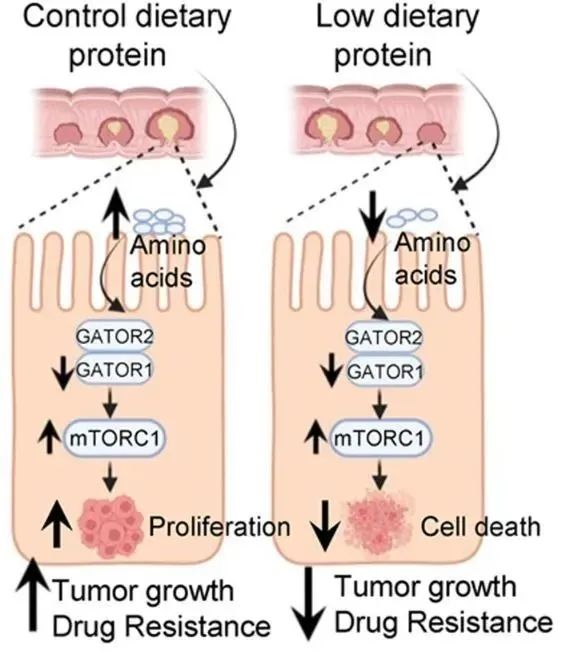
研究模式图:GATOR复合物感应氨基酸并调控mTORC1介导的营养信号通路,影响结肠癌细胞生长和耐药
总的来说,这项研究表明,氨基酸感应通路在驱动结直肠癌的发生发展中起着关键作用,并强调了膳食蛋白质干预在治疗结直肠癌的临床意义。进一步的研究将完善低蛋白饮食的治疗窗口概念。此外,研究团队还将继续了探究营养信号通路是如何影响结直肠癌并使其产生耐药性的,以及是否有一种抑制剂可以阻断GATOR复合物,开发新的癌症治疗方法。
特别提醒:本文仅如是解读最新科研进展,对于癌症患者而言,低蛋白饮食可能会带来新的潜在风险。
原始出处:
Solanki S, et al. Dysregulated amino acid sensing drives colorectal cancer growth and metabolic reprogramming leading to chemoresistance. Gastroenterology, 2022.
作者:nagashi
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







👍
35
👍
35
有趣,低蛋白**认知,同时还告诉你低蛋白的时机!!!
53