山东大学马春红/刘新泳/韩博团队《J Hepatol》:发现肝细胞肝癌的潜在治疗新策略
2024-02-21 BioMed科技 BioMed科技
该研究阐明了HCC微环境中免疫细胞Siglec-9及其配体表达水平及预后相关性,阐明了HCC微环境中免疫细胞Siglec-9及其配体表达水平及预后相关性。
近日,Journal of Hepatology在线发表题为“Increased Siglec-9/Siglec-9L interaction in NK cells predicts poor HCC prognosis and can be a targetable checkpoint for immunotherapy”的研究论文。山东大学基础医学院马春红教授/梁晓红教授、药学院刘新泳教授以及山东大学齐鲁医院病理科韩博教授作为共同通讯作者,博士研究生肖榕、博士后田野为共同第一作者,山东大学为第一作者单位和唯一通讯作者单位。
肝细胞肝癌(HCC)发病率高、死亡率高,是全球第三大癌症相关死亡原因。慢性病毒性肝炎、脂肪肝、肝硬化以及不良生活习惯均会诱发HCC的发生。HCC传统治疗手段主要包括射频消融(RFA)、肝切除(LR)和肝移植(LT),仅适用于少部分早期患者。近年,免疫检查点抑制剂(ICIs)为肝癌的治疗带来了革命性的突破,但总体效率较低(< 20%),并且ICI的作用机制易导致其在全身多器官发生免疫相关不良反应,因此有必要进一步揭示肝癌免疫微环境调控机制,寻找更好的治疗肝癌的免疫检查点靶点及药物。
NK细胞具有强大的杀伤肿瘤细胞的能力,在肝脏中含量丰富。NK细胞表面活化性和抑制性受体的平衡决定NK细胞的功能走向。复杂的肿瘤微环境通过多种因素抑制NK细胞表面活化性受体表达、促进抑制性受体表达,并且增强抑制性受体与其配体的结合,导致肿瘤浸润的NK细胞(TINK)功能失调。异常唾液酸化是多种肿瘤的特性,唾液酸化蛋白可以通过多种方式抑制NK细胞的功能,尤其是可以直接作为NK细胞抑制性受体的配体,限制NK细胞的免疫监视作用,是极具潜力的肿瘤免疫治疗靶点。Siglec是一群特异性表达在免疫细胞表面的、唾液酸化蛋白的受体家族蛋白,近年来作为新兴的免疫检查点受到了广泛的关注,其中Siglec-7和Siglec-9是主要表达在人NK细胞上的两个Siglec家族蛋白,但其在HCC微环境中的空间互作网络及其作为治疗靶点的潜力尚不明确。
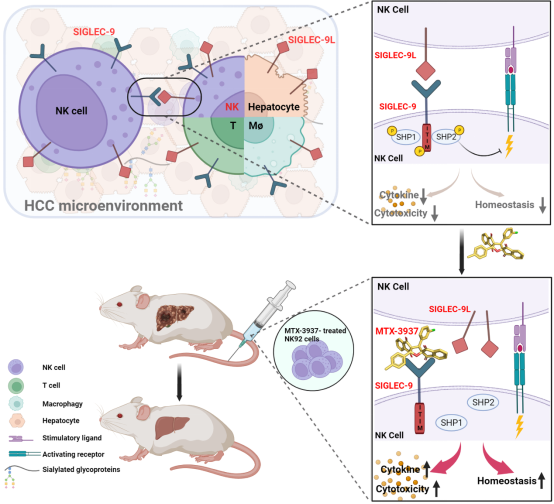
研究团队利用数据库分析和多标记免疫荧光对肝癌临床组织芯片中Siglec-7和Siglec-9与其配体的空间分布特征进行分析,发现Siglec-7在肿瘤浸润的多种免疫细胞上表达下调,Siglec-7配体(Siglec-7L)在癌和癌旁的多种细胞中的表达均无显著差异,并且二者的表达与预后无关。值得注意的是,Siglec-9显著高表达于TINK,且其表达与患者生存率明显负相关;Siglec-9L普遍表达在各种细胞上,尤其在TINK中Siglec-9L阳性细胞比例升高,并且复发患者NK细胞上Siglec-9L的表达水平显著高于非复发患者。进一步分析发现,Siglec-9及其配体的表达呈明显正相关,在肿瘤组织中,与Siglec-9+ NK细胞邻近的配体阳性细胞比例显著提高,并且以NK细胞为主,提示肿瘤微环境内Siglec-9与其配体有更强的相互作用,且该相互作用主要发生在NK细胞之间。以上结果表明Siglec-9/Siglec-9L可作为NK细胞上肝癌免疫治疗的潜在干预靶点。
接下来研究团队基于虚拟对接、生物膜干涉技术(BLI)和表面等离子共振技术(SPR),从306,709个小分子化合物中筛选到一个与Siglec-9结合的小分子化合物MTX-3937。利用NK92细胞系和肝癌患者外周NK细胞及TINK检测证实,MTX-3937与Siglec-9结合并抑制其下游通路、显著提高NK细胞分泌细胞因子和杀伤肿瘤细胞系和患者来源原代肝癌细胞的能力,此外MTX-3937通过抑制NK细胞的凋亡提高其存活能力;动物回输实验进一步证实,MTX-3937显著促进NK细胞功能和稳态、抑制肝癌细胞生长。机制研究发现MTX-3937抑制了NK细胞Siglec-9下游SHP1和SHP2的磷酸化,证明MTX-3937通过抑制Siglec-9及其下游信号通路提高NK细胞的功能。以上结果表明MTX-3937可以作为先导化合物,具有HCC免疫治疗的临床应用前景。
综上,该研究阐明了HCC微环境中免疫细胞Siglec-9及其配体表达水平及预后相关性,阐明了HCC微环境中免疫细胞Siglec-9及其配体表达水平及预后相关性,筛选出具备肝癌治疗潜力的、靶向Siglec-9的小分子化合物MTX-3937,为肝癌免疫治疗提供了新的靶点和策略。
该研究得到了山东大学齐鲁医院检验科赵地、山东第一医科大学附属省立医院肝胆外科王建平和山东大学转化医学共享平台提供的支持。该研究得到国家重点研发计划、国家自然科学基金、山东省泰山学者攀登计划、山东省自然科学基金等项目的资助。
马春红教授团队长期致力于探索肿瘤免疫微环境调控机制及干预策略,相关研究成果发表在Gut, Nat Commun, Hepatology, J Hepatol, J Exp Med, Molecular Therapy, Cancer Res, Cell Mol Immunol, Cell Rep, Signal Transduct Target Ther, Adv Sci, J Immunother Cancer, Sci Transl Med等国际杂志。
刘新泳教授团队长期致力基于靶标结构和多种药物化学策略相结合的药物研究工作,聚焦于抗病毒药物、重大慢性病药物和免疫调节剂的先导发现、优化和药物开发。近年来已有多个抗病毒、抗痛风创新药物实现成果转化,相关成果在J Med Chem等权威期刊累计发表SCI论文400余篇。
原文链接:
https://linkinghub.elsevier.com/retrieve/pii/S0168827824001065
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#肝癌# #HCC# #Siglec-9#
101
肝细胞肝癌(HCC)发病率高、死亡率高
0