Cell子刊:癌症治疗专用代餐?可阻止三阴乳腺癌进展和癌症干细胞逃逸!
2021-11-04 MedSci原创 MedSci原创
Cell Metab:模拟禁食饮食可以阻止三阴乳腺癌和癌症干细胞逃逸
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌(BC)亚型,与其他BC亚型相比,其临床侵袭性高,复发率高。最近批准的化疗-免疫联合治疗改善了患者的预后,然而由于肿瘤对治疗的耐药,以及肿瘤干细胞(CSCs)的存在,绝大多数晚期TNBC患者的预后仍然很差。
CSCs是一种缓慢循环的癌细胞,其特点是细胞内活性氧(ROS)水平低,这有助于它们的自我更新潜力和抵抗化疗或放疗诱导的DNA和其他大分子损伤。由于缺氧诱导因子(HIF-1)介导葡萄糖转运蛋白(GLUT)和糖酵解酶(如己糖激酶(HK))的表达上调,这种代谢可塑性使CSCs能够在不利的肿瘤微环境中生存,从而使其成为最具耐药性的癌细胞亚群。
近年来,研究表明禁食/模拟禁食(FMD)循环,提高了不同类型癌症(包括BC)标准疗法的疗效,还能同时使正常细胞免受治疗引起的毒性。有学者发明了一种低卡路里、低蛋白质、低糖(碳水化合物)、高植物脂肪、高维生素、高矿物质(无机盐)、高膳食纤维的模拟禁食代餐,能够模仿定期禁食或五天禁食的效果,同时仍然为人体提供充足营养,有助于改善肥胖、衰老、糖尿病、心血管疾病,还有助于提高乳腺癌的化疗和内分泌治疗效果。

由于CSCs在促进肿瘤启动、进展和对治疗的耐药方面发挥着关键作用,本研究了FMD对CSC生存的影响,以及这将如何影响TNBC的生长和对靶向治疗的反应。
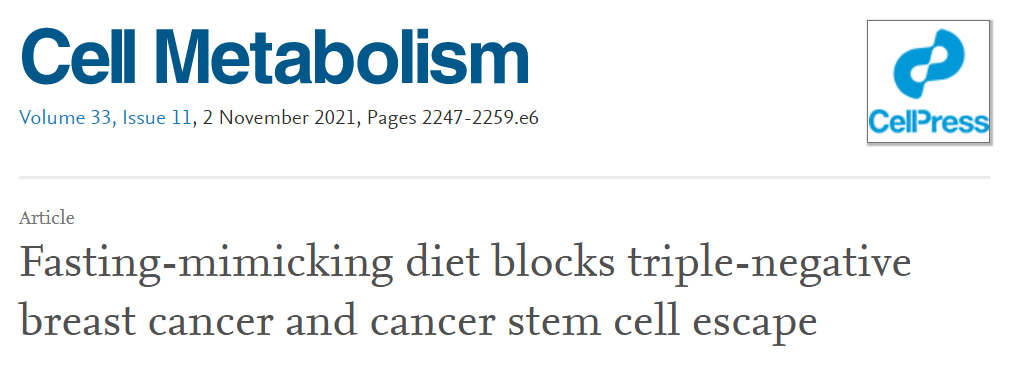
1、禁食/FMD通过降低血糖水平减少人类TNBC干细胞
与自由饮食(AL)相比,FMD循环减少了体外原代乳腺球的数量,以及表达乙醛脱氢酶1 (ALDH1)的细胞百分比(图1A和1B)。与AL相比,FMD降低了能够促进TNBC的细胞频率,增加了肿瘤无进展生存(图S1E)。
评估在体内补充葡萄糖的效果,在FMD周期喂养的小鼠的饮用水中添加3%的葡萄糖,这是基于小鼠通过标准饮食假定的每日正常糖浓度。与体外实验结果一致,补充葡萄糖部分逆转了FMD诱导的肿瘤进展减缓,并完全挽救了FMD依赖性的乳腺球群减少(图1C、1D和S1G)。
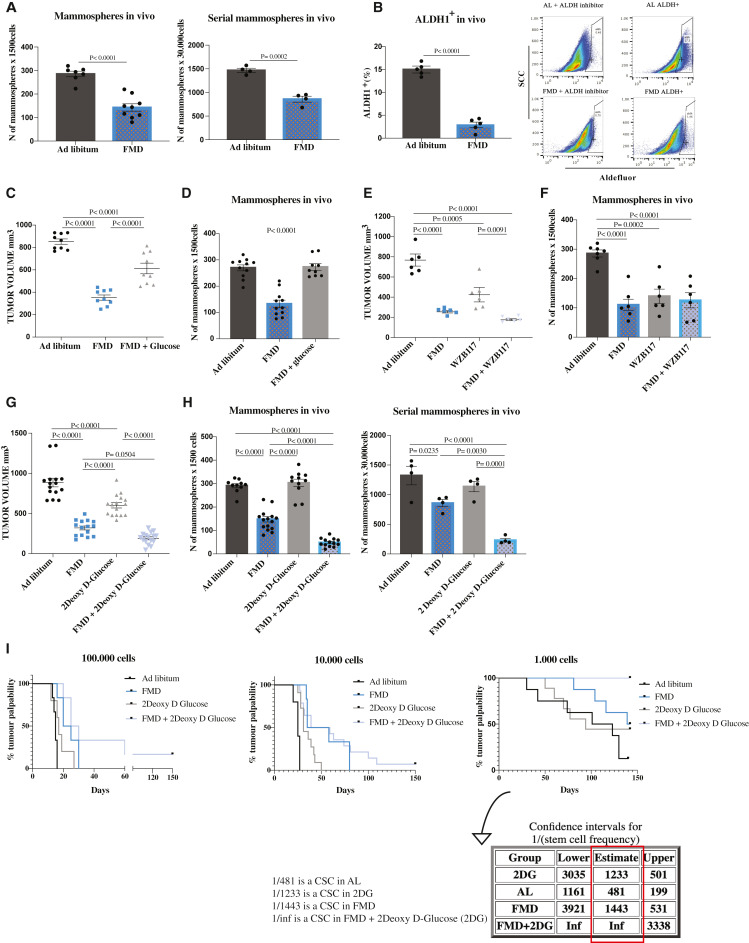
图1 在SUM159人三阴性乳腺癌(TNBC)中,FMD可降低乳腺球群细胞生长、CSC标记物表达和干细胞频率,其作用可通过2-脱氧-d -葡萄糖(2DG)增强。
2、在同基因TNBC模型中,FMD可减少TNBC CSCs并延迟肿瘤进展
为证实在同系小鼠TNBC模型中的数据,在免疫能力强的BALB/c雌性小鼠中测试了禁食/FMD在4T1小鼠移植中的作用。与AL条件相比,4个FMD周期延迟了肿瘤进展,减少了乳腺球数量以及CD44CD24+ -和ALDH1细胞的百分比,从而证实了此前在人类SUM159模型中报道的抗CSC作用(图2A)。此外,与人类TNBC的数据一致,在STS细胞生长培养基中添加1 g/L葡萄糖逆转了STS对4T1球形成的影响(图2B)。最后,2DG在延缓肿瘤进展和降低CSC方面增强了FMD的作用,从而证实了SUM159模型的结果(图2C-2E)。
由于转移是TNBC患者主要死因,而CSCs在转移扩散中发挥关键作用,我们评估了循环FMD,单独或联合2DG,对TNBC小鼠转移形成的影响。结果表明,FMD周期可以延缓转移形成,并阻止它们扩散到其他器官。大多数喂食AL + / - 2DG的小鼠在细胞注射后10天出现转移形成,而只有少数接受FMD的小鼠出现转移(图S3F)。在随后的时间点(细胞注射后17天),80%的FMD治疗小鼠仅在肺部出现转移,而在正常饮食喂养的小鼠中,转移在肝脏、脾脏、卵巢和淋巴结更为常见(图2F)。此外,在第17天,我们观察到在使用循环FMD和2DG联合治疗的动物中,更有效地防止了转移形成(图2F)。
图2示在同基因TNBC模型中,FMD独立于免疫系统发挥作用并减少转移
3、低基线血糖与转移性TNBC患者生存率增加相关
为了确定在小鼠中的发现是否与人类TNBC进展有关,我们研究了基线血糖浓度对晚期TNBC患者总生存(OS)的相关性,回顾性评估了2006年10月-2020年1月期间接受铂基化疗的晚期BC患者(图S4A)。在418例不同BC亚型的患者中,我们选择了81例连续接受一线卡铂-紫杉醇或卡铂-吉西他滨治疗的晚期TNBC患者(表S1)。如果基线血糖水平低于100 mg/dL,则认为血糖正常。与正常血糖患者相比,高血糖患者的OS显著降低(图3A)。多变量模型证实了高血糖浓度对患者OS的独立负性预后作用(HR高血糖患者vs正常血糖患者=1.95;95%CI 1.05-3.64;p = 0.035)(图3B)。
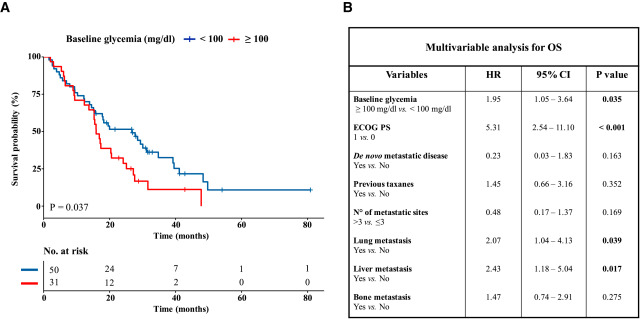
图3 在TNBC晚期患者中,高血糖与较差的总生存率相关
4、PKA激活逆转STS依赖的乳腺球群缩小
接下来将研究葡萄糖消耗使CSCs增敏的机制。通过检测PKA的经典下游底物CREB的磷酸化以及SUM159和4T1肿瘤中KLF5的表达来检测PKA的活性。在两种FMD小鼠模型中,pCREB和KLF5在肿瘤中均下调,表明PKA通路受到抑制(图4A)。此外,对SUM159肿瘤肿块进行RNA测序分析,发现FMD诱导的PKA通路抑制选择性地发生在CD44CD24+−中,而在CD44CD24分化细胞中不发生(图4B)。
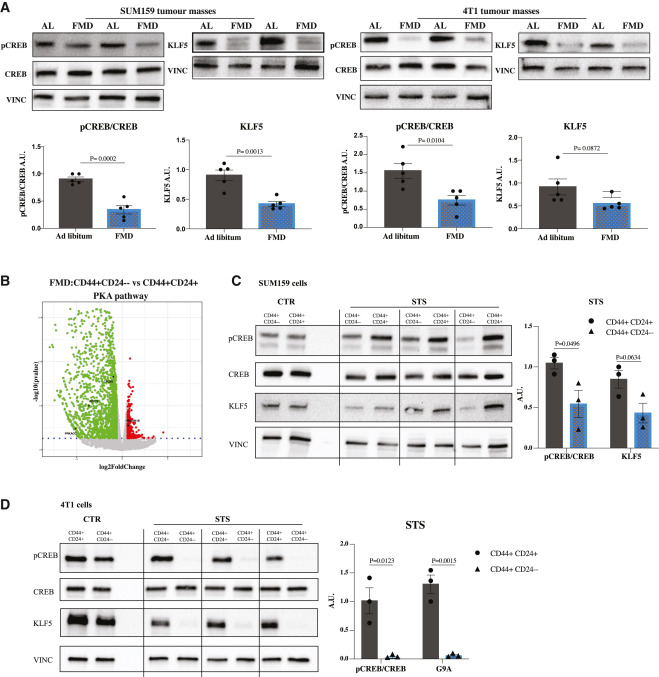
图4 FMD在CSCs中选择性下调PKA
在SUM159或4T1 TNBC细胞中,CTR条件下CSCs与分化癌细胞之间pCREB和KLF5的表达无明显变化,而STS条件下CSCs中pCREB和KLF5的表达均有选择性下调(图4C和4D)。这些结果表明PKA轴选择性参与了对CSCs的影响,PKA抑制在干细胞调节中的作用(图5A, 5B和S5A)。
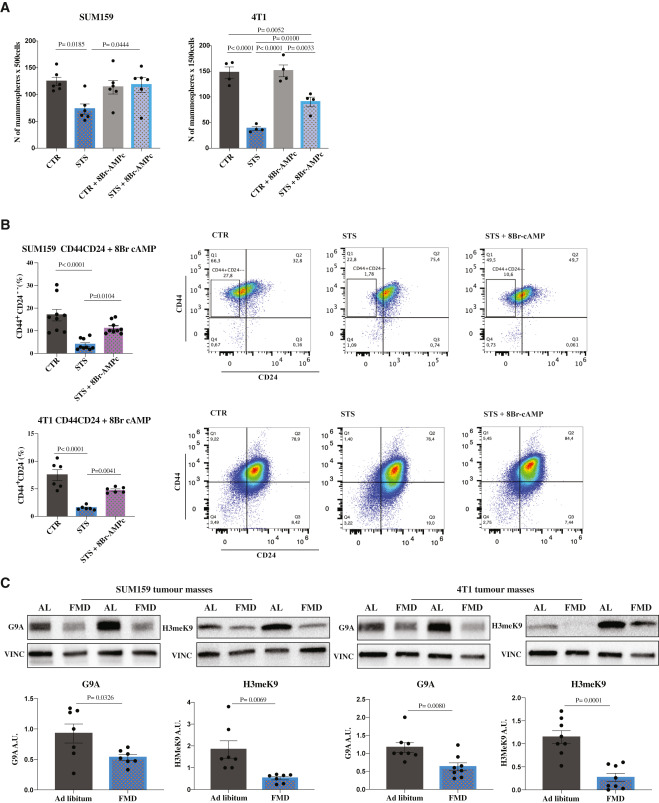
在SUM159和4T1肿瘤中,FMD均下调了G9A和H3K9me2水平(图5C)。值得注意的是,通过8Br-cAMP外源激活PKA途径逆转了STS/ FMD依赖性的KLF5和H3K9me2蛋白的下调,与STS单独条件下相比,KLF5和H3K9me2蛋白的表达增加(图S5B)。总之,这些数据表明,FMD诱导的TNBC CSCs衰竭至少是通过葡萄糖还原和PKA通路抑制介导的。
5、将FMD周期与PI3K/AKT/mTOR抑制剂联合使用可使动物长期存活并减少治疗引起的副作用
虽然CSCs在肿瘤形成和进展中起着至关重要的作用,但分化的细胞对肿瘤的体积也起着至关重要的作用。事实上,单独循环FMD导致CSCs的显著耗竭,只会延迟肿瘤的生长,但并不会导致无癌生存或长期无进展生存。
研究表明,FMD导致了促凋亡分子(如BIM和ASK1)的表达增加。RNA-seq分析还表明,FMD周期在上调CCND-CDK4/6信号轴的同时上调PI3K-AKT和mTOR信号通路,下调CCNB-CDK1(图6A和S6A)。
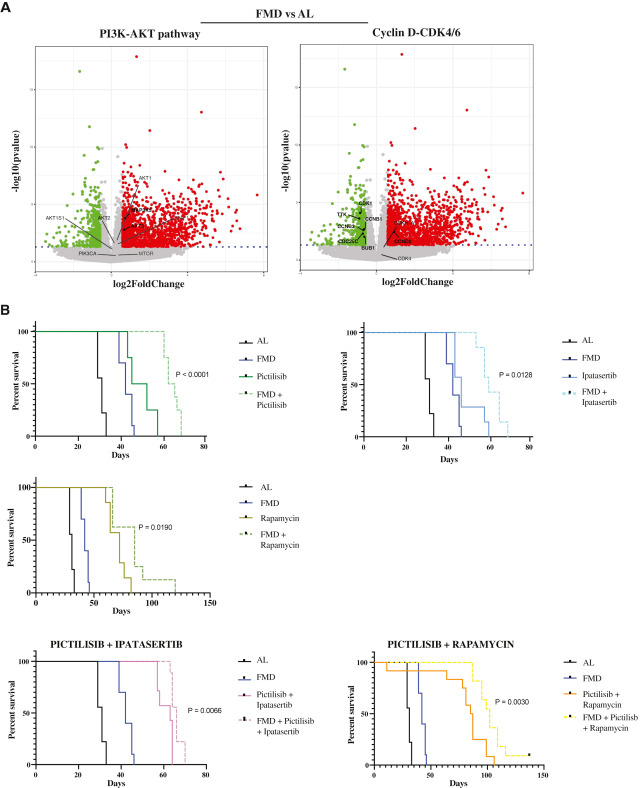
接着研究了药物抑制PI3K/AKT和mTOR通路是否可以通过阻断“饥饿逃逸通路”(SEPs)来增强FMD的作用,从而促进分化TNBC细胞在FMD期间的生存。在SUM159的小鼠异种移植中,每周一次的FMD显著提高了每种药物抑制剂的抗肿瘤活性,导致小鼠存活率显著增加(图6B和S7A)。然而,最显著的效果出现在联合所有三种药物与FMD周期。特别是针对PI3K/AKT和mTOR的3种药物对喂食标准饮食的小鼠的无进展生存有很强的影响,但添加FMD周期导致PI3K/AKT和mTOR途径抑制剂的三重组合的抗肿瘤活性显著增强。在85%的小鼠中,肿瘤的生长时间超过150天(图7A)。
在这种情况下,观察到的抗肿瘤作用可能部分是由PKA信号通路的强抑制介导的。事实上,我们发现三次pictilisib + ipatasertib + rapamycin处理联合STS,而不是单次(pictilisib)或双次(pictilisib + ipatasertib)处理强烈下调KLF5和H3K9me2蛋白的表达。

图7 FMD通过增强激酶抑制剂的作用和逆转高血糖引起的死亡来逆转TNBC的晚期进展
因此,我们研究了禁食/FMD诱导的高血糖预防是否有助于延长生存。有趣的是,FMD周期保护小鼠免受PI3K/AKT和mTOR抑制剂诱导的高血糖(图7B),在某些动物中高血糖则直接导致小鼠死亡,而不依赖于肿瘤的生长(图7A)。FMD周期使血糖在用药后不久恢复到正常水平,从而使绝大多数药物治疗期间血糖水平正常(图7B)。基于RNA-seq结果评估CDK4/6抑制剂palbociclib与pictilisib联合的疗效,发现palbociclib + pictilisib显著延缓了肿瘤进展,而加入FMD循环进一步提高了其抗肿瘤活性,并延缓了耐药性的获得(图7C和S7C)。此外,与单纯药物治疗相比,fpd -palbociclib-pictilisib三联疗法在治疗8周后也减少乳腺球群细胞的形成(图7C)。
综上:
- 空腹/FMD通过降低血糖水平消耗TNBC干细胞
- PKA激活逆转了FMD诱导的癌症干细胞减少
- 在癌细胞中,FMD激活了可被靶向的饥饿逃脱机制
- FMD+激酶抑制剂可使TNBC消退,而无药物毒性
该研究结果表明,禁食模拟代餐对正常细胞、癌细胞和癌症干细胞具有广泛而不同的影响,可快速激活饥饿逃逸信号传导通路,并被对应靶点的激酶抑制剂阻断,禁食模拟代餐+激酶抑制剂可引起三阴性乳腺癌消退,并减少药物毒性,提供了一种可能适用于许多恶性癌症的新方法,故有必要进一步开展人类临床研究进行验证。
原文来源:
Giulia Salvadori, et al. Fasting-mimicking diet blocks triple-negative breast cancer and cancer stem cell escape.Cell Metab. 2021 Nov 2;33(11):2247-2259.e6.
DOI: 10.1016/j.cmet.2021.10.008
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#癌症治疗#
101
#Cell#
75
#CEL#
83
#癌症干细胞#
98
积分评论
221