Nat Genet:“魔剪”CRISPR治疗血液疾病取得突破进展
2018-04-06 Tierna 生物探索
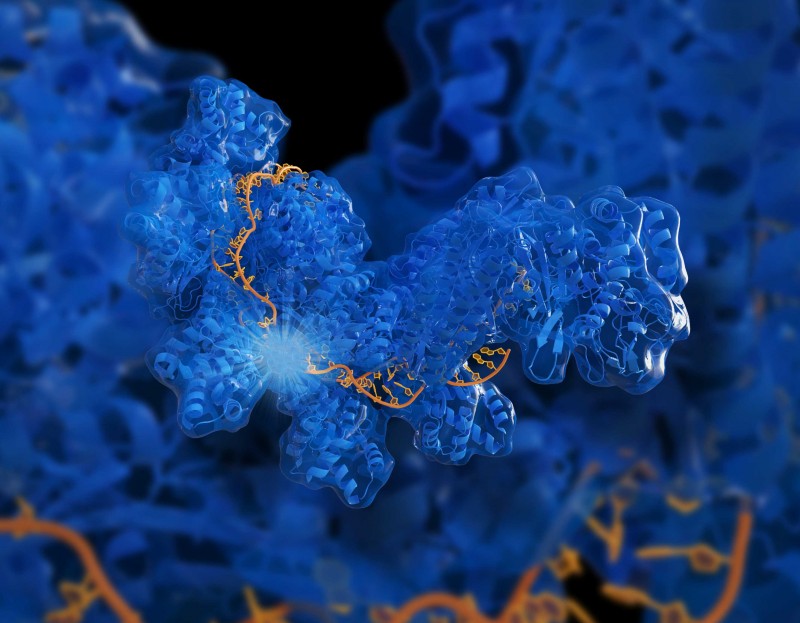
近日,科学家们确定了一种可以使几类血液疾病患者继续产生胎儿形式的人类血红蛋白(这种血红蛋白可以自然地弥补成人血红蛋白的不足)的基因控制机制,有效降低了疾病严重程度;此外,研究人员还利用CRISPR/Cas9基因编辑将天然有益的突变引入培养的血细胞中,直接促进了胎儿血红蛋白的产生。
作者:Tierna
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#Gene#
28
#NET#
28
#魔剪#
44
#Genet#
31
#Nat#
38