SCI TRANSL MED:难怪免疫治疗对有些患者无效!原来PD-1抗体都被巨噬细胞吃了
2017-05-15 佚名 奇点网
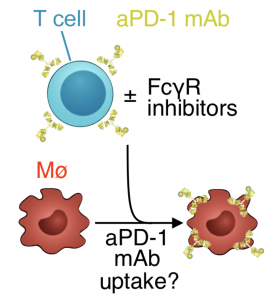
真是万万没想到!巨噬细胞竟然把抗癌药吃了,难怪有那么多患者对PD-1/L1抗体不响应。如果不是哈佛大学医学院附属麻省总医院的Mikael J. Pittet教授团队亲眼看到,任谁也不会想到,作为人体安全卫士的巨噬细胞,竟然会把好不容易结合到T细胞上的抗癌药物PD-1抗体吞噬掉。

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#Transl#
31
能早日指导临床实际工作!
54
#TRA#
35
#Med#
36
#PD-1抗体#
28