颅内转移的MET ex14跳变非小细胞肺癌患者在克唑替尼治疗进展后获益卡马替尼
刚刚 苏州绘真医学 苏州绘真医学
本研究旨在评估MET 14号外显子跳跃突变(MET ex14)晚期NSCLC患者的靶向治疗方法,本文患者在接受克唑替尼治疗后病情进展,并在PIK3CA中出现脱靶耐药变异。
卡马替尼是一种强效选择性的MET酪氨酸激酶抑制剂(TKI),由于其对携带MET 14号外显子跳跃突变的转移性非小细胞肺癌(NSCLC)患者具有潜在的颅内疗效,因此有望成为一种治疗药物。本研究旨在评估MET 14号外显子跳跃突变(MET ex14)晚期NSCLC患者的靶向治疗方法,本文患者在接受克唑替尼治疗后病情进展,并在PIK3CA中出现脱靶耐药变异。本文介绍了一例晚期MET ex14 NSCLC患者,在接受一线克唑替尼治疗后,在肺肿瘤完全切除和缓解后出现中枢神经系统(CNS)复发。后续疾病监测显示,在克唑替尼耐药的脑病灶中,卡马替尼产生了显著的颅内反应。分子检测揭示了最初的MET ex14 D1028N驱动突变和新发的PIK3CA旁路突变,可能导致脱靶耐药。在卡马替尼获批作为携带体系MET ex14突变的转移性NSCLC的一线治疗方案之前,克唑替尼已为靶向治疗提供了一种潜在的选择。改用具有更好中枢神经渗透性的选择性MET TKI(如卡马替尼),对于克唑替尼治疗失败且携带MET ex14突变的中枢神经转移性NSCLC患者来说,这似乎是一种有希望的治疗方法。需要进一步研究,以更有效地了解和监测耐药机制,使用先进的诊断技术,例如基于DNA的杂交捕获(HC)下一代测序(NGS),以指导一线治疗以外的分子分层治疗。
背 景
卡马替尼是一种高选择性强效MET酪氨酸激酶抑制剂(TKI),已获证对MET 14号外显子跳变(MET ex14)非小细胞肺癌(NSCLC)患者具有显著的抗肿瘤作用。基于这些有希望的结果,卡马替尼已获批用于治疗MET ex14阳性NSCLC。然而,卡马替尼对使用其它MET TKI后进展的NSCLC患者的疗效尚不明确。为了解决这个问题,正在对卡马替尼进行一项前瞻性研究,研究对象为既往接受过MET TKI治疗的、携带MET变异的NSCLC患者。NSCLC患者经常发生脑转移,并且生存率较低。脑转移患者的治疗选择有限,通常包括放疗或立体定向放疗(SRS),后者被认为是一种毒副作用较小的替代疗法。最近,人们开始考虑使用能够穿透中枢神经系统(CNS)的TKI来重新控制携带可干预致癌驱动因素患者的脑部病灶。选择性MET抑制剂卡马替尼已在MET ex14 NSCLC中显示出抗肿瘤疗效,并在部分患者群体中显示出颅内活性。有证据表明,卡马替尼可能在服用克唑替尼后出现疾病进展的MET ex14 NSCLC患者中引发软脑膜反应。其它报告表明卡马替尼具有颅内疗效,但还需要更多数据。除了提到的药代动力学障碍之外,在整个治疗过程中可能还需要解决与靶向治疗相关的挑战。与其它TKI一样,克唑替尼和卡马替尼都有可能出现耐药。
本病例报告描述了一名晚期MET ex14 NSCLC患者,该患者在接受克唑替尼治疗后,经手术完全切除并实现肺部肿瘤缓解,但出现中枢神经系统复发,且多处病变进展。本文报告了卡马替尼对克唑替尼耐药脑部病变的颅内活性,并讨论了这一发现对于使用卡马替尼治疗在其它TKI治疗中出现进展的MET ex14 NSCLC患者脑转移灶的潜在影响。
病 例
患者女,77 岁,无吸烟史,因出现呼吸困难、疼痛和眩晕症状就诊,癌症家族史未知,无严重合并症。患者确诊为转移性IV期左肺肺癌。患者的治疗时间表总结如图1所示。诊断时,患者有一处中枢神经系统转移。使用下一代测序(NGS)进行的分子检测显示,患者携带MET ex14[p.D1028N,NM_001127500.3:c.3082G>A,NM_001127500.3:p.Asp1028Asn;变异等位基因频率(VAF)48%],同时伴有CDK4和MDM2扩增。此外,患者的PD-L1 TPS评分为 2%。
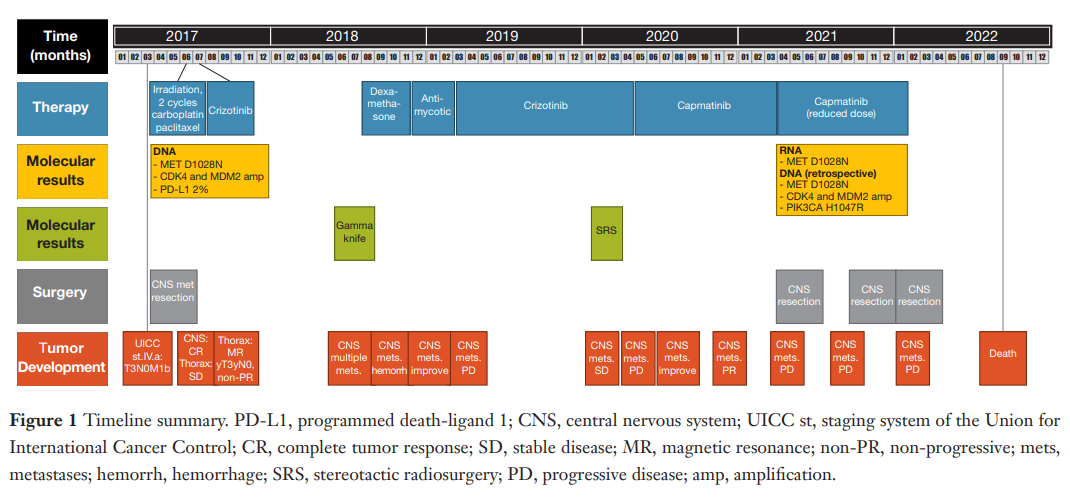
▲图1 时间线汇总
患者确诊为MET ex14肺腺癌后,行中枢神经系统转移灶切除术,随后接受 40 Gy辅助放疗,以及卡铂 6 mg/d静脉注射(第 1 天)和紫杉醇 200 mg/m2静脉注射(第 1 天),每 3 周 1 次,共 2 个周期的诱导治疗。患者中枢神经系统完全缓解,但胸部病灶无变化。由于克唑替尼是当时德国唯一可用于治疗MET ex14阳性患者的药物,因此患者随后接受克唑替尼 250 mg [卡铂(CBDCA):曲线下面积(AUC)6.0] 治疗,每日两次,共 39 天,肺部肿瘤消退。随后按照Junker等人描述的方法切除肿瘤(图2)。然而,患者在诱导治疗期间仍出现肝酶水平升高。
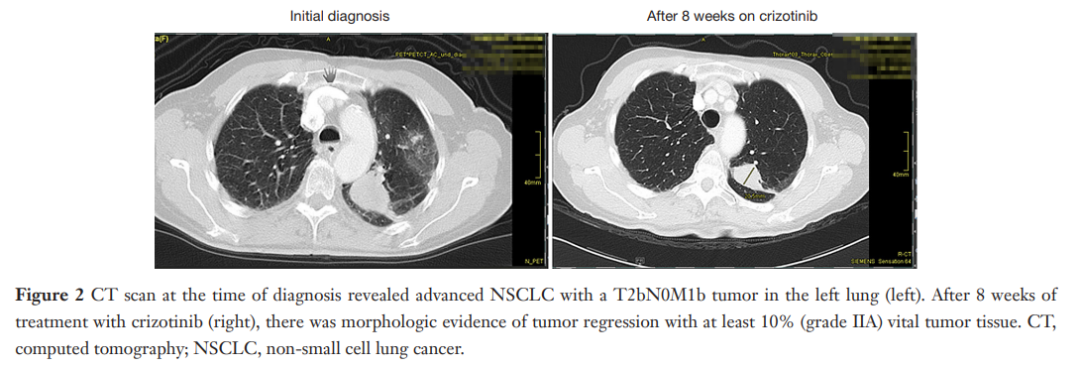
▲图2 诊断时的CT影像
肺部肿瘤缓解约 6 个月后,患者的中枢神经系统(CNS)水肿减少,但随后出现CNS复发,并出现多发性出血性中枢神经系统转移瘤,其中右侧小脑区域明显受累,第四脑室受压。鉴于该肿瘤的位置特殊,手术干预可能会导致言语障碍。因此,患者拒绝接受手术,接受SRS治疗,根治了部分中枢神经系统转移瘤。患者在开始诱导治疗后约 22 个月后恢复使用克唑替尼治疗,取得颅外完全缓解。不幸的是,尽管取得了相当的缓解,但在恢复治疗的前 3 个月内,所有中枢神经系统肿瘤均出现进展,左侧中央前转移灶明显进展。由于对克唑替尼没有反应,决定停止治疗。之后,患者开始以每天两次 400 mg(CBDCA:AUC 6.0)剂量服用卡马替尼。最初没有观察到副作用。患者开始卡马替尼治疗 1 个月后接受磁共振成像(MRI)扫描,结果显示左顶枕转移灶病情稳定,中枢神经系统水肿改善。治疗 2 个月后观察到左顶枕转移灶继续缩小,中枢神经系统水肿进一步改善,肺部残留无进展,没有颅外进展的迹象(图3)。
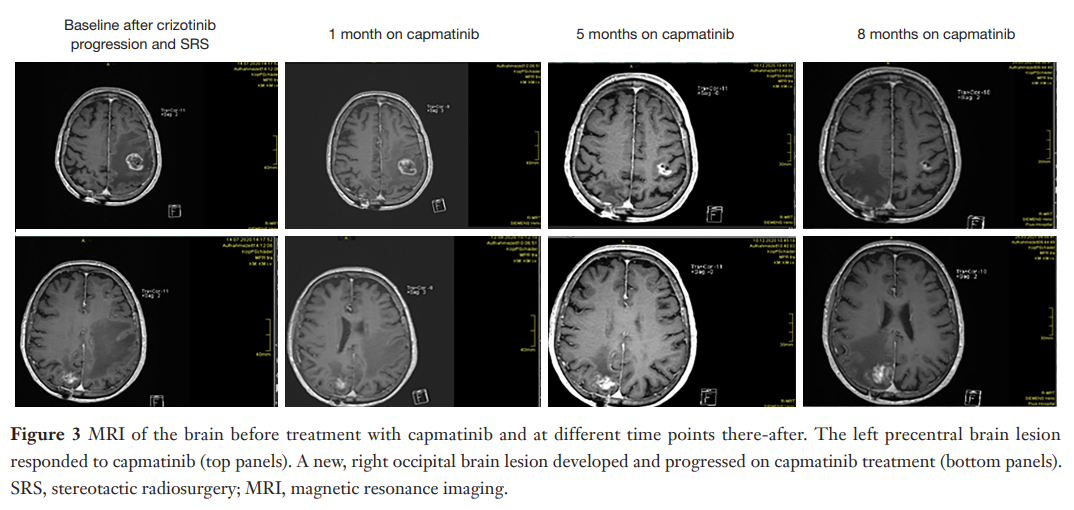
▲图3 不同时间点的脑MRI影像
经过 5 个月的卡马替尼治疗后,MRI扫描显示左顶叶转移灶缓解,其他转移灶放射性坏死(图3)。然而,患者在治疗 6 个月后出现 2 级外周水肿,导致卡马替尼剂量减少至每日两次 200 mg,每日两次。随后的MRI脑部扫描显示左侧顶枕骨转移灶消退,但右侧枕骨转移灶出现疾病进展(图3)。尽管如此,卡马替尼治疗仍坚持进行,在接受卡马替尼治疗 10 个月后,患者因右枕骨转移而接受了手术干预。对石蜡包埋或冷冻保存的肿瘤标本进行组织学检查,以确定是否存在肿瘤细胞。同时,进行了NGS以确定MET TKI耐药机制。利用基于RNA的NGS panel来确认MET 14号外显子跳跃突变,在MET基因或其他基因位点内未检测到明显的耐药相关突变。随后使用基于DNA杂交捕获NGS panel对相同的福尔马林固定石蜡包埋(FFPE)材料进行回顾性检查,除了检出MET驱动突变(VAF 10%),还检测到MDM2和CDK4基因拷贝数变异,以及PIK3CA H1047R激活突变(NM_006218.4:c.3140A>G; NM_006218.4:p.His1047Arg, VAF 5%)。患者于 2022 年 9 月(首次确诊 66 个月后)去世。
讨 论
本病例报告强调了接受MET TKI治疗的MET ex14 NSCLC患者颅内疾病进展患者治疗的挑战。在这种情况下,中枢神经系统药物渗透性有限可能是疾病进展的潜在原因,可以通过换用另一种渗透性更高的MET TKI来解决,例如之前已显示颅内反应的卡马替尼。
本文病例报告显示,卡马替尼对克唑替尼耐药且对SRS无反应的病变表现出颅内活性。然而,在卡马替尼治疗期间出现了新的中枢神经系统病变并出现进展,这表明需要更好地了解对不同TKI的耐药机制。随后对不同的中枢神经系统病变或液体活检进行彻底的基因检测可能会在这方面提供信息。
另一个挑战在于识别克唑替尼治疗期间中枢神经系统进展过程中发生的基因改变。与使用奥希替尼治疗的具有表皮生长因子受体(EGFR)突变的NSCLC的情况类似,科学文献中报道了多种对克唑替尼的潜在耐药机制,这些机制可能来自与驱动因素依赖性和驱动因素独立的旁路耐药途径相关的改变,包括EGFR、KIT和MAPK途径的激活。此前,PIK3CA和MET-TKI同时发生的激活突变引发的PI3K通路激活已被反复证明是导致对MET-TKI治疗产生耐药性的因素。此外,临床前研究表明,将MET-TKI 药物与针对PIK3CA的抑制剂相结合可能存在治疗机会。然而,旁路变异通常缺少治疗药物,因此通常会忽略将其纳入基本的常规分析方案中。这种遗漏可通过基于RNA的NGS结果(无)和基于DNA的NGS结果(PIK3CA突变)的对比来体现。本文结果表明,精心设计的、基于DNA的HC-NGS能够鉴别主要驱动突变(MET D1028N)、其它变异(MDM2和CDK4扩增)以及获得性耐药性变异(PIK3CA H1047R)。PIK3CA突变很可能是卡马替尼的耐药机制,这在尽管接受了卡马替尼治疗但仍出现进展并随后需要切除的转移灶中显而易见。
需要开展临床试验,研究卡马替尼对使用另一种MET TKI 后仅出现中枢神经系统进展的 METex14 NSCLC患者的疗效。这将有助于确定MET TKI在治疗颅内疾病进展中的最佳治疗顺序,并确定可预测治疗反应的生物标志物。此外,探索MET TKI与其它治疗方式(如下一代MET TKI或免疫疗法)的联合治疗也很重要,以改善晚期MET ex14 NSCLC患者的预后。
本病例报告提供了有关解决MET ex14 NSCLC患者颅内疾病进展的复杂性的见解。在这种情况下,改用另一种以增强中枢神经系统通透性为特征的MET TKI(例如卡马替尼)是一种潜在的可行策略。尽管如此,仍有必要进行进一步研究,以通过使用复杂的诊断检测(例如基于DNA的HC-NGS)来揭示不同TKI的耐药机制的复杂性。此外,为这一特定患者群体寻求最佳治疗策略需要进一步研究和探索。
参考文献:
Jóri B, Bundschuh O, Falk M, Heukamp LC, Kluge A, Tiemann M, Willborn KC, Woitzik J, Griesinger F. Intracranial response to capmatinib after progression on crizotinib in a patient with MET exon 14 skipping non-small cell lung cancer-a case report. Transl Lung Cancer Res. 2024 Jul 30;13(7):1749-1755. doi: 10.21037/tlcr-23-769. Epub 2024 Jul 15. PMID: 39118880; PMCID: PMC11304159.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#非小细胞肺癌# #卡马替尼#
0