【BCJ】CAR-T治疗RRMM,髓外病变对结局的影响
2024-06-27 聊聊血液 聊聊血液
为了深入评估存在EMD对RRMM患者接受商业化BCMA CAR-T治疗的结局的影响,学者开展了一项大样本多中心回顾性分析。
CAR-T治疗髓外病变
髓外病变(EMD)与复发难治性多发性骨髓瘤(RRMM)患者的不良预后相关,但因为缺乏高质量证据,EMD的治疗尚未达成共识。虽然CAR-T细胞疗法的缓解率较高、生存结局较高,但前瞻性和回顾性研究均证实EMD是CAR-T治疗下早期进展的预测因素。
为了深入评估存在EMD对RRMM患者接受商业化BCMA CAR-T治疗的结局的影响,学者开展了一项大样本多中心回顾性分析,结果近日发表于《Blood Cancer Journal》。

研究结果
基线特征
EMD不包括骨依赖性(Bone-dependent)和骨旁浆细胞瘤(髓旁[paramedullary]病变);但鉴于有的文献中将骨旁浆细胞瘤归类为EMD,为了更好地理解“真正的EMD”对CAR-T后预后的影响,该研究进一步将没有EMD的患者细分为单纯髓旁疾病(PMD)的患者和没有任何EMD/PMD的患者(单纯骨髓组)。内脏EMD定义为位于主要内脏器官的EMD,包括但不限于肝、肺、脾和胰腺。
共189例RRMM进行单采,其中152例最终输注,其中108例(71%)接受标准治疗(SOC) ide-cell, 44例(29%)接受SOC cilta-cell。47例(31%)患者在CAR-T细胞输注前有活动性EMD;在剩下的105例(69%)患者(非EMD组)中,26例(17%)仅有PMD、79例(52%)既没有EMD也没有PMD。患者既往接受治疗的中位数为6线,85%为三类难治。
患者的基线特征见表1,按输注前活动性EMD组(n=47)与非活动性EMD(n=105)(非EMD组)进行分层。EMD组患者的中位年龄为60岁,19%的患者ECOG体能状态(PS)≥2,43%的患者输注前为R-ISS III期疾病,35%的患者携带高危细胞遗传学。EMD组36例(77%)患者接受ide-cel治疗,11例(23%)患者接受cilta-cel治疗。EMD组患者的中位年龄为60岁,而非EMD组的中位年龄为65岁(p=0.0125)。其他因素匹配良好。
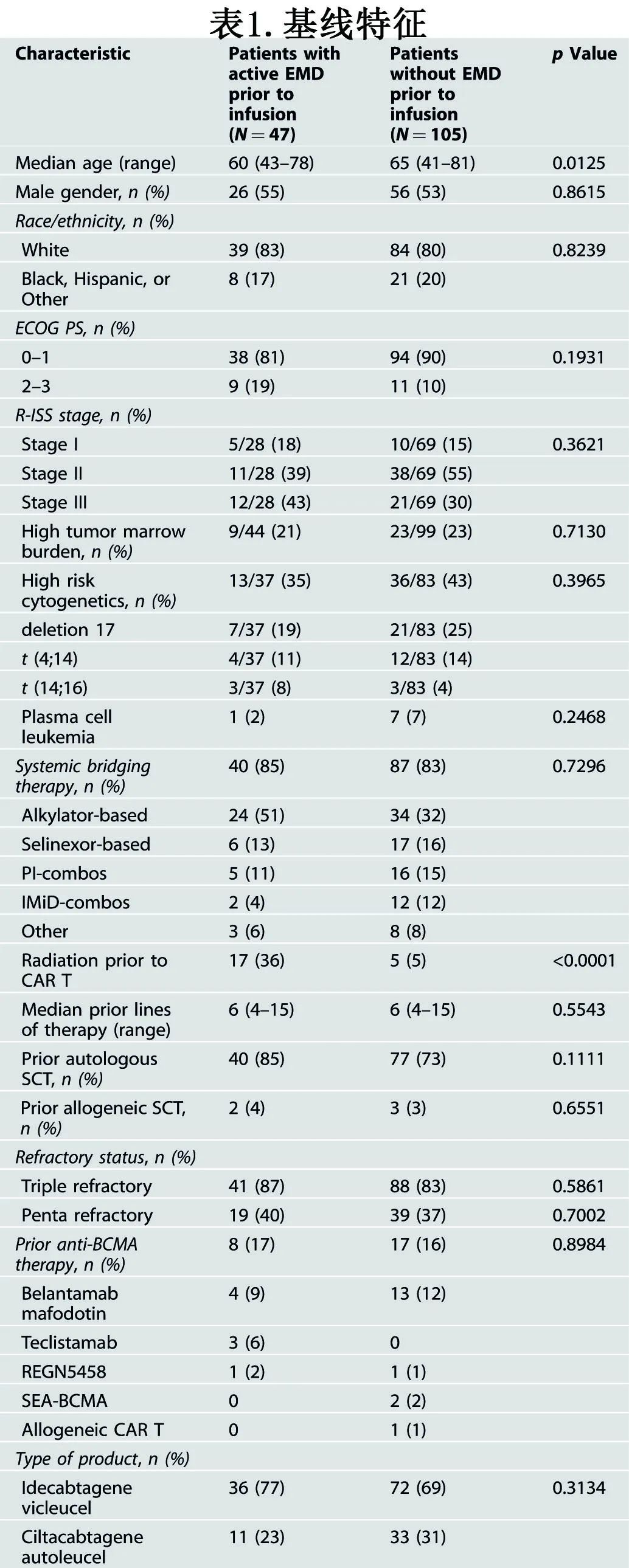
关于CAR-T输注前EMD的具体位置,47例EMD患者中有25例(53%)为内脏EMD,21例(45%)EMD患者有皮肤受累,7例(15%)有淋巴结受累。仅有1个EMD病灶9例(19%),2个EMD病灶9例(19%),≥3个EMD病灶29例(62%)。值得注意的是,6例(17%)患者至少有一个最长垂直直径大于5厘米的病灶,17例(36%)患者在CAR-T之前接受过EMD放疗。
安全性
表2总结了两组的不良事件。EMD组的中位住院时间为12天,9名患者(19%)在住院期间需要住ICU。EMD组所有级别CRS的发生率为81%,至最高级别CRS的中位时间为4天;所有级别ICANS的发生率为36%,其中21%为1级、9%为2级、6%为4级。虽然EMD组和非EMD组分别有5例(11%)和3例(3%)患者发生3-4级CRS事件,但两组间托珠单抗的使用率无差异。然而,类固醇(40% vs 24%,p = 0.03)和anakinra (21% vs 3%,p=0.0002)的使用在EMD组更为频繁。当仅关注EMD组时,ide-cel和cilta-cel治疗的患者中任何级别(≥3级)CRS的发生率分别为78%(3%)和91%(36%),任何级别(≥3级)ICANS的发生率分别为36%(0%)和36% (27%)。
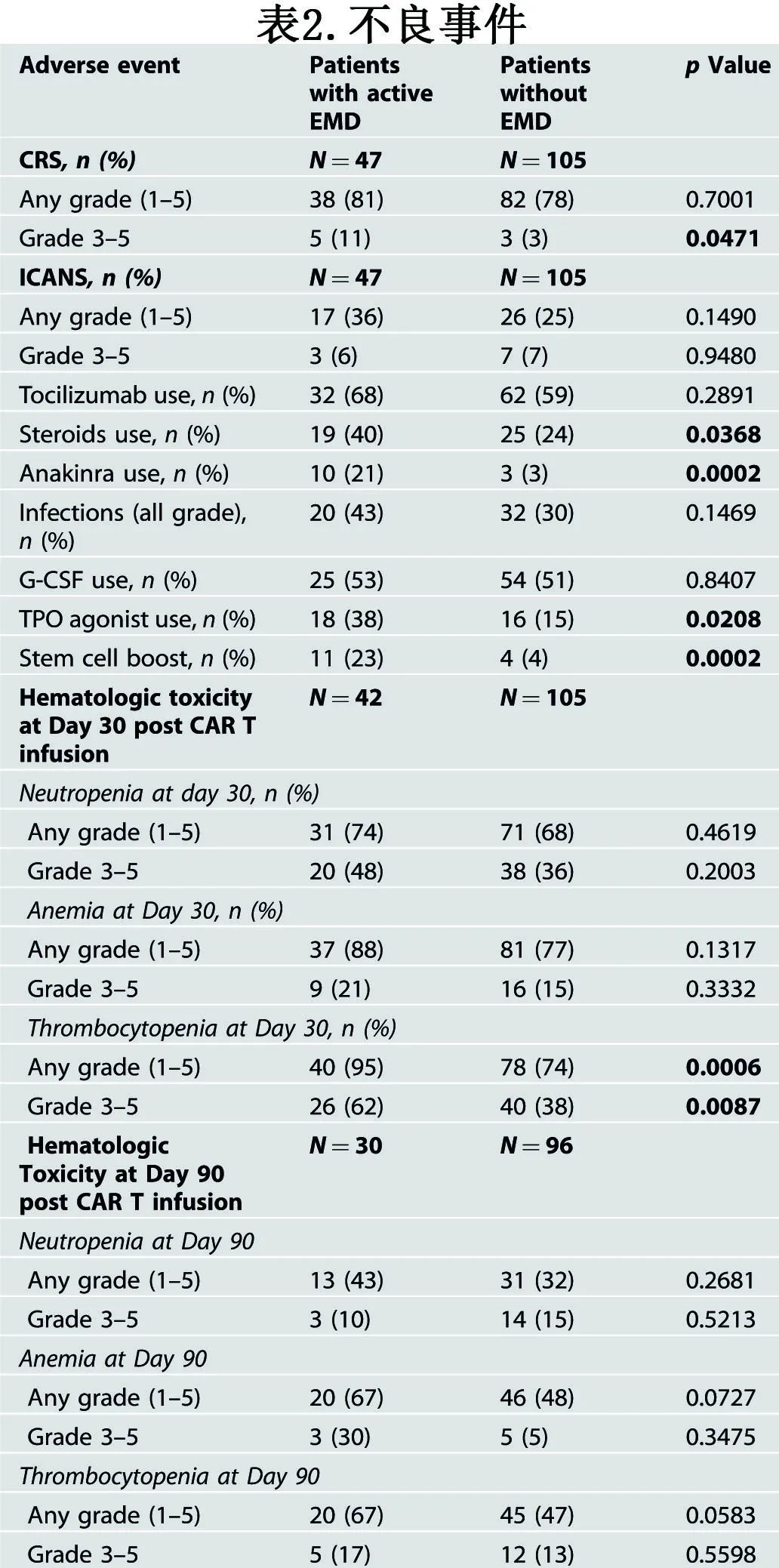
CAR-T输注后第30天,EMD组分别有48%、21%和62%的患者出现≥3级中性粒细胞减少症、贫血和血小板减少症。与非EMD组相比,EMD组中任何级别(95% vs 74%,p=0.0006)和≥3级血小板减少症(62% vs 38%,p=0.0087)的发生率更高,从而意味着血小板生成素激动剂的使用率更高(38% vs 15%,p=0.02)。两组感染发生率(所有级别)相似,EMD组为43%,非EMD组为30%。
治疗反应
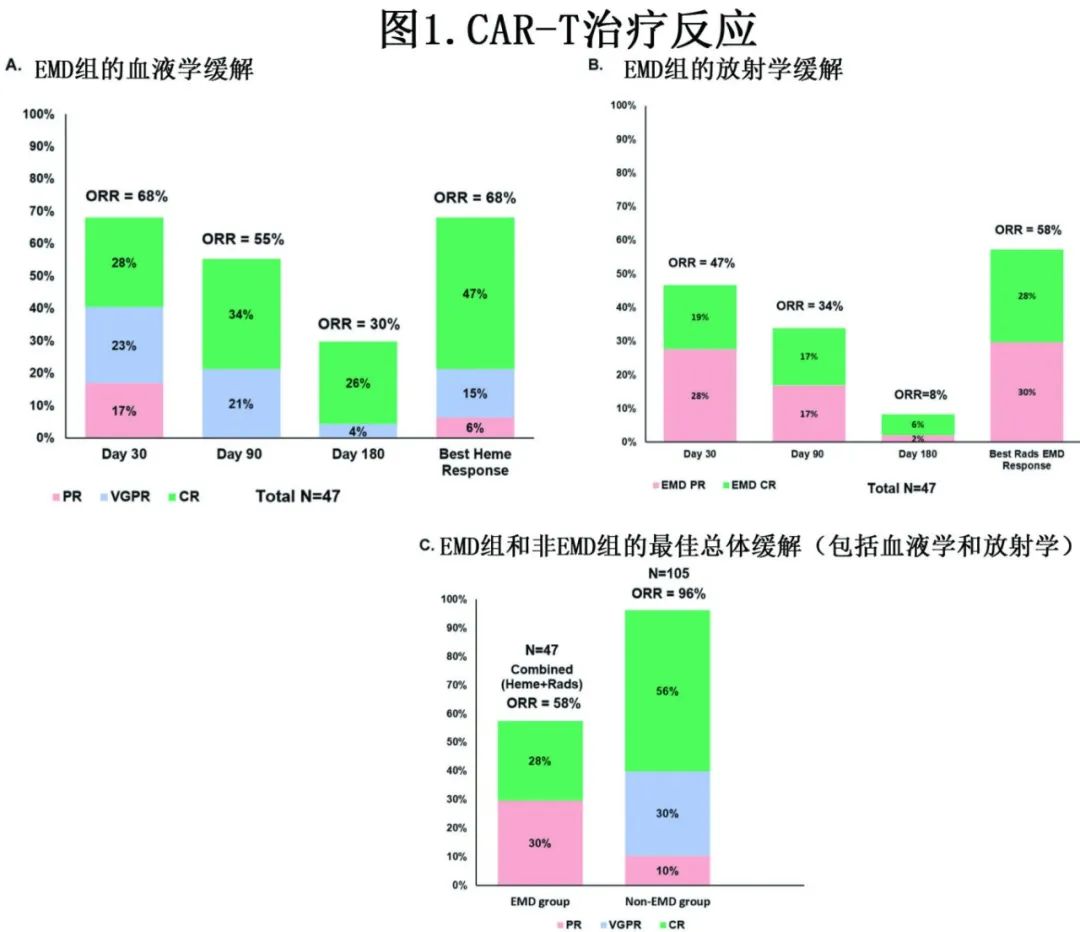
EMD组患者的血液学、放射学以及血液学+放射学联合缓解率如图1所示。47例患者中有5例由于输注后未获得放射影像学,因此无法进行联合总缓解率评估;在综合总缓解率分析中将其视为无反应。此外,在反应评估前输注后30天内因毒性死亡的患者也纳入反应分析,并被视为无反应。图1A、b显示EMD组CAR-T治疗后+30、+90和+180天的血液学和放射学反应的详情。对于EMD患者, ide-cel (n=36)和cilta-cel (n=11)治疗的最佳联合ORR分别为61%和46%;需要注意的是,4例接受cilta-cel治疗的EMD患者在输注后30天内死于CAR-T相关毒性,而接受ide-cel治疗的EMD患者在输注后30天内没有一例死于毒性。总体而言,与非EMD组相比,EMD患者的总ORR (58% vs 96%, p<0.00001)和≥CR率(28% vs 56%,p=0.002)较低(图1C)。
生存结局
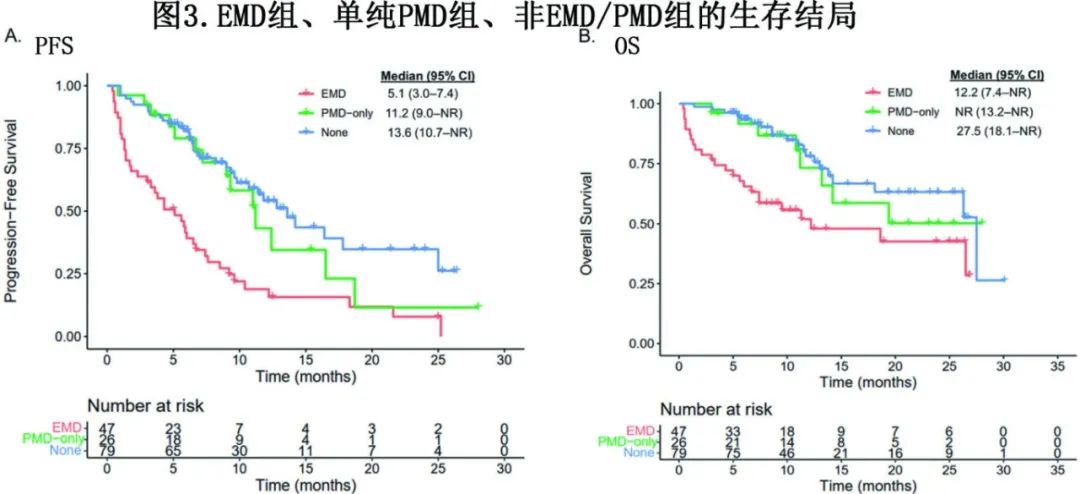
EMD组中位随访12.5个月,非EMD组中位随访12.6个月。EMD组患者的中位PFS劣于非EMD组(5.1个月vs 12.4个月;P<0.0001;图2a),中位OS 也是EMD组非EMD组(12.2 vs 27.5个月;P=0.00058;图2b)。
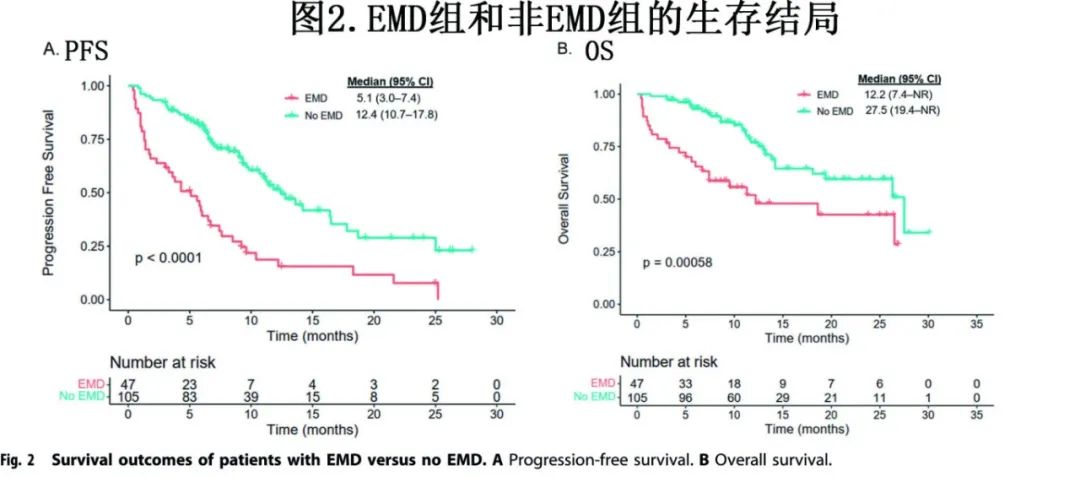
为更好地了解真正的EMD对CAR-T细胞治疗后疗效的影响,进一步评估了EMD组、单纯PMD组和单纯BM组(即图中的非EMD/PMD组)之间的PFS和OS。单纯PMD组与单纯BM组的中位PFS (11.2个月vs 13.6个月,p=0.3798;图3A)和OS(未达到[NR] vs 27.5个月,p=0.6446;图3B)均相似。然而,EMD组相对于单纯PMD组表现出显著较差的中位PFS (5.1 vs 13.6个月,p<0.0001;图3A)和OS (12.2 vs 27.5, p=0.0008;图3B)。
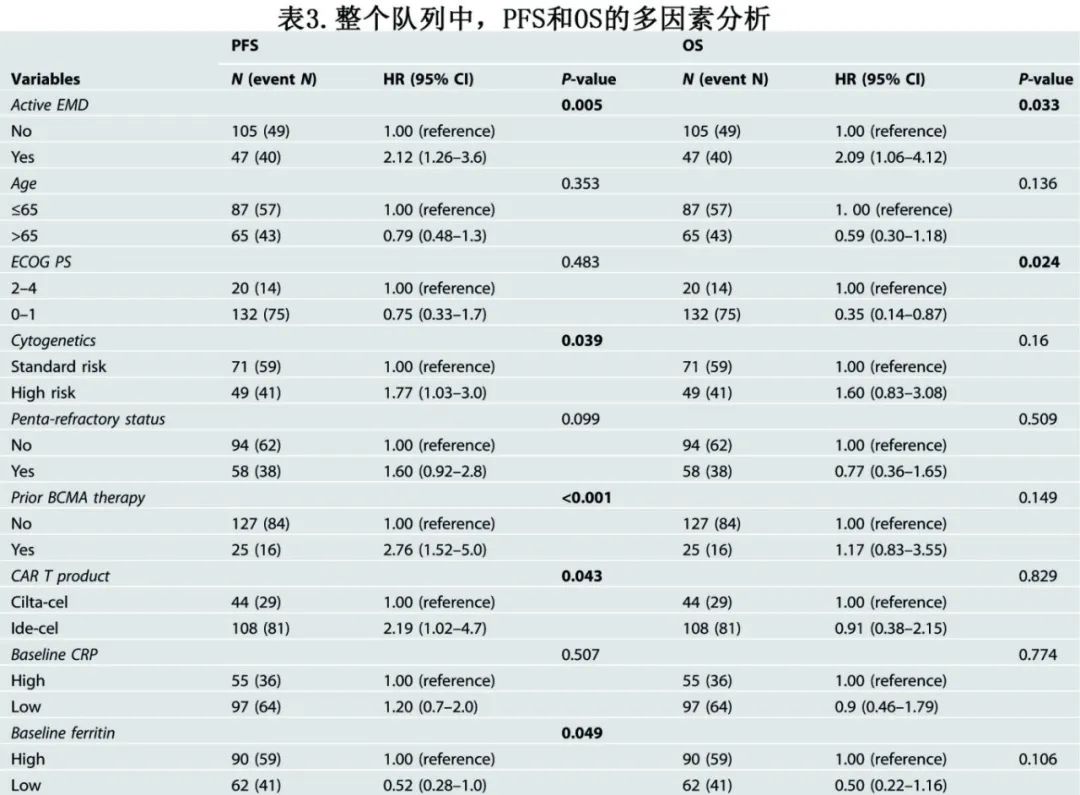
对整个患者队列的多因素分析发现,CAR-T前的活动性EMD是不良PFS (HR=2.12,p=0.005)和OS (HR=2.09,p=0.033) 的独立预测因子(表3)。除活动性EMD外,高危细胞遗传学、既往抗BCMA治疗、接受ide-cell产品和基线铁高蛋白与PFS恶化独立相关(表3);而活动性EMD和ECOG PS≥2与较差的OS相关。
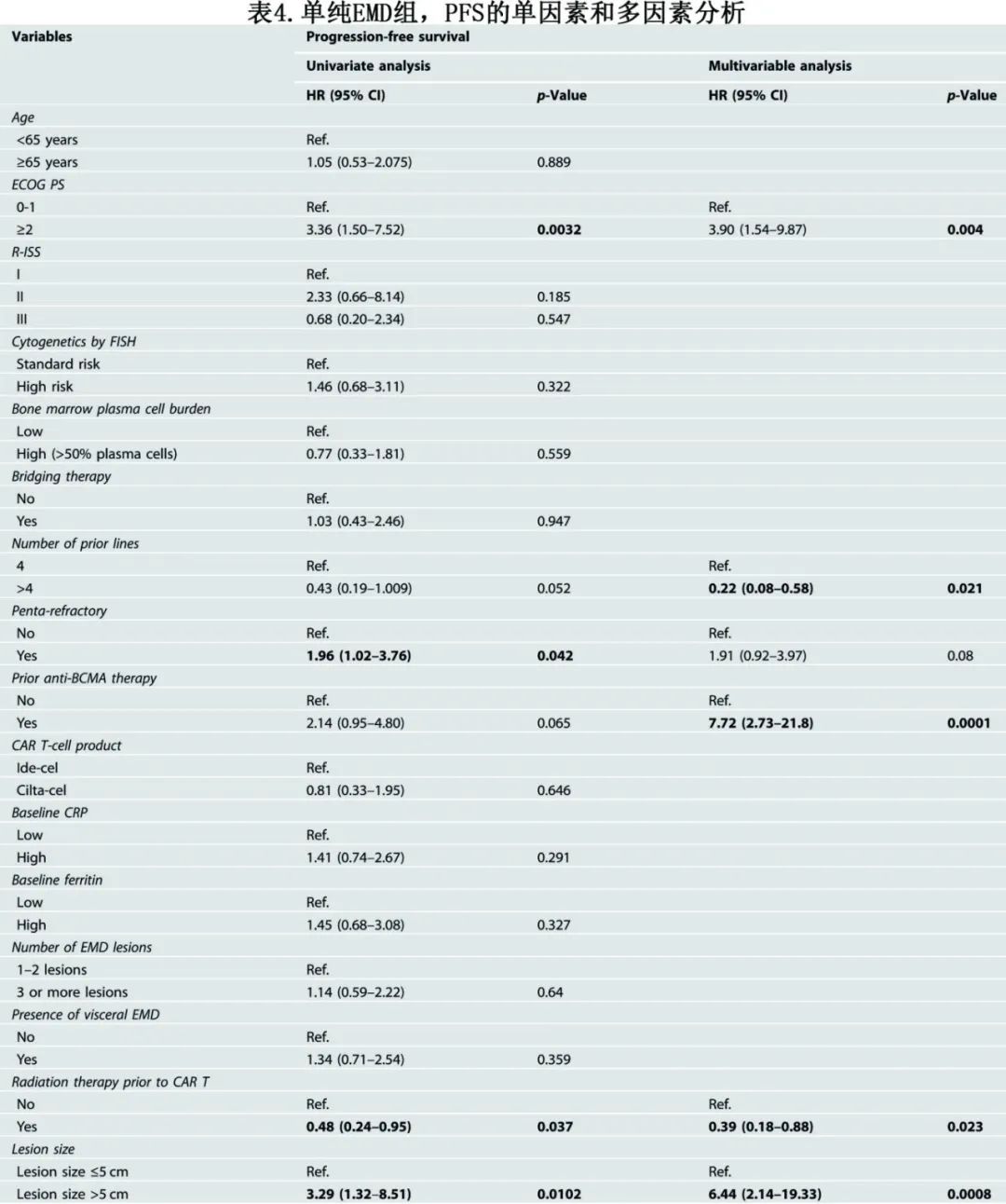
在单纯EMD队列中,多因素分析发现ECOG PS≥2、既往4线治疗、既往抗BCMA治疗暴露、输注前未接受放疗、病变大小>5cm与PFS恶化相关(表4)。
在EMD组47例患者中,32例(68%)出现疾病复发,其中12例(25.5%)伴EMD复发,8例(17%)伴生化复发,12例(25.5%)同时伴EMD和生化复发。分别有7例(15%)、9例(19%)和8例(17%)患者复发时EMD出现于CAR-T治疗前同一部位、新部位和同一部位+新部位。47例EMD组患者中有24例(51%)死亡:进行性骨髓瘤14例(30%),CRS/噬血细胞淋巴组织细胞增多症4例(8.5%),感染/败血症2例(4%),非相关原因4例(8.5%)。在非EMD组的105例患者中,28例(27%)患者死亡:24例(23%)死于骨髓瘤进展,2例(2%)死于感染/败血症,1例(1%)死于迟发性神经毒性,1例(1%)死于无关原因。
总结
作者回顾性收集了美国三家中心152例患者输注商业化CAR-T的RRMM患者,其中47例(31%)有EMD (EMD组),105例(69%)没有(非EMD组),两组患者的基线特征相似。与非EMD组相比,EMD组在第30天发生高级别CRS、类固醇和anakinra使用以及血小板减少的发生率更高。此外,EMD组的总缓解率 (58% vs 96%,p<0.00001)、无进展生存期(5.1 vs 12.4个月;p<0.0001)、总生存期 (12.2 vs 27.5个月;p=0.00058) 较低。进一步将非EMD患者细分为有髓旁病变的患者(单纯PMD组,n=26[17%])和既没有EMD也没有PMD的患者(单纯骨髓组,n=79[52%])。单纯PMD患者与单纯BM患者的中位PFS(11.2个月vs 13.6个月,p=0.3798)和OS(未达到vs 27.5个月,p=0.6446)相似,但EMD患者的中位PFS(5.1个月vs 13.6个月,p<0.0001)和OS(12.2个月vs 27.5个月,p=0.0008)均低于单纯PMD组。
尽管与没有EMD的患者相比,SOC CAR-T治疗在真实世界中伴EMD的RRMM患者中获得了有意义的临床结局,但缓解率和生存结局仍劣于无EMD的患者。CAR-T输注后,仅存在EMD而不存在PMD与明显较差的生存结局相关。该研究有助于确定更适合CAR-T后干预的患者,包括对复发进行常规影像学密切监测、在疾病进展的最早迹象时开始挽救治疗以及在未来的临床试验中考虑CAR-T后维持治疗。
参考文献
Dima, D., Abdallah, AO., Davis, J.A. et al. Impact of Extraosseous Extramedullary Disease on Outcomes of Patients with Relapsed-Refractory Multiple Myeloma receiving Standard-of-Care Chimeric Antigen Receptor T-Cell Therapy. Blood Cancer J. 14, 90 (2024). https://doi.org/10.1038/s41408-024-01068-w
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#多发性骨髓瘤# #髓外病变#
2