苏大熊玲红、何学文/港中深唐本忠院士ACS Nano:多功能ALP响应型AIE探针——精准成像与协同治疗肿瘤的新突破
2024-07-04 BioMed科技 BioMed科技
研究开发ALP响应型多功能AIE探针TPE-APP,能响应癌细胞中ALP被激活,实现荧光成像与协同化学动力学-光动力学癌症治疗,体内外实验均证明其有效性和安全性。
光动力疗法(PDT)是一种新型的癌症治疗手段,它利用光敏剂(PSs)诱导生成活性氧(ROS),从而精准杀灭癌细胞。然而,PDT的有效性高度依赖于肿瘤区域内的氧气浓度,而肿瘤特有的缺氧微环境往往成为其疗效的制约因素。化学动力疗法(CDT)作为一种非侵入性疗法,通过触发肿瘤内部的Fenton或类Fenton反应,高效生成ROS,展现出巨大的治疗潜力。然而,由于肿瘤组织的复杂性、反应效率波动及还原性环境等因素,CDT的实际应用仍受到诸多限制。为突破单一疗法的局限,科研界积极探索多疗法联合的协同效应,通过不同疗法的互补作用,实现治疗效果的倍增。PDT与CDT的联合应用能够同时覆盖肿瘤内部氧合充足与缺氧区域,弥补了CDT在穿透深度上的局限,极大地增强了治疗的有效性。因此,开发一种能够精准靶向肿瘤细胞,并在局部区域同步激活PDT与CDT的探针分子,成为了实现多疗法协同、高效治疗癌症的关键。这一创新设计将有望引领癌症治疗领域的新一轮变革,为癌症患者带来更加个性化、高效且安全的治疗方案。
近日,苏州大学熊玲红/何学文和港中深唐本忠院士开发了一种具有碱式磷酸酶(ALP)酶切位点的多功能水溶性聚集诱导发光(AIE)探针(TPE-APP)。TPE-APP探针响应癌细胞中异常表达的ALP生物标志物而被激活,产生强发光的TPE-DMA聚集体和高活性的醌亚甲(QM)中间体,实现了荧光成像引导的协同化学动力学-光动力学癌症治疗的一体化策略。该研究以题为“All-in-One Alkaline Phosphatase-Response Aggregation-Induced Emission Probe for Cancer Discriminative Imaging and Combinational Chemodynamic−Photodynamic Therapy”的论文发表在《ACS Nano》上。

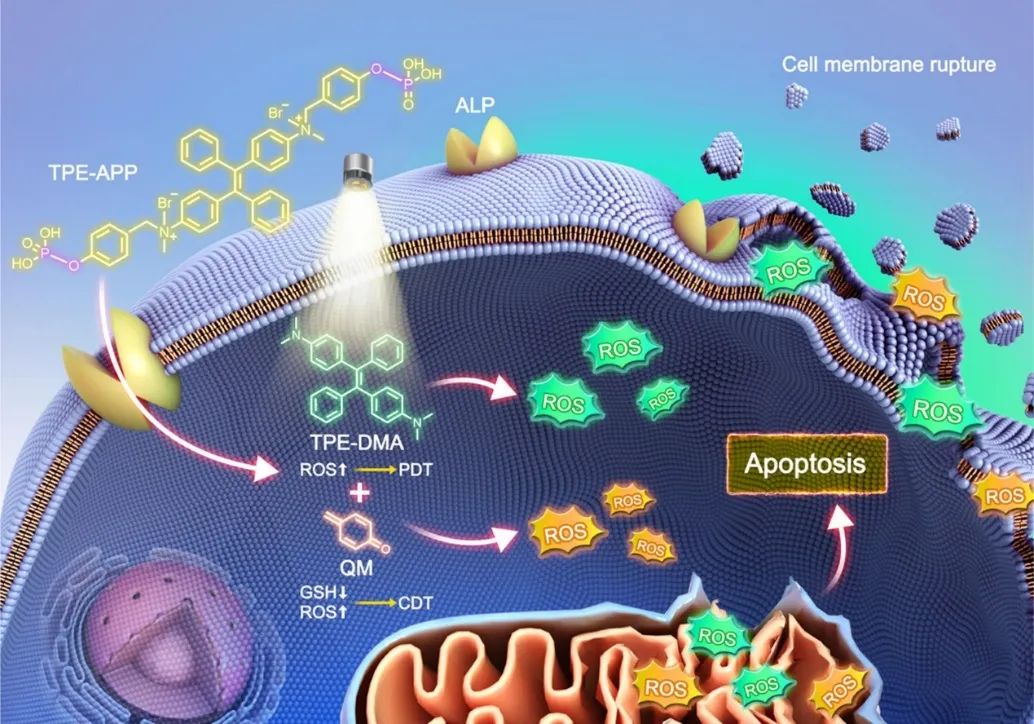
图1 ALP响应型多功能AIE探针的荧光成像引导的协同化学动力学-光动力学癌症治疗的一体化策略
ALP催化水解AIE探针产生点亮型荧光信号和ROS 物质
研究团队对ALP催化水解TPE-APP的光物理性质以及水解产物进行了表征。结果表明,ALP 酶能够特异性催化水解 TPE-APP 探针,生成不溶于水的聚集诱导发光产物 (TPE-DMA)和高活性的QM。TPE-DMA在水溶液中发生聚集,发出强烈的黄绿色荧光(图2a-f)。此外,TPE-DMA在白光照射下能够产生ROS,具有光动力活性,且活性中间体QM也能产生ROS,具有化学动力活性(图2g-l)。总之,在ALP催化下,TPE-APP可同时生成具有荧光成像信号的TPE-DMA和具有光动力和化学动力活性的TPE-DMA和QM,为实现成像引导的协同肿瘤治疗提供了依据。
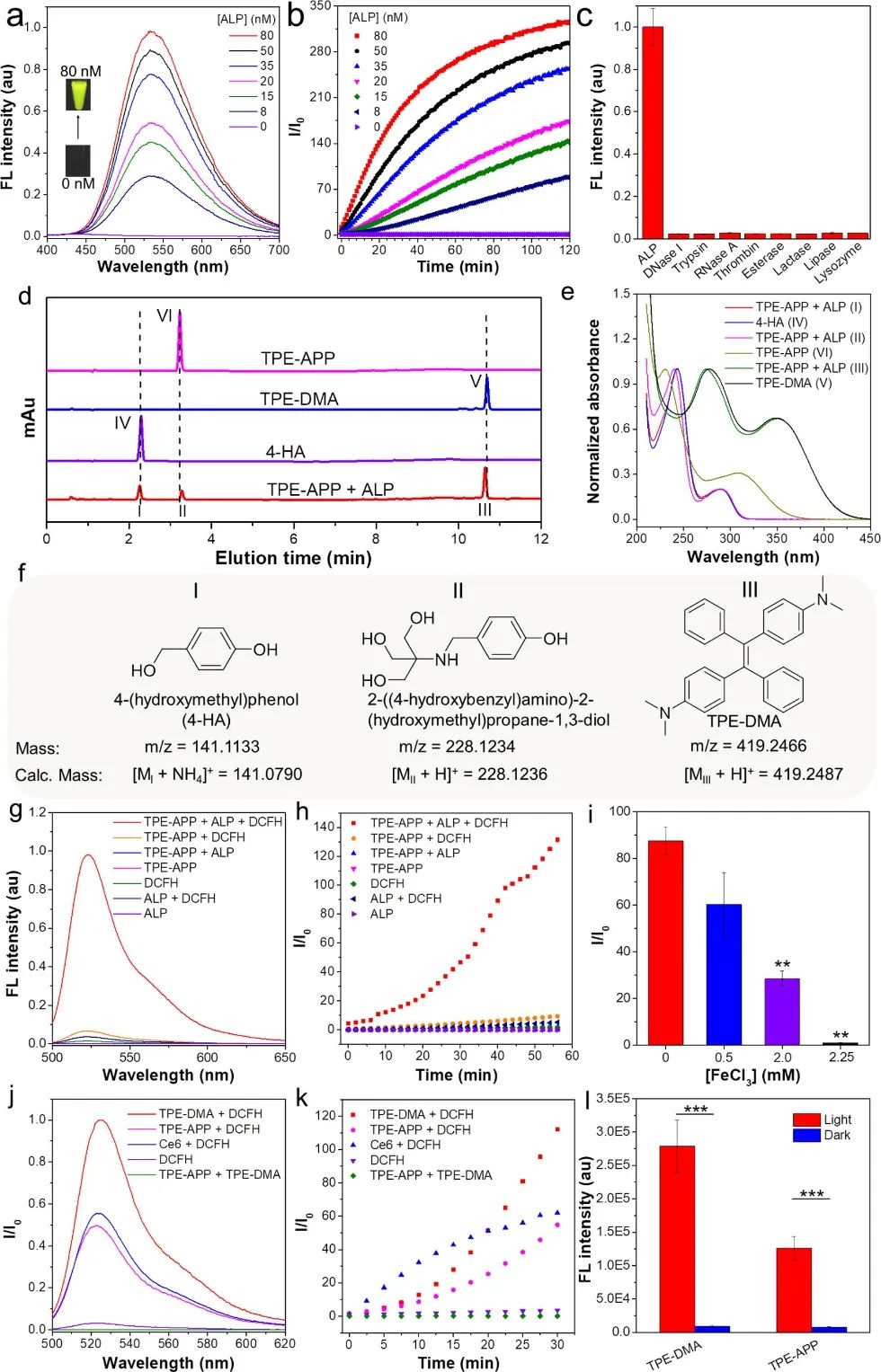
图2 激活的TPE-APP的光物理性质和ROS生成能力表征
选择性癌细胞成像和细胞毒性评价
研究团队选择高表达ALP的HeLa癌细胞和低表达ALP的MDCK正常细胞作为模型,探索TPE-APP探针对癌细胞的选择性成像以及杀伤。结果表明,TPE-APP能够在HeLa细胞中被激活,从而点亮HeLa细胞,而由于MDCK细胞ALP表达量极低,则无法激活TPE-APP探针而点亮细胞,从而实现了TPE-APP探针对癌细胞和正常细胞的选择性成像区分(图3)。免疫荧光分析结果表明,胞内水解产物TPE-DMA和ALP抗体(Alexa546-Ab)的荧光在HeLa细胞中具有很好的共定位效率,其皮尔森系数高达94.4%(图4a)。通过水解产物TPE-DMA与商品化细胞器的共染分析结果表明,激活的TPE-APP探针主要定位于细胞膜上,部分聚集于线粒体(图4b)。TPE-APP导致HeLa凋亡而MDCK无损,并且由于光动力与化学动力协同作用,TPE-APP在白光照射下对HeLa毒性大增。10 μM TPE-APP+白光照射对癌细胞杀伤高达91%,正常细胞存活超90%(图5)。综上所述,靶向激活的TPE-APP探针产生的化学动力活性分子和AIE光敏剂能够实现对癌细胞的靶向协同增强杀伤效果。
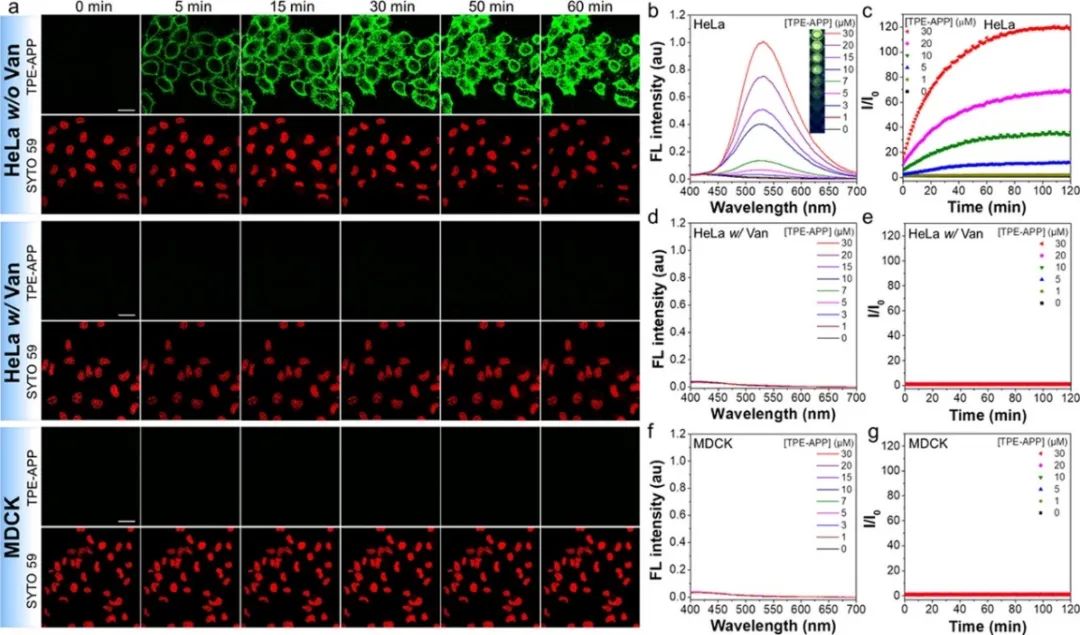
图3 TPE-APP探针鉴别癌细胞成像
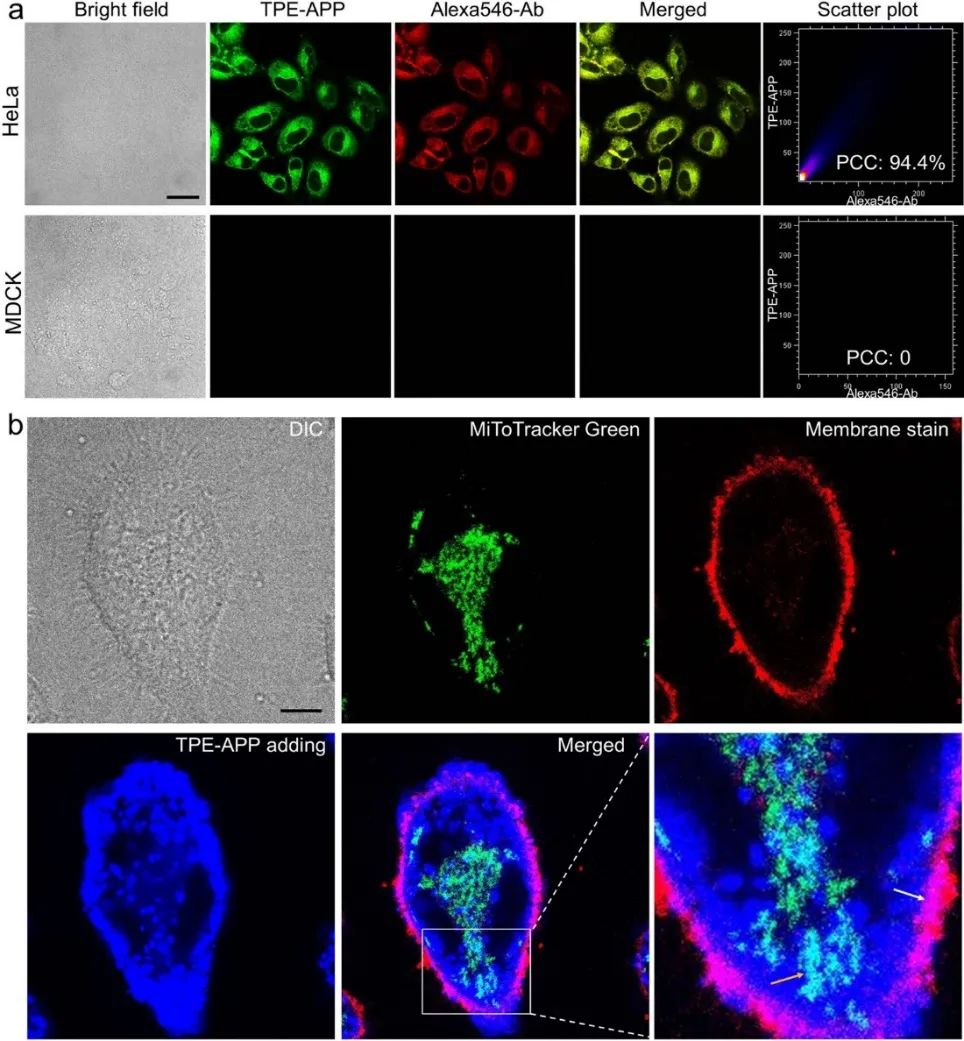
图4 TPE-APP探针的细胞内行为
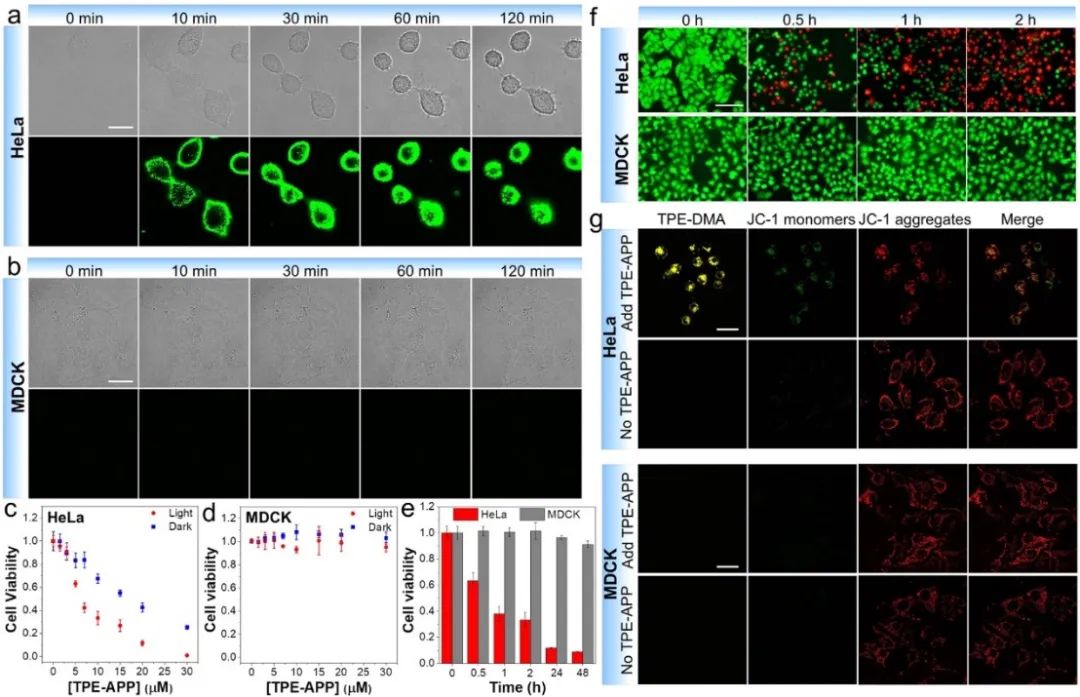
图5 TPE-APP探针选择性杀灭癌细胞
原位ROS生成与肿瘤细胞膜损伤
进一步研究TPE-APP探针的ROS生成与杀灭癌细胞机制。发现TPE-APP探针在HeLa细胞中ROS生成强,是由TPE-DMA、QM产生及GSH消耗协同作用导致的(图6a-b)。同时,激活的TPE-APP探针能够改变癌细胞线粒体的膜电势,从而进一步促进ROS的原位生成(图5g)。通过商品化细胞膜染料和激活的TPE-APP共染的实时示踪分析,发现HeLa细胞逐渐发射皱缩,同时细胞膜也出现明显的破碎(图6c)。由于细胞膜破碎后,乳酸脱氢酶(LDH)会释放至胞外,通过监测LDH进一步说明激活的TPE-APP能够在胞内原位产生的ROS,直接破坏细胞膜,导致癌细胞死亡(图6c-e)。此外,将TPE-APP与ALP表达量高、中、低水平的肿瘤细胞(HeLa、HepG2、RD)和正常细胞(MDCK)孵育,研究激活的TPE-APP对不同ALP表达量细胞的CDT-PDT效果。结果表明,TPE-APP对肿瘤细胞的CDT和PDT作用与细胞内ALP的表达水平密切相关,而ALP的表达水平决定了癌细胞的命运(图6f-i)。
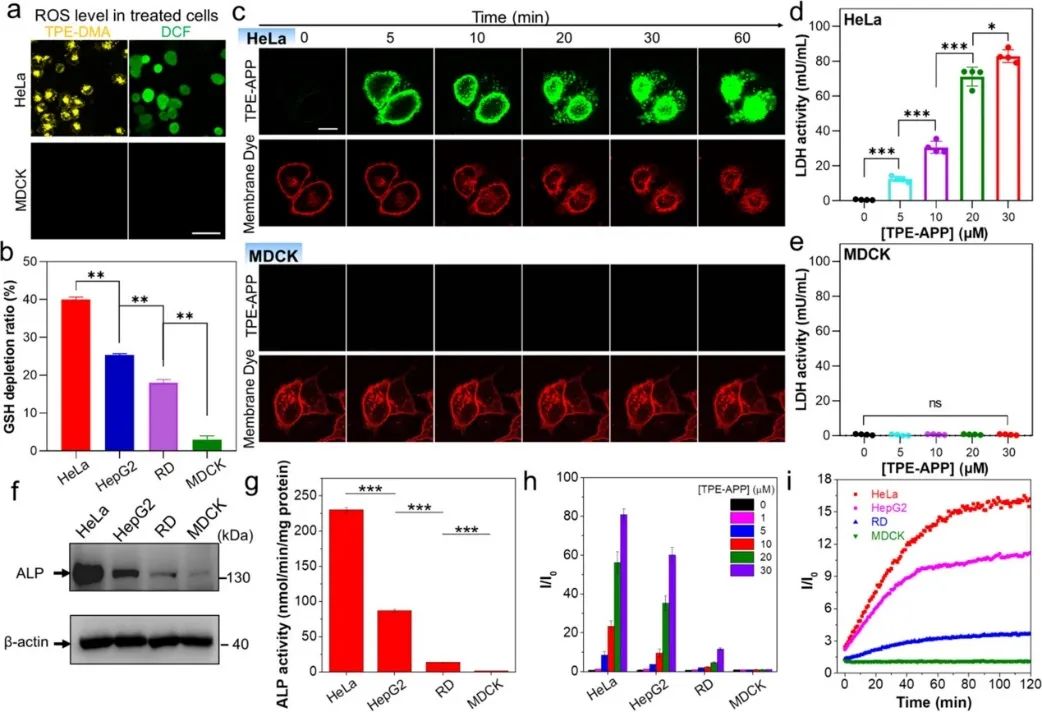
图6激活的TPE-APP生成ROS原位损坏细胞膜
体内肿瘤特异性成像和协同治疗
进一步评估TPE-APP探针在荷瘤小鼠中的选择性成像能力和其对体内肿瘤的抑制效果。结果表明,激活的TPE-APP探针能够监测活体内内源性ALP活性,同时能够利用PDT与CDT协同抑制肿瘤生长(图7)。此外,通过生化分析等对TPE-APP的体内生物相容性进行了全面评价,发现TPE-APP具有良好的生物安全性和生物相容性。
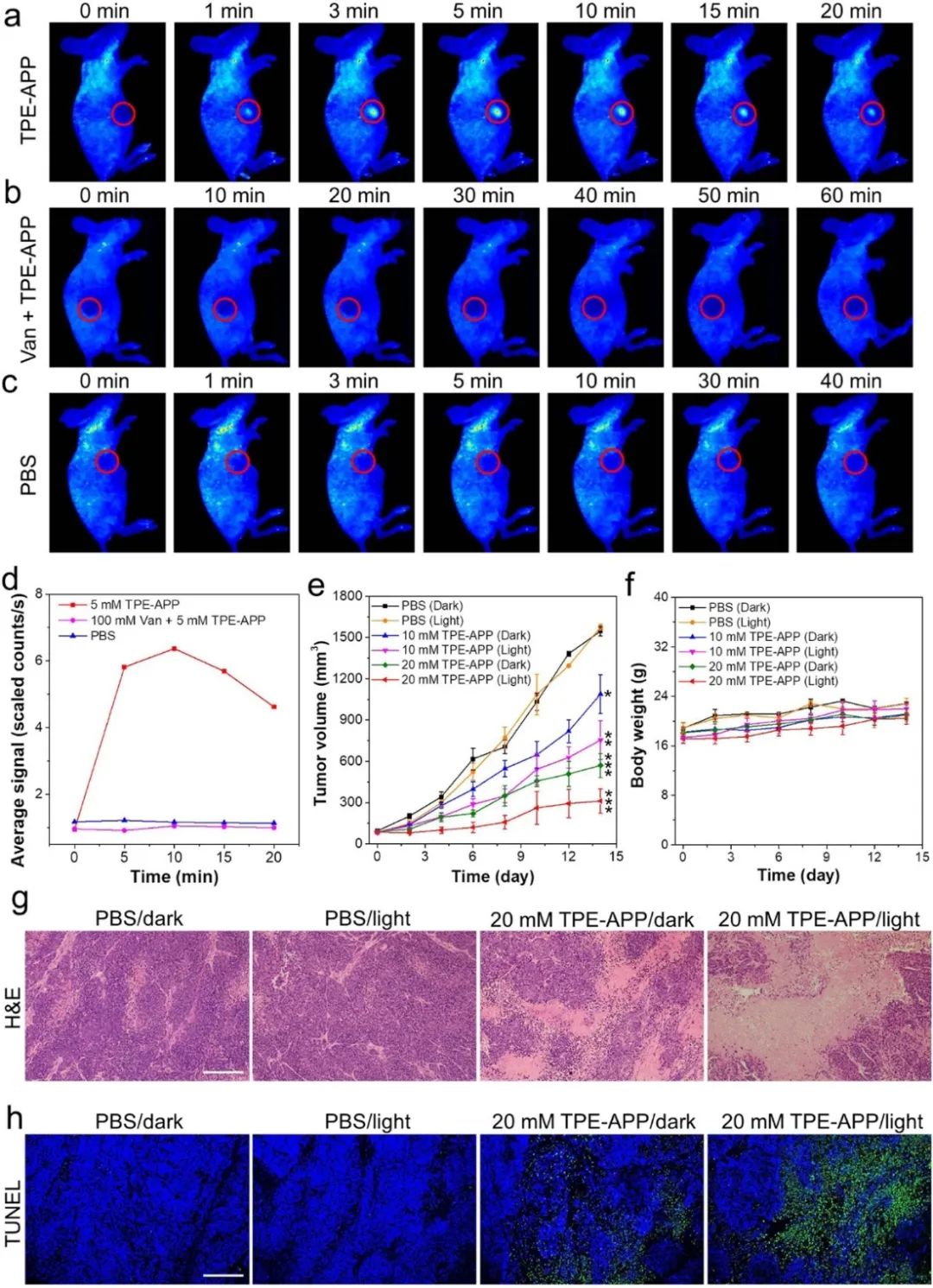
图7 荷瘤小鼠FL成像及联合治疗
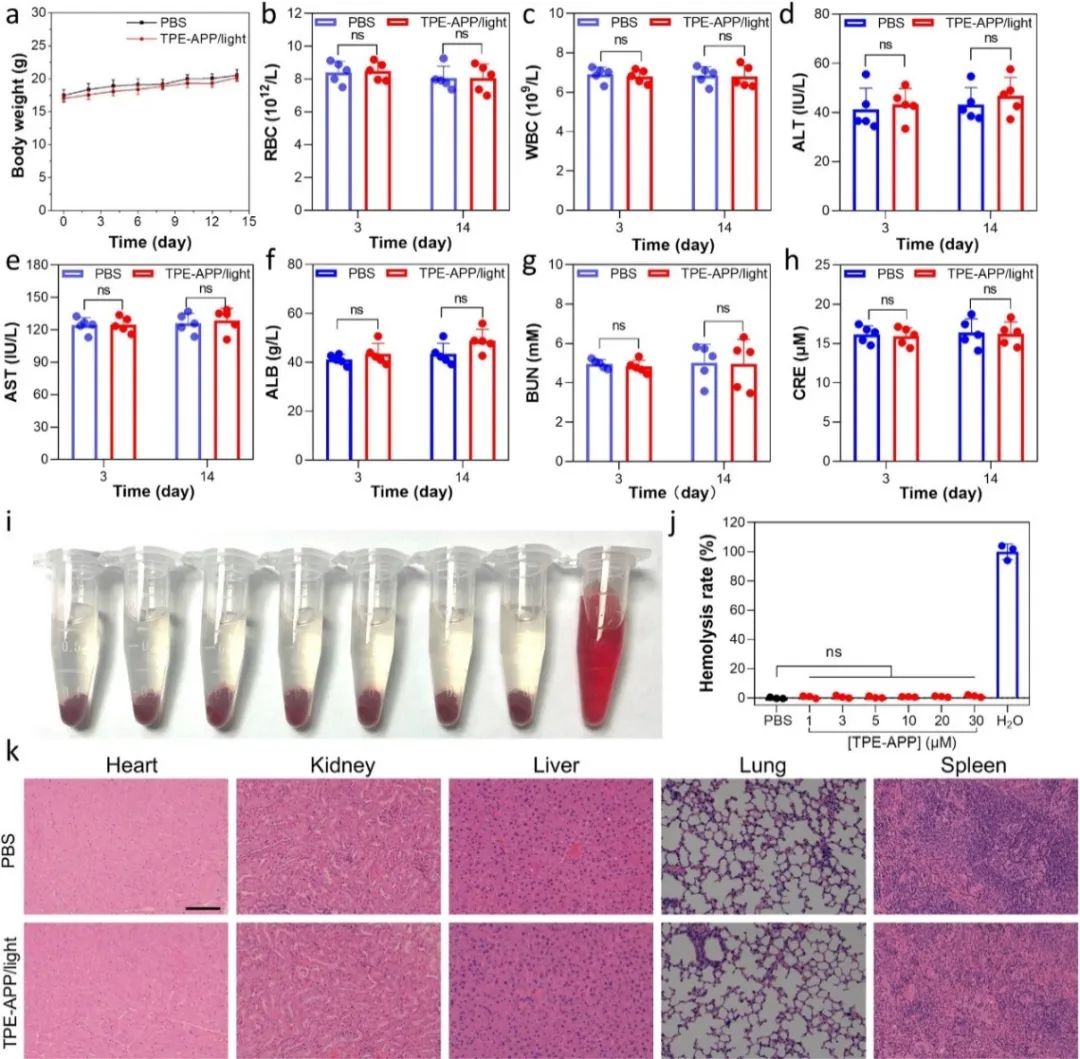
图8 TPE-APP探针的体内生物相容性
【小结】
总之,研究团队开发出了一种ALP响应型的多功能AIE探针(称为TPE-APP)。该探针对ALP具有稳定的选择性响应,不仅能够发射出高信噪比的强荧光信号,用于癌细胞选择性成像;同时,激活的TPE-APP探针具有光动力和化学动力活性,能够产生大量ROS,破坏癌细胞的细胞膜,实现对肿瘤的协同治疗。这种多合一策略为通过设计多功能肿瘤特异性生物标志物的响应探针来实现对肿瘤精确靶向诊断和治疗提供了方向。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c03879
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#癌症治疗# #光动力疗法# #化学动力疗法# #AIE探针# #碱式磷酸酶#
79