北科大徐晓光/北医三院张辛/南科大刘吉AM:超顺磁性复合水凝胶支架,用于骨关节炎再生的可体内动态监测
2024-07-08 BioMed科技 BioMed科技
研究合成新型多功能复合水凝胶支架用于骨关节炎治疗,具有良好软骨下骨修复特性,能无创监测,为OA再生提供治疗平台。
骨关节炎(OA)是一种普遍的疾病,其初期特征是软骨下骨折,目前尚无精确且特定的治疗方法。在这里,北京科技大学徐晓光、北医三院张辛和南方科技大学刘吉通过光聚合修饰的透明质酸(GMHA)作为基质,在羟基磷灰石基础上合成了一种新型多功能支架,该支架含有基于空心多孔磁性微球。体内软骨下骨修复结果表明,该支架的精心设计具有最适合软骨下骨修复的属性。支架内无机颗粒的多孔结构促进了装载的外源性血管内皮生长因子(VEGF)的有效传输。组装在微球中的Fe3O4纳米粒子促进骨髓间充质干细胞的成骨分化,并加速新骨生成。这些特性使支架展现出良好的软骨下骨修复特性,并获得了高软骨修复评分。治疗结果证明,软骨下骨支撑显著影响了上层软骨修复过程。此外,磁共振成像监测显示,Fe3O4纳米粒子在软骨下缺陷修复过程中逐渐被新骨所替代,允许无创且无辐射的评估,以跟踪OA修复过程中新生骨的发展。复合水凝胶支架(CHS)为OA治疗中的生物医学应用提供了一个多功能平台。该研究以题为“A Superparamagnetic Composite Hydrogel Scaffold as In Vivo Dynamic Monitorable Theranostic Platform for Osteoarthritis Regeneration”的论文发表在《Advanced Materials》上。

方案1展示了作为成骨再生治疗平台的水凝胶复合支架的设计和制造过程。该过程包括了羟基磷灰石-四氧化三铁(HAp-Fe3O4)微球的合成,这些微球具有独特的形态和优异的性质,通过特殊的两步水热合成法制备而成。这些微球的多孔结构有利于药物的装载和持续释放。此外,磁性成分的存在使得支架可以利用磁共振成像(MRI)在体内原位监测软骨下骨修复情况,并实时评估治疗效果。精心设计的复合支架在体外和体内测试中表现出色,包括持续的药物释放、生物成像和骨修复能力,这些都是治疗骨关节炎(OA)的关键要素。
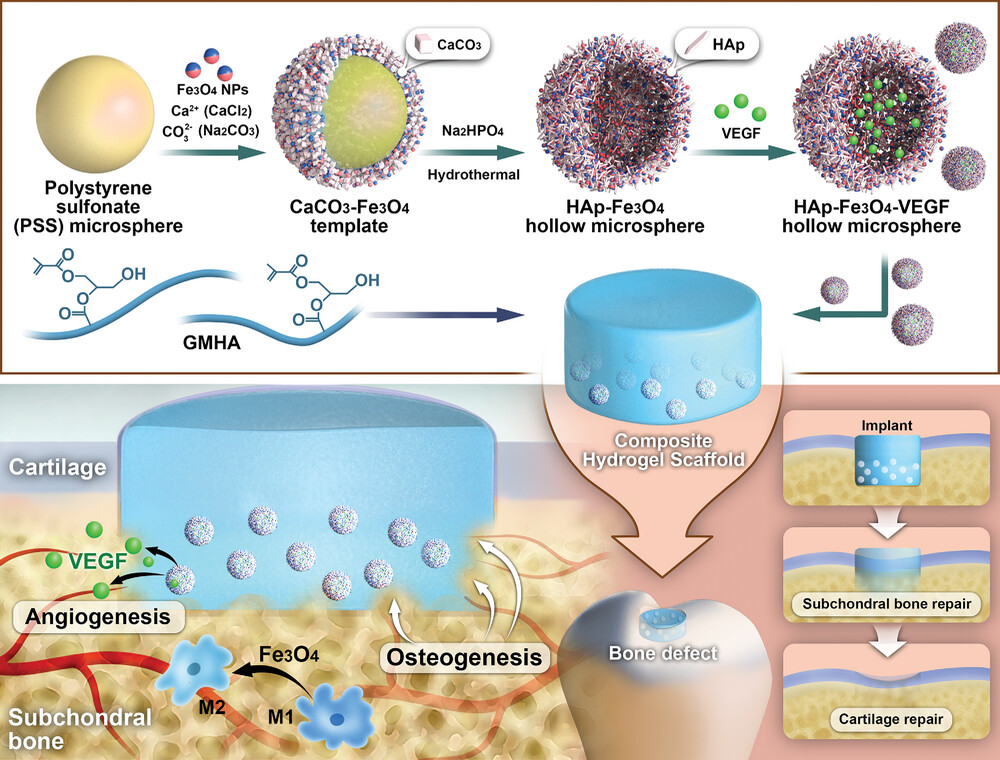
方案1. 水凝胶复合支架作为成骨再生治疗平台的设计和制造过程
【GMHA、HAp-Fe3O4微球和CHS的特征】
图1展示了GMHA(甲基丙烯酸缩水甘油酯修饰的透明质酸)和HAp-Fe3O4(羟基磷灰石-四氧化三铁)微球以及CHS(复合水凝胶支架)的特征。通过核磁共振(NMR)谱图验证了HA(透明质酸)主链的成功甲基丙烯酸化,热重分析(TGA)曲线显示了GMHA和CHS-H之间的显著差异,并且通过X射线衍射(XRD)和X射线光电子能谱(XPS)分析确认了HAp-Fe3O4微球的存在。磁滞回线表明了CHS-L和CHS-H具有优良的超顺磁性,为磁共振成像(MRI)测试提供了条件。扫描电镜(SEM)和透射电镜(TEM)观察以及能量色散X射线光谱(EDS)映射揭示了HAp-Fe3O4微球的多孔结构和Fe元素在壳层上的均匀分布。
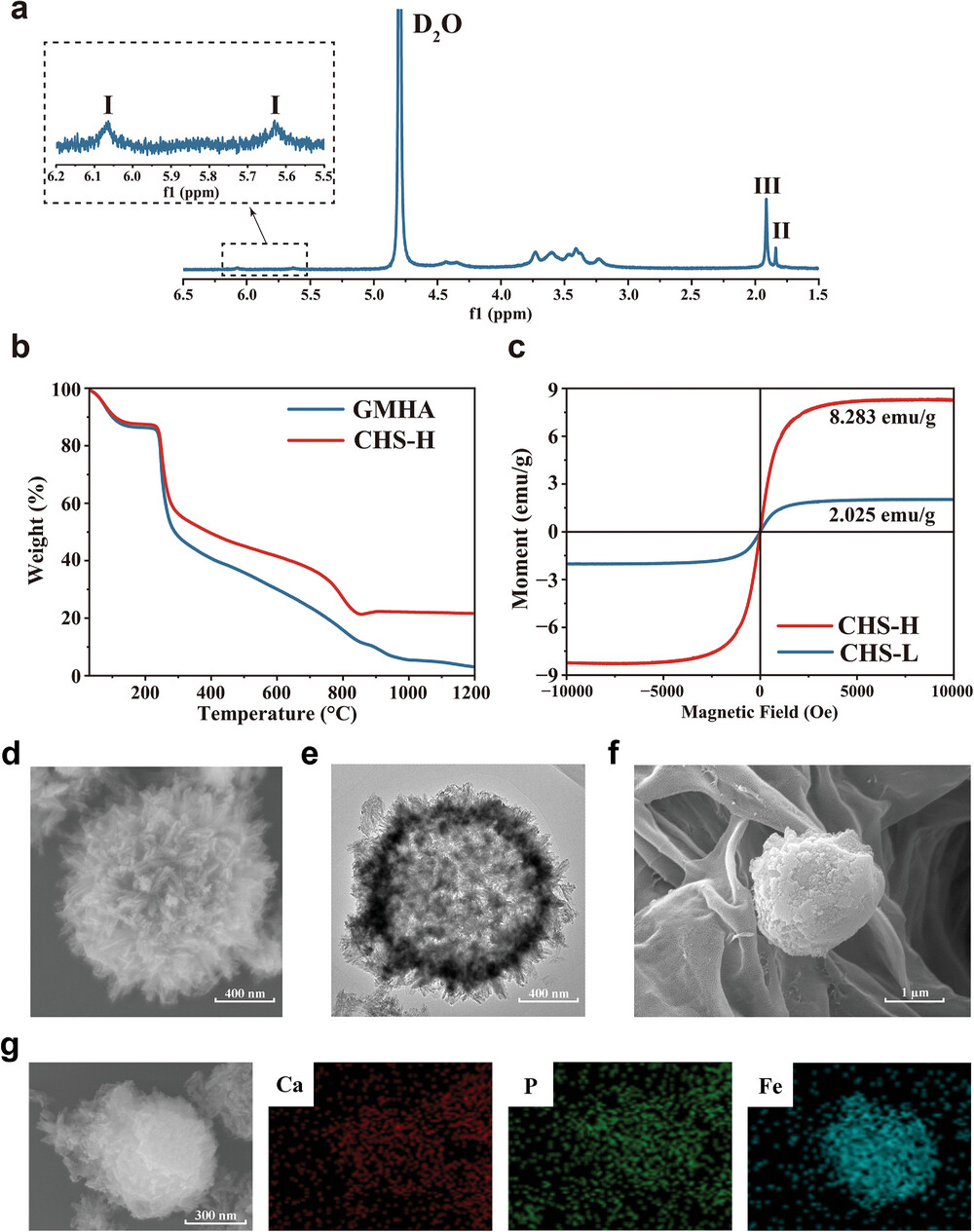
图1. GMHA、HAp-Fe3O4微球和CHS的特征
【无机-有机复合药物负载支架的性质】
图2通过流变学测试,研究了支架在不同频率下的储能模量(G')和损耗模量(G"),表明所有样品在10 Hz以下的频率范围内显示出凝胶状态。压缩测试显示,随着无机纳米粒子含量的增加,支架的压缩强度得到提高,从GMHA的355.5 kPa增加到CHS-H的759.6 kPa,这归因于无机粒子与有机网络结构的显著不同的机械性能。药物释放实验以对乙酰氨基酚为模型药物,结果显示所有支架在初始阶段快速释放药物,随后释放速度减慢直至达到平台期,7天后GMHA、CHS-L和CHS-H的药物释放率分别为96.86%、95.77%和97.21%,说明多孔HAp-Fe3O4微球的吸附性质影响了药物释放的持续时间。此外,利用MRI T2图像和弛豫率(1/T2)的测定,评估了支架作为MRI造影剂的潜力,发现随着无机粒子含量的增加,支架的弛豫率增加,这有助于体内实时监测软骨下骨的修复情况。
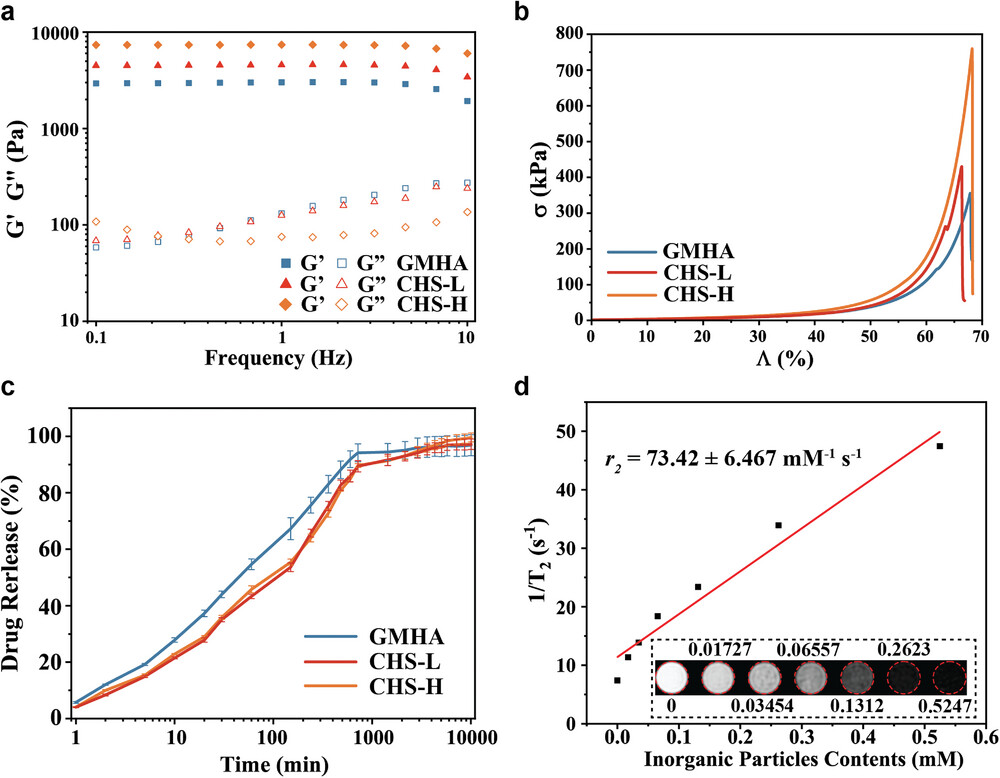
图2. 无机-有机复合药物负载支架的性质
【不同水凝胶中细胞行为的评估】
图3通过共聚焦激光扫描显微镜(CLSM)图像显示了在不同HAp-Fe3O4微球分数的CHSs中培养的细胞在第7天和第14天的存活状态。使用CCK-8试剂盒量化了细胞在水凝胶浸出液中的活性,结果表明水凝胶浸出液对细胞无毒性。免疫荧光染色图像展示了BMSCs在不同CHSs中培养后胶原蛋白I(COLI)的表达,CHS-H组中COLI表达最高,表明HAp-Fe3O4微球能显著促进成骨分化。此外,通过免疫组化染色评估了植入后14天的免疫反应,结果显示M2型巨噬细胞(抗炎型)的阳性反应强烈,而M1型巨噬细胞(促炎型)的反应较弱,这可能归因于Fe3O4引起的M1型巨噬细胞的铁死亡。
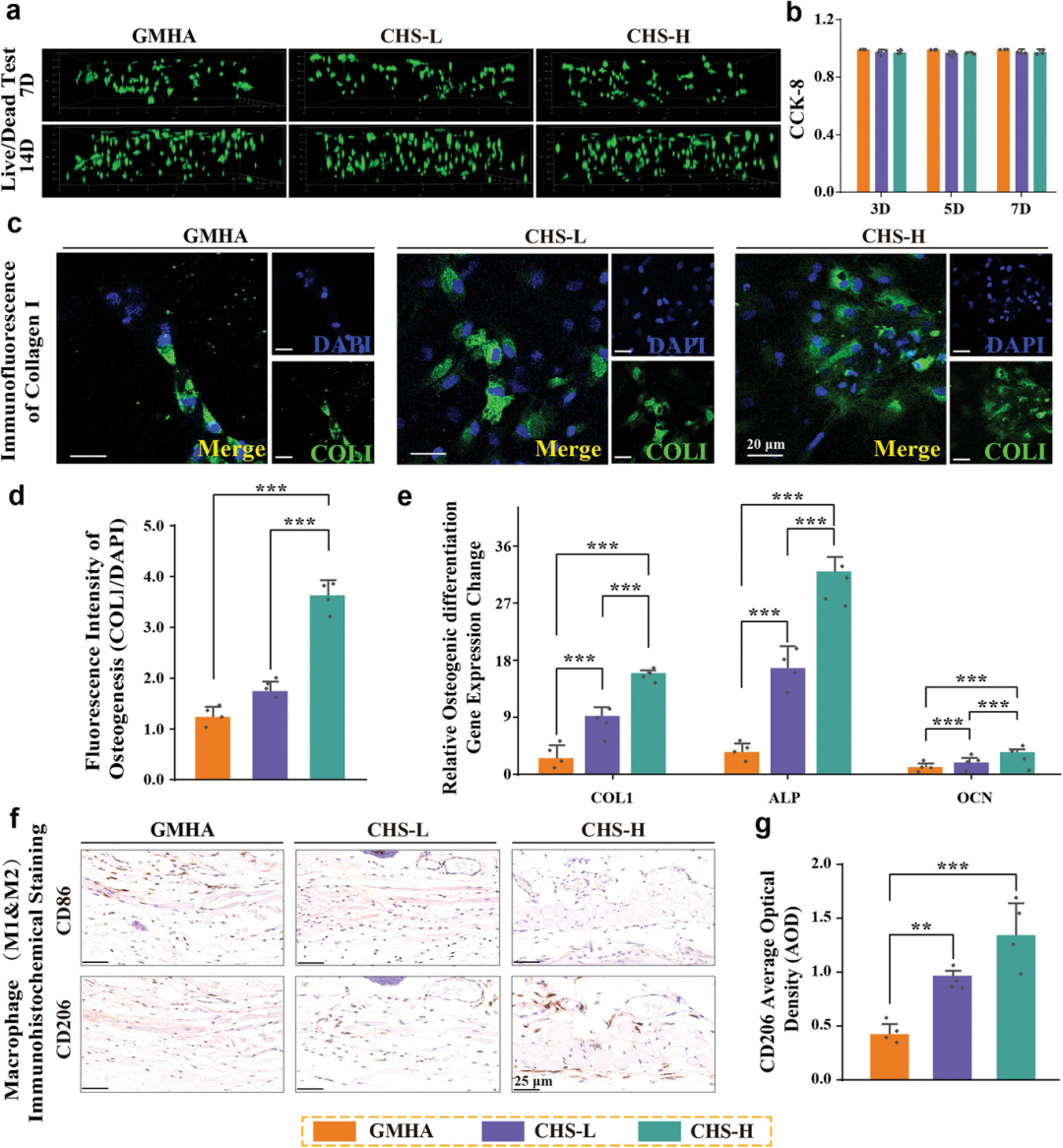
图3. 不同水凝胶中细胞行为的评估
【通过MRI原位追踪骨关节炎再生】
图4通过磁共振成像(MRI)原位追踪了骨关节炎(OA)再生过程。研究中使用了不同的复合水凝胶支架(CHS),包括GMHA、CHS-L、CHS-H和CHS-H+VEGF,这些支架被用于修复兔模型中的骨软骨缺陷。MRI图像显示,在植入初期,含有磁性粒子的CHS-H和CHS-H+VEGF部分能够通过MRI清晰地可视化,且视觉效果明显优于不含或含有较少磁性粒子的组别。随着植入后6周的代谢,这些组的T2信号逐渐减弱,表明新生骨的再生,尤其是CHS-H+VEGF组。到了12周,CHS-H+VEGF组的代谢趋于完成,原有的缺陷被新骨完全填充。相比之下,GMHA组由于缺乏磁性成像剂,在12周的再生过程中无法通过MRI观察到植入的水凝胶和新形成的骨头。此外,所有复合水凝胶组在6周后都能检测到新形成的骨头之间的连接,而CHS-H+VEGF组形成的新骨较其他两组更薄。这些结果表明,复合水凝胶支架不仅促进了软骨下骨的修复,而且通过MRI的成像效果,实现了对骨修复过程的长期、原位、无创跟踪。
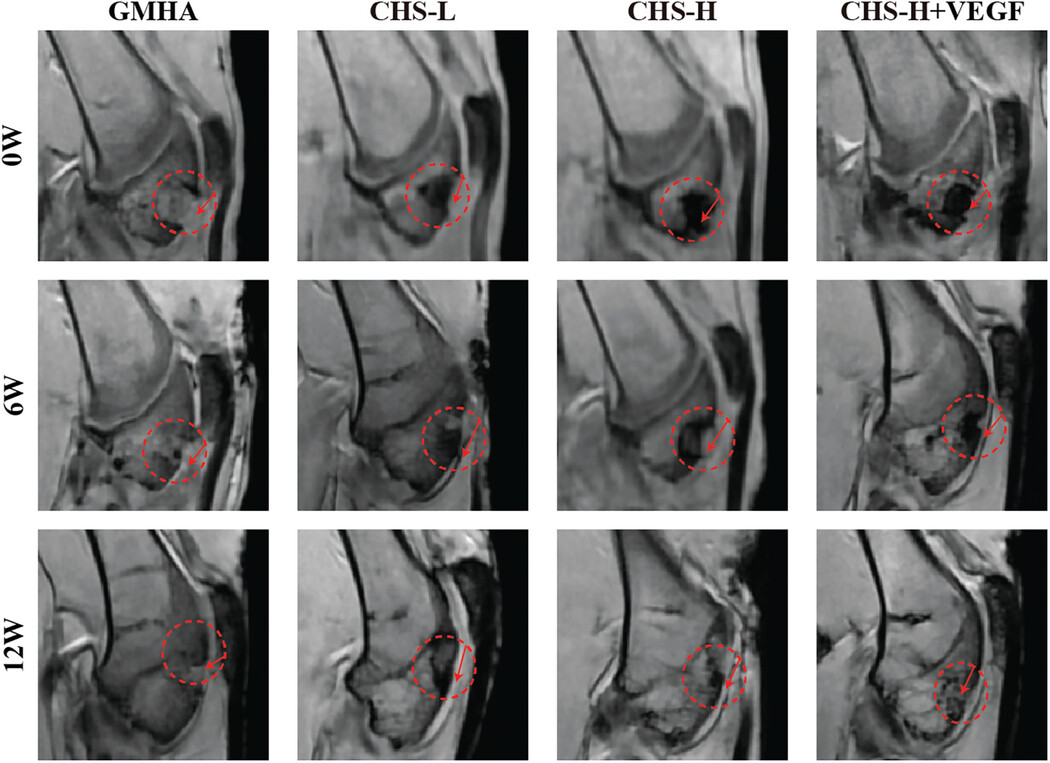
图4. 通过MRI原位追踪骨关节炎再生
【使用CHS作为治疗平台,在兔膝关节模型中体内修复全层骨软骨缺陷】
图5通过比较GMHA、CHS-L、CHS-H和CHS-H+VEGF组修复的骨软骨缺陷的代表性图像,发现CHS-H+VEGF组新形成的透明软骨在完整性和与周围组织的相似性方面表现最佳。国际软骨修复协会评分系统(ICRS)的定量评估结果显示,CHS-H+VEGF组的修复效果显著优于其他组。组织学评估通过H&E染色、甲苯胺蓝(TB)染色和Safranin O-Fast Green染色进行,进一步确认了CHS-H+VEGF组在再生受伤的软骨至骨界面组织方面的高效性。此外,通过微CT图像重建和定量分析,CHS-H+VEGF组新形成的骨组织成功填充了缺陷区域,并且骨小梁数量最多、间距最小,表明了其在软骨下骨重建方面的优越性能。这些结果表明,CHS-H+VEGF支架在促进骨软骨再生方面具有显著的修复效果,尤其是在添加了VEGF后,能显著提高修复组织的质量和整合度。
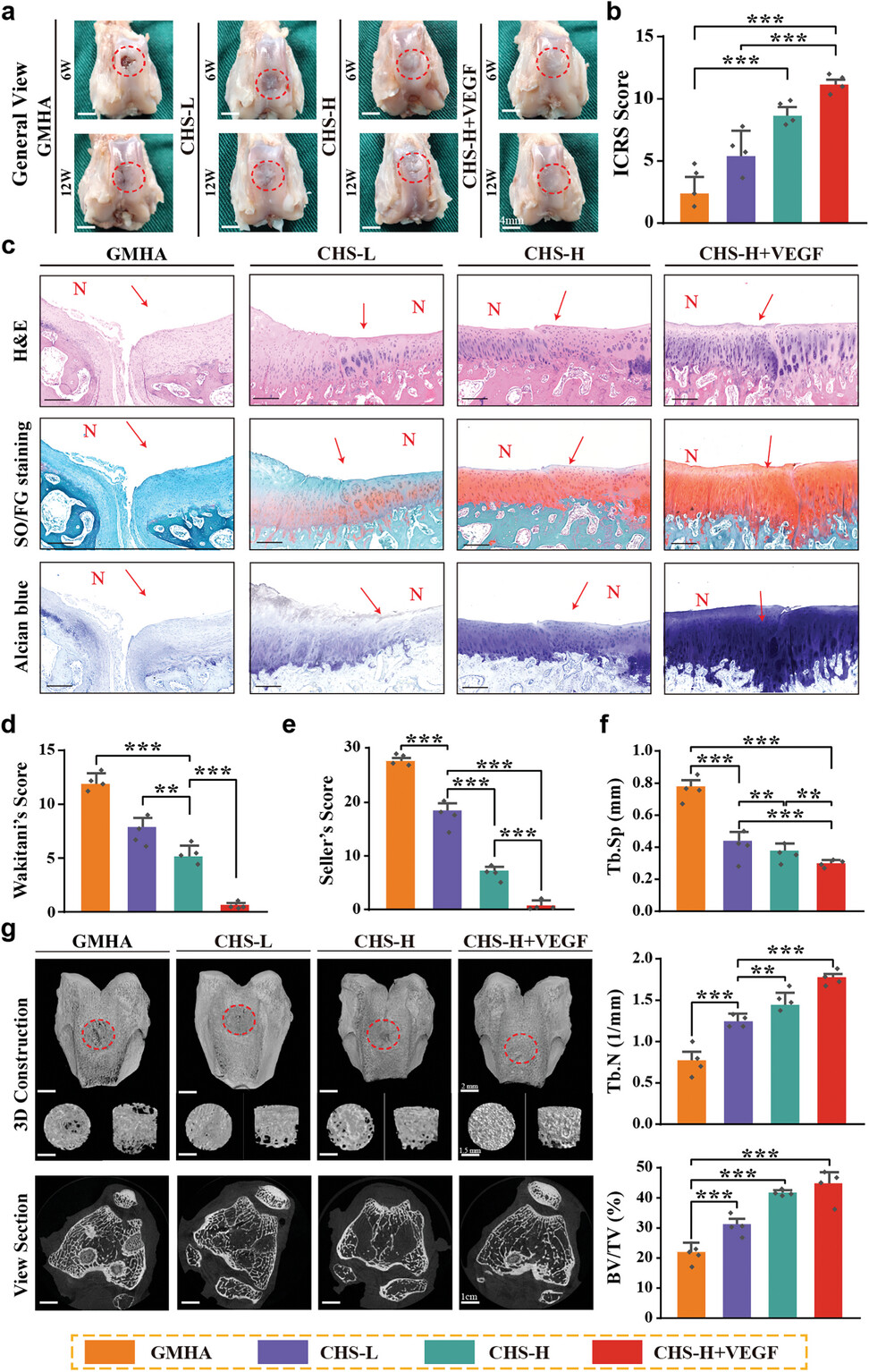
图5. 使用CHS作为治疗平台,在兔膝关节模型中体内修复全层骨软骨缺陷
【在不同CHS处理的修复组织中,12周术后修复软骨组织的定量分析】
图6通过纳米压痕测试和胶原纤维取向的定量分析,评估了不同复合水凝胶支架(CHS)处理后修复组织的生物力学特性和胶原纤维排列。结果显示,CHS-H+VEGF组修复的软骨组织表面几乎平滑,且其弹性模量最接近正常软骨,但与原始软骨相比仍有差距。Sirius红染色和偏振光显微镜观察表明,CHS-H+VEGF组的胶原纤维在表层区域的取向与正常软骨最为接近,而在深层区域的垂直取向也显示出良好的趋势。这些结果表明,CHS-H+VEGF支架在修复效果上表现最佳,尤其是在促进胶原纤维正确取向和提高修复组织生物力学性能方面,接近正常软骨的自然结构和功能。
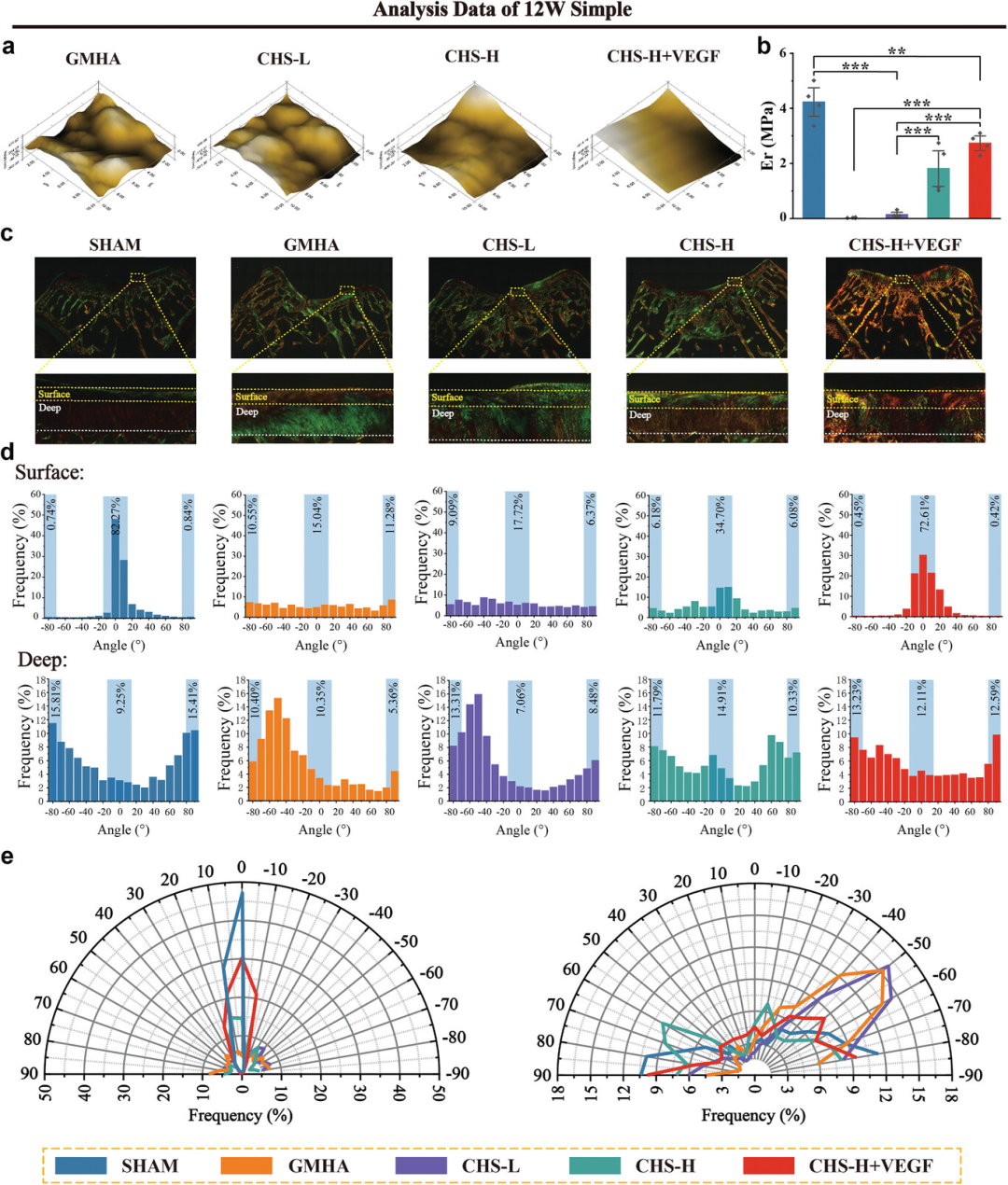
图6. 在不同CHS处理的修复组织中,12周术后修复软骨组织的定量分析
【小结】
该研究合成了一种复合水凝胶支架(CHS),并通过系统的评估验证了其适合的力学性能、体外降解性和药物释放能力。复合支架中羟基磷灰石-四氧化三铁颗粒的加入影响了水凝胶的网络结构及其随后的支架性能。通过细胞毒性试验验证了复合支架的生物相容性。动物模型为复合支架在修复和再生骨软骨缺陷中的作用提供了有力证据,并展示了软骨下骨对上层软骨的支持和修复作用。更重要的是,这种支架通过其磁性成像效应实现了软骨下骨和软骨的长期体内跟踪,满足了临床需求。经过进一步的研究和改进,CHS有望用于临床应用。
原文链接:
https://doi.org/10.1002/adma.202405641
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#骨关节炎# #复合水凝胶支架#
97