盘点:癌症免疫检查点疗法的现状与展望
2016-07-25 佚名 生物谷
越来越多的证据表明,天然或诱导产生的免疫反应能够有效针对肿瘤抗原产生反应,从而杀伤肿瘤细胞。临床试验也表明,肿瘤组织间隙的免疫细胞浸润能够促进癌症患者的治疗效果。研究者们通过寻找在不同肿瘤组织中浸润的淋巴细胞的类型、功能和空间分布等信息,能够改善针对癌症患者的诊断与治疗方案的设计。伴随这些临床试验的进展,研究者们对癌症的"免疫监视(immunosurveillance)"现象开始越来越关注,即
越来越多的证据表明,天然或诱导产生的免疫反应能够有效针对肿瘤抗原产生反应,从而杀伤肿瘤细胞。临床试验也表明,肿瘤组织间隙的免疫细胞浸润能够促进癌症患者的治疗效果。研究者们通过寻找在不同肿瘤组织中浸润的淋巴细胞的类型、功能和空间分布等信息,能够改善针对癌症患者的诊断与治疗方案的设计。伴随这些临床试验的进展,研究者们对癌症的"免疫监视(immunosurveillance)"现象开始越来越关注,即在除了少数特殊的环境下,肿瘤细胞能够被其特异性的免疫细胞杀伤。而上述的"特殊环境"指的是肿瘤微环境(TME)或癌症的免疫编辑作用造成免疫耐受性的细胞的产生。
过去几十年来,癌症的免疫疗法取得了突飞猛进的发展,"免疫监视"这一概念在临床上产生了巨大的现实意义。目前位于免疫疗法尖端的"免疫检查点阻断剂"对于很多癌症,尤其是恶性且化学药物耐受性癌症的治疗中有着明显的效果。其中,效果最显著的是"cytotoxic-T-lymphocyte-associated protein 4 (CTLA-4)"以及"programmed cell death 1 (PD-1)"两类免疫检查点阻断剂。
CTLA-4 与PD-1阻断剂的抗癌原理
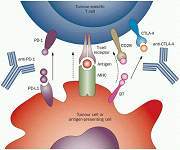
早期,在T细胞信号调控领域的研究者们发现了一类叫做Ctla4的基因,在T细胞激活的状态下,该基因能够表达CTLA-4蛋白。CTLA-4与T细胞的共刺激因子CD28具有很高的结构同源性。功能上,CTLA-4与CD28类似,都能够与抗原呈递细胞表面的B7(CD80 & CD86)结合,而且前者的结合能力明显更强。之后,研究者们发现CTLA-4与B7的结合能够有效阻断T细胞与APC的相互作用,从而抑制T细胞的激活。这一发现意味着:CTLA-4的活性一旦被人为抑制,则能够让T细胞充分地激活,这对于肿瘤免疫反应具有正面的调控作用。
许多前临床期的研究都证实了这一假设,而且导致一类叫做"ipilimumab"的特异性识别CTLA-4的单克隆抗体的产生并且应用于癌症的临床治疗试验中。除了促进共刺激因子的识别之外,靶向CTLA-4的抗体还能够清除体内肿瘤微环境中的调节性T细胞(Treg)。由于肿瘤微环境中的Treg细胞能够抑制肿瘤抗原特异性T细胞免疫反应,而且其表面表达大量的CTLA-4蛋白,因此这一靶向抗体的刺激能够有效激活肿瘤微环境中的T细胞免疫反应,从而提高机体对肿瘤细胞的清除能力。
PD-1与CTLA-4都表达于激活的T细胞表面。PD-1的激活能够下调T细胞激活后TCR传递的胞内信号。PD-1有两类天然受体,PD-L1与PD-L2。PD-L2主要表达于抗原呈递细胞表面,而PD-L1则广泛表达于多种细胞类型,包括肿瘤细胞、免疫细胞、上皮细胞、内皮细胞等等。研究表明,PD-L1的表达受到IFN-g的调节,而这一效应能够帮助肿瘤细胞逃离免疫监视。另一方面,PD-L1能够与T细胞表面的CD80分子结合,这使得该分子相关的信号调节变得更加更加复杂。
已知的免疫检查点药物
如今,已经有4种免疫检查点阻断剂得到了FDA的批准:1、上文提到的CTLA-4单抗ipilimumab,用于治疗恶性的黑色素瘤患者;2、一类PD-1阻断性单抗pembrolizumab,用于治疗恶性的黑色素瘤患者以及表达PD-L1的非小细胞肺癌患者;3、靶向PD-1的单抗nivolumab,用于治疗恶性的黑色素瘤患者以及表达PD-L1的非小细胞肺癌患者,且对常规化疗没有反应的癌症患者以及恶性的肾癌患者也有效;4、靶向PD-L1的单抗atezolizumab,用于治疗晚期或恶化的、对常规化疗没有反应的尿道肿瘤患者。这些获批的药物在将来可能能够应用于更多癌症类型的治疗,同时也会有其它的免疫检查点阻断剂的加入。
免疫检查点阻断剂在癌症治疗中的局限性
虽然以上药物在临床应用中取得了明显的治疗效果,但事实上大部分癌症患者对免疫检查点阻断剂都没有阳性反应,或者由于副作用的存在而不得不停止使用。对于ipilimumab来说,它的临床治疗阳性反应率仅有15%;针对PD-1-PD-L1信号的相关药物阳性比例很少超过40%。总之,目前有两类问题需要解决:
1、为什么不同的患者对于免疫检查点抑制剂的反应有如此明显的差别?
2、如何才能进一步扩大免疫检查点阻断剂的广谱性,使之成为对大多数癌症患者均适用的治疗选项?针对这两大问题,我们需要了解肿瘤微环境中的免疫反应内在机制。
限制肿瘤免疫检查点疗法的因素分析
1. 来自肿瘤微环境的影响。
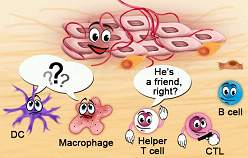
如今,我们普遍认为癌症细胞倾向于与组织周围的基质、基质细胞以及免疫细胞协同分化,并共同作用导致肿瘤微环境的形成。肿瘤微环境能够促进慢性炎症反应,抑制免疫反应以及促进肿瘤组织的血管生成作用。
T细胞要想完成对肿瘤的“免疫监视”作用,需要完成三个步骤:
1. 被外周淋巴结中的肿瘤特异性树突状细胞激活;
2. 通过肿瘤血管以及层层的屏障到达肿瘤组织;
3. 识别并杀伤肿瘤细胞。
完成这三个步骤的前提是需要足够多的肿瘤特异性抗原的产生。
然而,癌症恶化过程中,肿瘤细胞经常会阻碍T细胞完成上述三个中的任意一个或多个步骤,从而导致免疫逃逸现象的出现。由于T细胞是免疫检查点疗法的核心力量,因而T细胞活性的阻断势必会影响该疗法的效果。一些肿瘤微环境中,肿瘤细胞表面的PD-L1会上调。而针对这种类型的癌症,抗PD-L1的治疗效果则十分显著。色氨酸的代谢是另外一个导致免疫逃逸的机制。色氨酸能够被一种由髓系细胞分泌的叫做IDO的酶分解生成犬尿氨酸,而犬尿氨酸被认为能够抑制T细胞的克隆增殖并促进其发生失活效应以及细胞凋亡。在一些临床治疗中,结合PD-L1阻断剂与IDO阻断剂的联合治疗手段效果明显高于单独使用PD-L1,这也间接证明了上述观点。
肿瘤微环境中的基质细胞能够阻止T细胞与癌细胞的直接接触。研究表明,肿瘤微环境中的某些成分能够通过表观遗传修饰的方式下调T细胞中Cxcl9以及Cxcl10的表达,这一效应会导致T细胞难以跨越屏障进入肿瘤微环境中对癌细胞进行杀伤。此外,由于肿瘤微环境中缺少能够表达IFN-g的DC,因此T细胞的激活会受到明显的影响。研究表明,如果人为地提高肿瘤相关DC与T细胞互作时IFN-g的表达水平,而能够有效促进激活的T细胞向肿瘤组织的迁移。
2. 来自癌细胞本身的影响
癌细胞内源性的信号也参与了免疫逃逸的效应。研究表明黑色素瘤细胞中癌基因WNT-b-catenin的表达能够抑制ILC与CD103+ DC向肿瘤微环境中的浸润,这一过程主要是由于趋化因子CCL4的缺失。其它一些基因,例如PI3K、STAT、EGFR等的失活突变也能够导致癌细胞对肿瘤检查点阻断剂疗法的耐受效应的产生。
造成癌细胞的耐受现象的出现,主要原因包括癌细胞本身的突变;微环境中的特殊炎症状态对癌细胞代谢信号调控的影响;死亡细胞相关分子(DAMP)的刺激对癌细胞的影响等等。
3. 其它因素
除了肿瘤微环境以及癌细胞内源信号的特征以外,患者的其它一些生理特征也造成了免疫疗法效应不佳的结果。其中包括年龄、HLA类型、遗传背景、饮食与代谢差异以及慢性感染病史等。
肠道微生物促进癌症免疫疗法的治疗效果
越来越多的证据表明,人体的细胞数量远远不及机体寄生的微生物,其中大部分微生物存在于肠道中。通过高度的共生化互作,肠道的益生菌能够调节机体的生理状态,并使之达到最佳水平。肠道微生物参与调节了宿主的营养代谢,排毒反应,抗感染,调节肠道稳态以及促进免疫与神经系统的成熟。而人体也为这群微生物提供了充足的养分,适宜的生活环境。总之,肠道微生物促进了人体遗传与代谢多样性的形成。
由于体内大量微生物的存在,而同时宿主又必须对病原体有足够的免疫监视能力,因此,肠道微生物与免疫系统在长期的进化过程中产生了高度的默契。这种稳态一旦遭到破坏,会引发一系列的自体免疫疾病,例如肥胖、糖尿病、IBD非酒精脂肪肝等等。很多研究表明,不同的微生物或其代谢产物能够调节宿主的免疫反应。例如,肠道的微生物就能够促进局部的免疫系统中Treg细胞的分化与激活,这也是免疫耐受的形成机制之一。
临床治疗结果显示:化疗与放疗会导致患者肠道共生菌稳态的紊乱;反之,肠道的微生物菌群也能正向或反向地干预癌症治疗的效果(通过药物干预或免疫调节等方式)。具体地,目前肠道微生物参与的抗癌免疫调节作用已经被用于辅助癌症的化学治疗。化疗药物cyclophosphamide能够促进多种格兰氏阳性菌从肠道向淋巴结迁移,并进一步促进Th-17的分泌。临床结果也表明,健康的肠道微生物对于癌症的化疗效果具有关键的作用。
就免疫检查点阻断剂的癌症治疗来讲,有证据表明CTLA-4的阻断疗法能够通过影响上皮间淋巴细胞与肠道表皮细胞的稳态而促进多种拟杆菌属的菌类的增殖,这些细菌能够通过影响粘膜处的DC促进抗肿瘤Th1细胞的激活。临床试验结果表明,在接受了ipilimumab治疗后,有患者表现出肠道拟杆菌数量的上升,也间接证明了上述观点。
未来的免疫检查点阻断剂发展方向
一方面,我们可以通过操纵微生物组对免疫检查点疗法的治疗效果增加系统的筛选,找到综合性的治疗方案;另外,分离对免疫检查点疗法有反应的患者体内的癌症微生物组,并进行患者间的移植,以期能够提高癌症免疫疗法的广谱性与个体治疗效果。具体地,我们如果能够找到促进肿瘤免疫反应的微生物抗原结构,并将其作为肿瘤疫苗的组成部分进行研发,可能会有意想不到的效果。(生物谷Bioon.com)
参考文献:
作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





能不能收藏啊
95
深度好文
111
#免疫检查点#
65
#免疫检查点疗法#
75
学习学习!
157