Cell:科学家们开发出更精准、更高通量的分析基因新方法
2017-08-14 佚名 生物探索
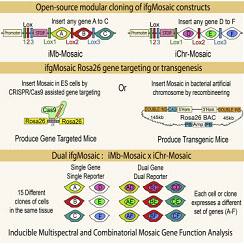
发表在8月10日Cell上西班牙科学家开发的新方法允许任何研究人员在脊椎动物模型中诱导多谱系基因嵌合体,如小鼠和斑马鱼;可以让不同的细胞群在同一个组织中被诱导,并且可以同时成像,所以对它们行为差异的分析可以为研究基因的功能提供精确数据和新见解。

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#新方法#
33
#高通量#
29
#CEL#
27
#Cell#
29
#精准#
34