Cell:膜蛋白质量控制机制新框架
2013-07-31 Cell bio360
日前,美国国立卫生研究院(NIH)与英国 MRC 分子生物学实验室的研究人员采用多种研究方法,提出了去泛素化酶在膜蛋白降解决定过程中的新作用,为膜蛋白质量控制机制提出了一种新框架。相关研究论文刊登在了近期出版的《细胞》(Cell)杂志上。 膜蛋白在机体生物学中扮演了重要的角色,有些膜蛋白可作为“载体”而将物质转运进出细胞。有些膜蛋白是激素或其他化学物质的专一受体,如甲状腺细胞上有接受来自脑垂
日前,美国国立卫生研究院(NIH)与英国 MRC 分子生物学实验室的研究人员采用多种研究方法,提出了去泛素化酶在膜蛋白降解决定过程中的新作用,为膜蛋白质量控制机制提出了一种新框架。相关研究论文刊登在了近期出版的《细胞》(Cell)杂志上。
膜蛋白在机体生物学中扮演了重要的角色,有些膜蛋白可作为“载体”而将物质转运进出细胞。有些膜蛋白是激素或其他化学物质的专一受体,如甲状腺细胞上有接受来自脑垂体的促甲状腺素的受体,细胞的识别功能也决定于膜表面的蛋白。
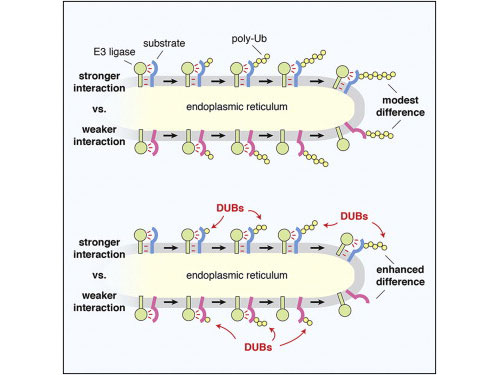
新合成的膜蛋白需要泛素连接酶复合物检测,走向降解与非降解的两条命运,但是经过多年研究,科学家们对于这一过程中底物-连接酶之间的相互作用,出现的细微差别如何会造成了完全不同的最后结果的作用机制,并不清楚。
在这项研究中,科学家利用来自病毒介导的降解途径中的纯化组分,重构了脂质体中膜蛋白识别过程,以及泛素化过程。由此发现膜上的底物-连接酶之间的相互作用,能够直接影响泛素组件调节多泛素化的过程。
而且令研究人员感到惊讶的是,但就是这种差异过程还不能解释培养细胞中降解和非降解的不同命运。之后研究人员又通过计算机模拟,实验分析发现持续的去泛素化是最大底物差异的一个先决条件,去泛素化酶能降低多泛素化停留时间,从而更快释放底物和酶,这解释了底物-酶之间相互作用的微小差别,能被放大到降解的这种更大差异。
这些研究结果为膜蛋白质量控制机制提出了一种底物差别的新框架,揭示了一种膜蛋白降解的新作用机制。
Zai-Rong Zhang, Juan S. Bonifacino, Ramanujan S. Hegde. Deubiquitinases Sharpen Substrate Discrimination during Membrane Protein Degradation from the ER. Cell, 25 July 2013; DOI: 10.1016/j.cell.2013.06.038
作者:Cell
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#质量控制#
76
#膜蛋白#
35
#白质#
49
#CEL#
31
#Cell#
26