CLIN CANCER RES | FDA批准摘要:西达基奥仑赛治疗复发或难治性多发性骨髓瘤
2024-05-12 daikun MedSci原创
西达基奥仑赛在经过多线治疗后的复发/难治多发性骨髓瘤患者中显示出显著的疗效,FDA根据CARTITUDE-1研究批准西达基奥仑赛上市。
多发性骨髓瘤(MM)是美国第二大常见血液肿瘤,占所有癌症的1.8%和所有血液肿瘤的17%,对于经主要抗骨髓瘤疗法如蛋白酶抑制剂、免疫调节剂和抗CD38抗体治疗后复发或难治的多发性骨髓瘤患者,现有的挽救疗法效果不佳,生存期较短,因此需要新的治疗方法,西达基奥仑赛是一种基因改造的T细胞产品,通过慢病毒载体表达靶向B细胞成熟抗原(BCMA)的嵌合抗原受体(CAR),2022年2月,美国FDA批准西达基奥仑赛用于治疗经过至少4线治疗(包括免疫调节剂、蛋白酶抑制剂和抗CD38抗体)后复发或难治的多发性骨髓瘤成人患者,支持该批准的主要依据是CARTITUDE-1研究,这是一项单臂、开放标签、多中心的II期临床试验,FDA认为西达基奥仑赛在该适应症患者中的获益大于风险,因此批准其上市。

方法
该研究是一项单臂、开放标签、多中心II期临床试验,纳入包括接受至少3线以上治疗(包括免疫调节剂、蛋白酶抑制剂和抗CD38抗体),并在最后一线治疗后12个月内出现疾病进展的成年复发/难治多发性骨髓瘤患者,共纳入113例患者,其中97例可评估疗效,首先进行淋巴细胞耗竭化疗(环磷酰胺+氟达拉滨),3天后进行CAR-T细胞输注(0.5-1.0 x 10^6/kg体重),研究的主要终点为独立审查委员会根据国际骨髓瘤工作组(IMWG)2016年标准评估总体反应率(ORR)。
研究结果
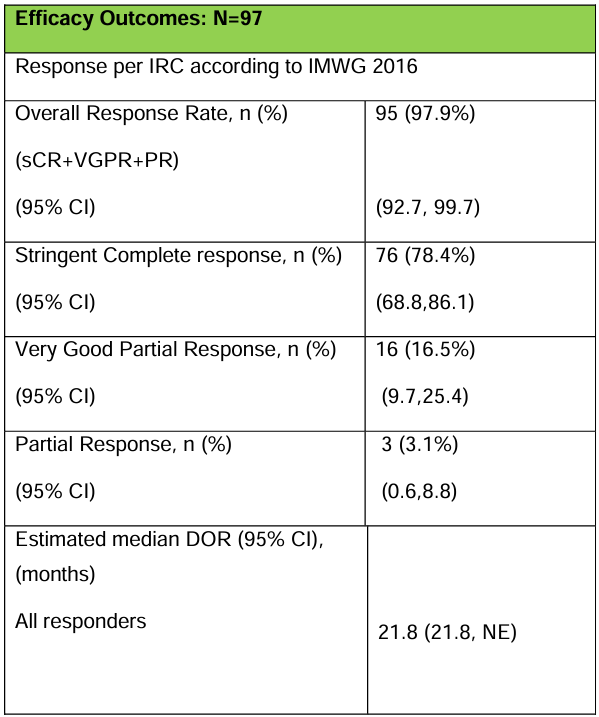
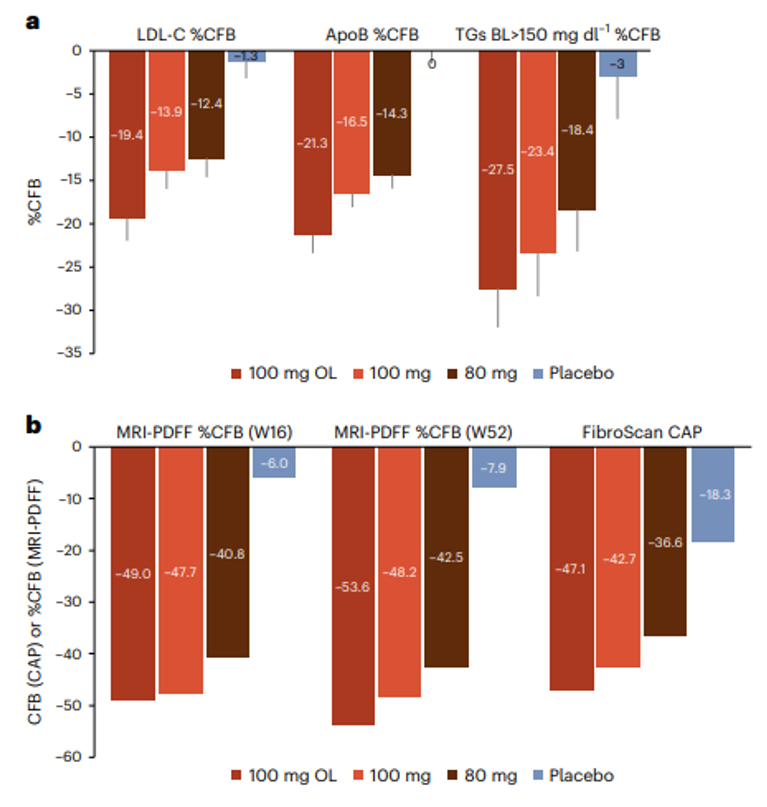
在可评估疗效的97例患者中,ORR达到97.9%,95%置信区间为92.7-99.7%,在可评估疗效的97例患者中,sCR达到78.4%,95%置信区间为68.8-86.1%,在所有95例反应患者中,中位反应持续时间为21.8个月,95%置信区间为21.8个月-无法估计。
安全性分析
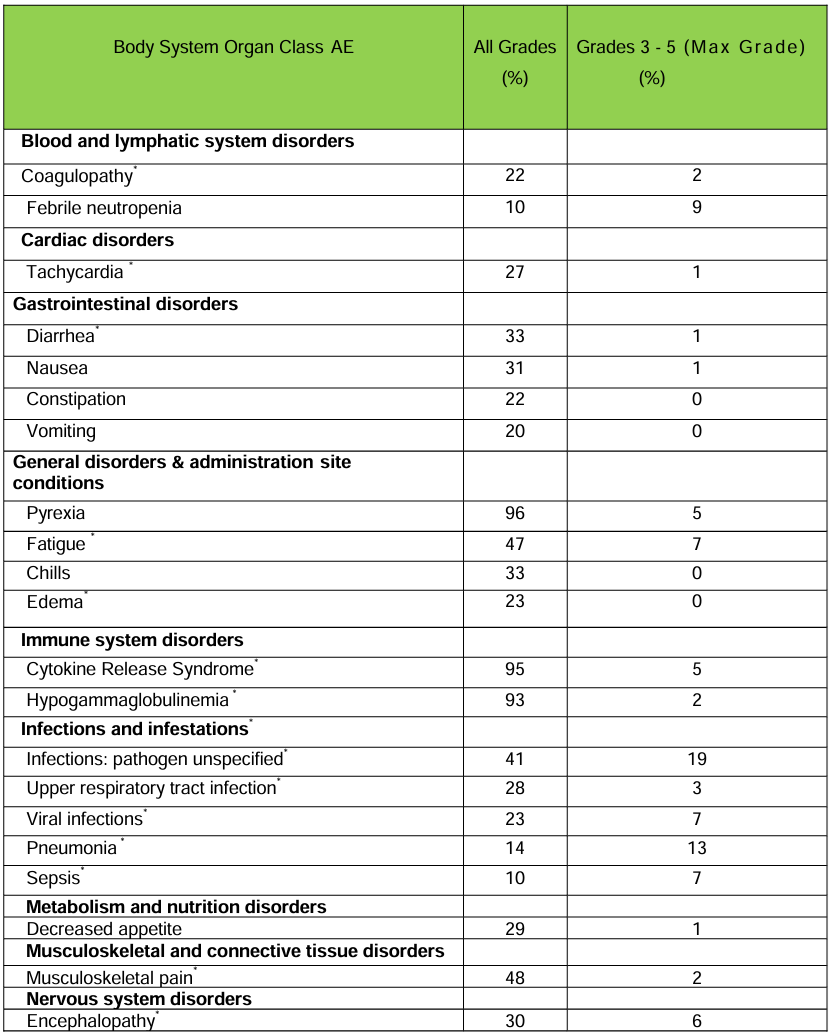
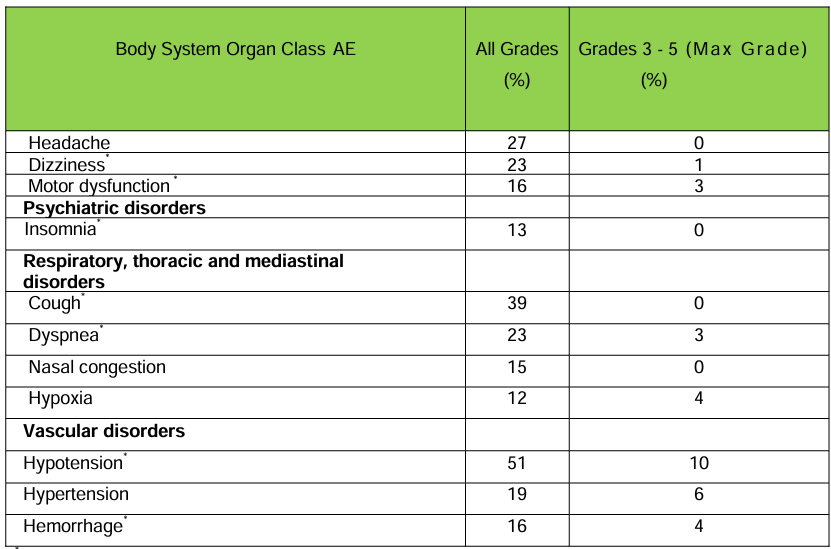
主要不良反应包括细胞因子释放综合征、神经系统毒性、长期血细胞减少等,发生率较高,在97例患者中,55%发生了严重不良事件,涉及细胞因子释放综合征、神经系统毒性、感染等,在97例患者中,9%死亡,主要死因包括细胞因子释放综合征、感染、神经系统毒性等,采取了相应的处理措施,如使用托珠单抗、皮质类固醇、抗癫痫药物等,以及针对血细胞减少给予支持治疗来进行不良反应处理,总体而言,西达基奥仑赛的获益大于风险,但在使用时需要谨慎评估患者状况。
结论
西达基奥仑赛在经过多线治疗后的复发/难治多发性骨髓瘤患者中显示出显著的疗效,包括高总体反应率和严格完全反应率,以及较长的反应持续时间,虽然西达基奥仑赛存在一定风险,但考虑到复发/难治多发性骨髓瘤患者的高疾病负担和有限的替代治疗方案,该产品的获益大于风险,FDA批准其上市。
原始出处
Kavita Natrajan, Megha Kaushal, Bindu George, Bindu Kanapuru, Marc R. Theoret; FDA Approval Summary: Ciltacabtagene Autoleucel for Relapsed or Refractory Multiple Myeloma. Clin Cancer Res 2024.
作者:daikun
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#FDA# #复发或难治性多发性骨髓瘤# #西达基奥仑赛#
83