Lancet Infect Dis:SARS-CoV-2灭活疫苗BBIBP-CorV的安全性和免疫原性
2021-06-26 MedSci原创 MedSci原创
正在进行的COVID-19大流行需要加快对候选疫苗的测试工作。近日,在中国河南进行的一项随机、双盲、安慰剂对照试验评估了一种灭活的严重急性呼吸道综合征冠状病毒2(SARS-CoV-2)候选疫苗BBIB
正在进行的COVID-19大流行需要加快对候选疫苗的测试工作。近日,在中国河南进行的一项随机、双盲、安慰剂对照试验评估了一种灭活的严重急性呼吸道综合征冠状病毒2(SARS-CoV-2)候选疫苗BBIBP-CorV在人类中的安全性和免疫原性,结果已发表于Lancet Infect Dis。

在第一阶段,研究纳入18-80岁的健康人,在筛查时血清中SARS-CoV-2的特异性IgM/IgG抗体阴性者被分成两个年龄组(18-59岁和≥60岁),随机分配接受疫苗或安慰剂,在第0天和第28天分别注射2μg、4μg或8μg的两剂。在第二阶段,健康成人(18-59岁)被随机分配(1:1:1:1)在第0天接受8微克的单剂量疫苗或安慰剂,或在第0和14、0和21或0和28天接受4微克的双剂量疫苗。每个队列中的参与者通过分层区块随机分配(区块大小为8),并分配(3:1)接受疫苗或安慰剂。次要结果是免疫原性。
结果显示,在第一阶段,192名参与者(平均年龄53-7岁[SD 15-6])被随机分配接受疫苗(2μg[n=24],4μg[n=24],或8μg[n=24],两个年龄组[18-59岁和≥60岁])或安慰剂(n=24)。在144名疫苗接种者中,有42人(29%)在接种后的头7天内报告了至少一种不良反应。最常见的系统性不良反应是发热(18-59岁,2μg组1例[4%],4μg组1例[4%],8μg组2例[8%];≥60岁,8μg组1例[4%])。所有的不良反应都是轻度或中度的。疫苗接种后28天内没有严重不良事件的报告。在第42天,与安慰剂组相比(2.0 [2.0-2.0]),18-59岁组的中和抗体几何平均滴度较高(87.7 [95% CI 64.9-118.6],2μg组;211.2 [158.9-280.6],4μg组;和228.7[186.1-281.1],8μg组)和≥60岁组(80.7[65-4-99-6],2μg组;131.5[108.2-159.7],4μg组;和170.87[133-0-219-5],8μg组)。
在第2阶段,招募了448名参与者(平均年龄41.7岁[SD 9.9]),随机分配到接受疫苗(第0天8微克[n=84]或第0和14天4微克[n=84],第0和21天[n=84],或第0和28天[n=84])或安慰剂的相同时间表(n=112)。336名疫苗接种者中,有76人(23%)在头7天内报告了至少一种不良反应(33人[39%],8μg第0天;18人[21%],4μg第0和14天;15人[18%],4μg第0和21天;以及10人[12%],4μg第0和28天)。4μg第0天和21天组的一名安慰剂接受者报告了3级发烧,但已康复。所有其他不良反应都是轻度或中度的。最常见的系统性不良反应是发热(1例[1%],8μg第0天;1例[1%],4μg第0和14天;3例[4%],4μg第0和21天;2例[2%],4μg第0和28天)。在第28天,4μg第0和14天(169.5,95% CI 132-217.1)、第0和21天(282.7,221.2-361.4)以及第0和28天(218.0,181.8-261.3)的疫苗激发的中和抗体滴度明显高于8μg第0天的方案(14.7,11.6-18.8;所有P<0-001)。
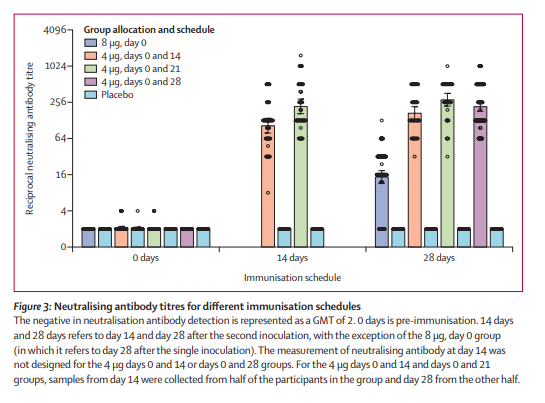
综上,SARS-CoV-2灭活疫苗BBIBP-CorV在两个年龄组的所有测试剂量中都是安全的,且耐受性良好。所有疫苗接受者在第42天都能诱发针对SARS-CoV-2的体液反应。在第0天和21天或第0天和28天用4μg疫苗进行两剂免疫,比在第0天和14天用单剂8μg或4μg疫苗的中和抗体滴度更高。
原始出处:
Shengli Xia, Yuntao Zhang, et al., Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infect Dis. 2021 Jan;21(1):39-51. doi: 10.1016/S1473-3099(20)30831-8.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#活疫苗#
56
#Lancet#
50
#SARS-CoV#
44
#Dis#
55
加油
65