Nature:基于空间分辨转录组学分析良、恶性组织拷贝数状态,揭示全基因组CNV的独特克隆模式
2022-08-28 测序中国 测序中国
研究团队对前列腺器官进行了深入的空间分析,生成了一个前所未有的图谱,包含单个患者多达50000个组织结构域以及10个患者约120000个组织结构域。
突变可以是遗传的,也可以是后天形成的(体细胞突变)。遗传基因组多态性存在于所有细胞中,很容易被识别,但发育过程中的体细胞突变通常只存在于小部分的细胞中。为了获得这些罕见的非遗传基因事件的空间信息,研究人员常用激光捕获显微解剖来探索组织学定义(或生物标志物定义)的组织区域甚至单个细胞。但这些研究的组织切片只能收集和检测有限数量的空间区域或单个细胞。
目前,空间分辨转录组学已经成为全基因组基因表达分析的有利工具,可以无偏倚地探索组织的基因组信息。在不受组织学边界限制的情况下进行空间基因组分析,将为描绘肿瘤和共存的良性组织中的克隆结构提供重要见解。此外,明确良性组织向恶性组织的转变是提高癌症早期诊断的基础。
近日,来自英国牛津大学、谢菲尔德大学,瑞典皇家理工学院、卡罗琳学院等机构的科研团队在国际顶级期刊Nature合作发表了题为“Spatially resolved clonal copy number alterations in benign and malignant tissue”的文章。研究团队利用空间组学技术系统地研究了原位基因组的完整性,并描述了先前未被确定的克隆关系,同时推测了良性和恶性组织中多个器官约12万个区域的空间拷贝数变化,揭示了全基因组拷贝数变异(CNV)在肿瘤和附近的良性组织中独特的克隆模式。

文章发表在Nature
主要研究内容
该研究涉及的标本均通过前列腺癌患者开放性根治性前列腺切除术获得,轴向切片取自中腺体。轴向切片并被细分为立方体(组织切片),使用Gleason分级系统对相应的组织切片进行组织学分级,进而发现了周围良性组织存在广泛的瘤内异质性(ITH)。研究团队从21个组织切片约21000个区域获得了器官范围的转录信息,平均每个条形码斑点检测到3500个表达基因。
接下来,研究团队从原位空间分辨的mRNA图谱中推断出全基因组CNV,并设计了一个计算机系统来整合含有多个克隆的组织,使用空间推断的CNV(siCNV)检测表达数据,成功再现了拷贝数状态和克隆分组。结果显示,除某些区域的CNV活性增加外,大部分组织区域的拷贝数较正常。这些初步结果表明,siCNV可以在器官尺度上识别组织区域,能够推断出与形态学或表达分析不同的基因组可变性和被研究组织的克隆进化模式。

图1. 全器官转录本和CNV状态的空间检测。来源:Nature
跨越组织边界的体细胞克隆
研究团队分析了每个斑点的拷贝数状态,并根据定义的聚类分离级别,通过分层聚类将这些点排序为“克隆”A到G。研究团队发现这些数据驱动的克隆集群与组织学亚型广泛相关,但仍有一些重要的区别。例如,许多CNVs已经发生在良性组织中(克隆C),其中最显著的是8号和10号染色体。
在空间上,具有癌症的克隆E、F是混合的,有多达25%的良性细胞。克隆G完全由Gleason 2级癌细胞组成。因此,在组织学上良性的细胞中存在体细胞突变事件,表明克隆群能够跨越组织学边界。
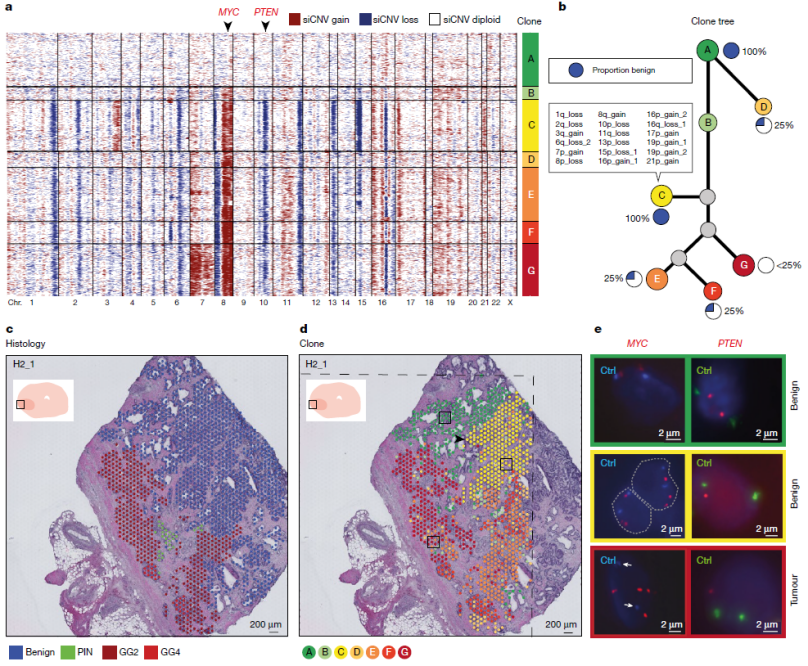
图2. 癌症和良性前列腺上皮的体细胞突变事件,来源:Nature
多组织克隆异质性
为证实上述发现,研究团队对前列腺切除术横截面上额外的37000个斑点进行了验证,发现靠近癌症的良性克隆具有空间连续性,有共同的Truncal events,也证实了前列腺肿瘤位点内siCNV克隆的高度ITH以及良性前列腺中存在的关键体细胞突变事件。研究团队将这一结果推广到多个器官中,进一步验证了siCNV克隆与基因表达的区别。
最后,研究团队分析了包含良性鳞状上皮和鳞状细胞癌(SCC)的皮肤组织,获得了一组与患者匹配的良性对照皮肤单细胞转录组测序数据,并在相邻的良性组织切片中进行了确认。值得注意的是,有两个关键事件(部分1号染色体和12号染色体增益)与附近的另一个完全由组织学上的良性组织组成的克隆共享。上述结果显示,siCNV分析能够正确预测91%空间克隆区域的CNV状态。
研究团队认为,将siCNV信息、空间基因表达模式和细胞类型定位相结合可以实现对单个克隆、良性组织或肿瘤的靶向治疗,这是通过其他方法无法轻易实现的。
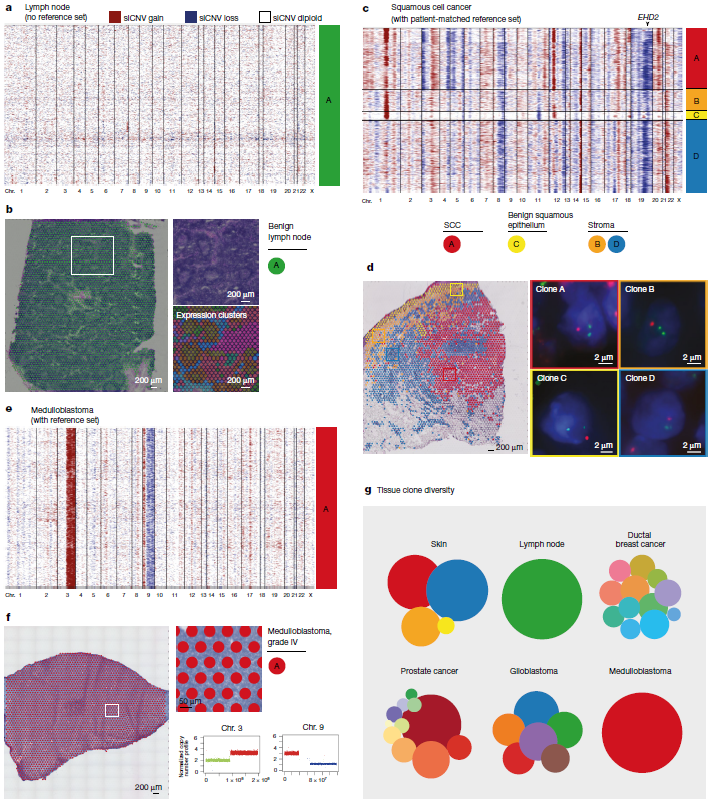
图3. 肿瘤和良性组织学中的体细胞拷贝数改变。来源:Nature
结 语
综上所述,研究团队对前列腺器官进行了深入的空间分析,生成了一个前所未有的图谱,包含单个患者多达50000个组织结构域以及10个患者约120000个组织结构域。该研究提供了一个无偏倚途径来探索基因组完整性,为癌症分子病理学的研究提供了思路,同时,也为改善临床重要癌症的早期检测、靶向和全身治疗以及改善恶性肿瘤患者预后提供了基础。
文章通讯作者之一,瑞典皇家理工学院的研究员Joakim Lundeberg表示:“确定从良性组织到恶性组织的转变是改善癌症早期诊断的基础,目前的研究结果为良性组织中如何产生基因组不稳定性提供了一个模型,这可能代表了癌症进化的早期事件。”
参考文献:
1. Erickson, A., He, M., Berglund, E. et al. Spatially resolved clonal copy number alterations in benign and malignant tissue. Nature 608, 360–367 (2022).
2. Grossmann, S. et al. Development, maturation, and maintenance of human prostate inferred from somatic mutations. Cell Stem Cell 28, 1262–1274 (2021).
3. Ji, A. L. et al. Multimodal analysis of composition and spatial architecture in human squamous cell carcinoma. Cell 182, 497–514 (2020).
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#转录#
145
#拷贝数#
96
#克隆#
133
#Nat#
86
#转录组#
112