NEJM:完胜Humira!武田Entyvio治疗UC的III期临床进一步结果出炉
2019-09-29 佚名 新浪医药
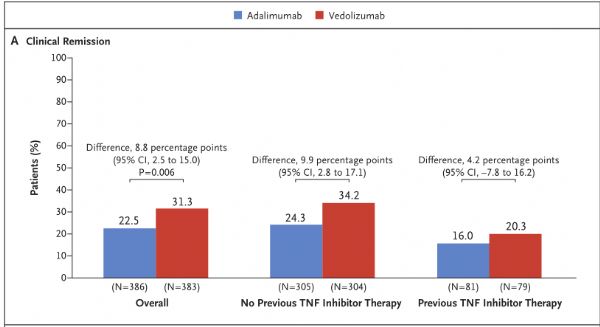
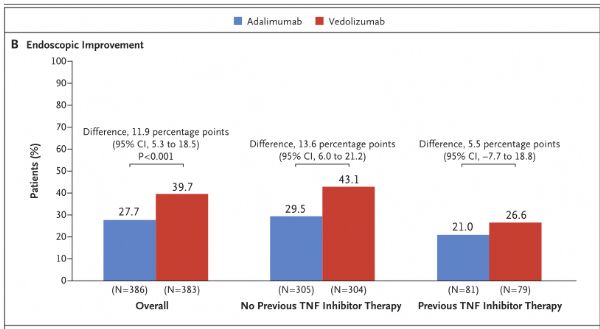
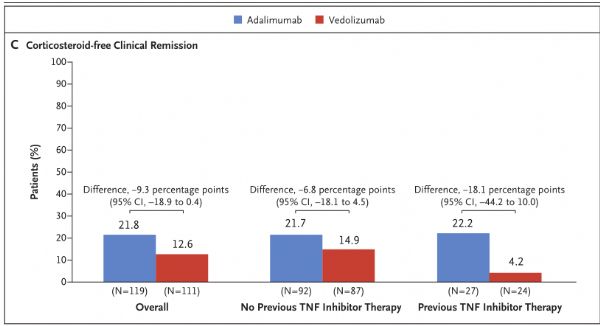
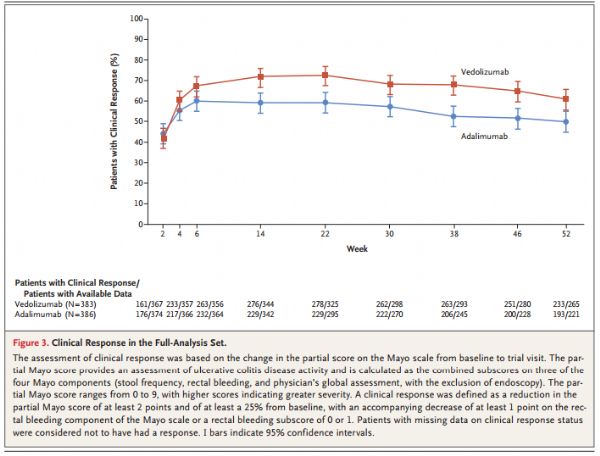
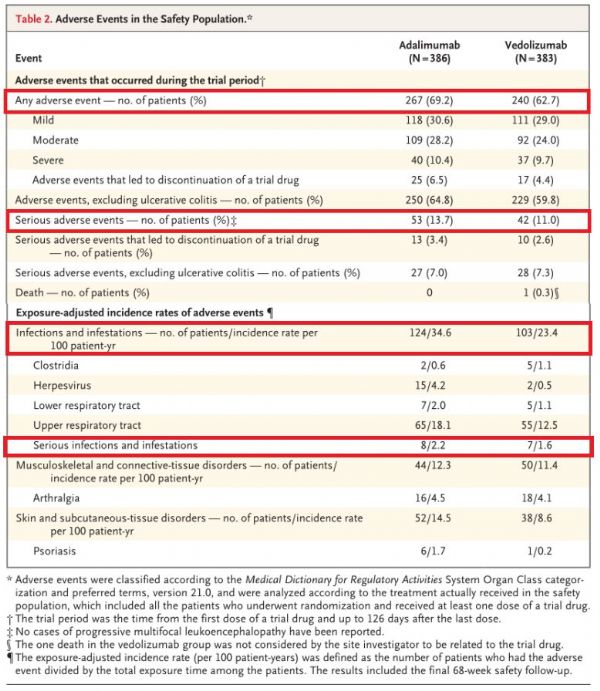
9月26日,武田制药宣布评估肠道选择性新型抗炎药Entyvio(vedolizumab)治疗溃疡性结肠炎(UC)的III期临床VARSITY(NCT02497469)的进一步结果已发表于《新英格兰医学杂志》。

作者:佚名
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









good
53
#I期临床#
39
#III#
60
#Entyvio#
66
#miR#
45