NAT COMMUN: 武大团队发文,乙肝病毒操纵细胞代谢来逃避宿主免疫
2021-01-05 haibei MedSci原创
HBV通过乳酸脱氢酶-A依赖性乳酸的产生抑制RLR信号传导。乳酸直接结合MAVS并防止其在HBV感染期间的聚集和线粒体定位。
先天免疫系统通过模式识别受体,如Toll样受体(TLR)和视黄酸诱导基因I(RIG-I)样受体(RLRs)来识别病原体。RLRs,包括RIG-I和MDA5,是细胞核RNA传感器,通过招募线粒体抗病毒信号(MAVS)的信号适配器(也称为Cardif,VISA和IPS-1)触发先天性免疫反应。一旦激活,MAVS分子在线粒体形成朊病毒样的超分子聚集,从而招募和激活TBK1和IKKε。激活的TBK1和IKKε诱导转录因子的激活,包括IRF3和NFκB,导致I型干扰素(IFN)和促炎细胞因子的生产。
此外,分泌的I型IFNs(IFN-I)结合到同源的IFNα/β受体(IFNAR)存在于大多数有核细胞的表面。IFNAR受体启动Jak/STAT信号,导致IFN刺激基因(ISGs)的转录。ISGs履行各种生物功能,执行抗病毒活性。

已有的研究显示,葡萄糖代谢和先天免疫是并存进化的。目前尚不清楚在乙型肝炎病毒(HBV)感染期间,这两个系统是否以及如何相互作用,以及背后涉及哪些机制。
最近,武汉大学的研究人员在Nature Communications杂志发文,报告了HBV激活糖酵解,以阻碍视黄酸诱导基因I(RIG-I)诱导的干扰素产生。研究人员证明,HBV通过形成包括己激酶(HK)在内的三元复合物,从RIG-I中捕获MAVS。
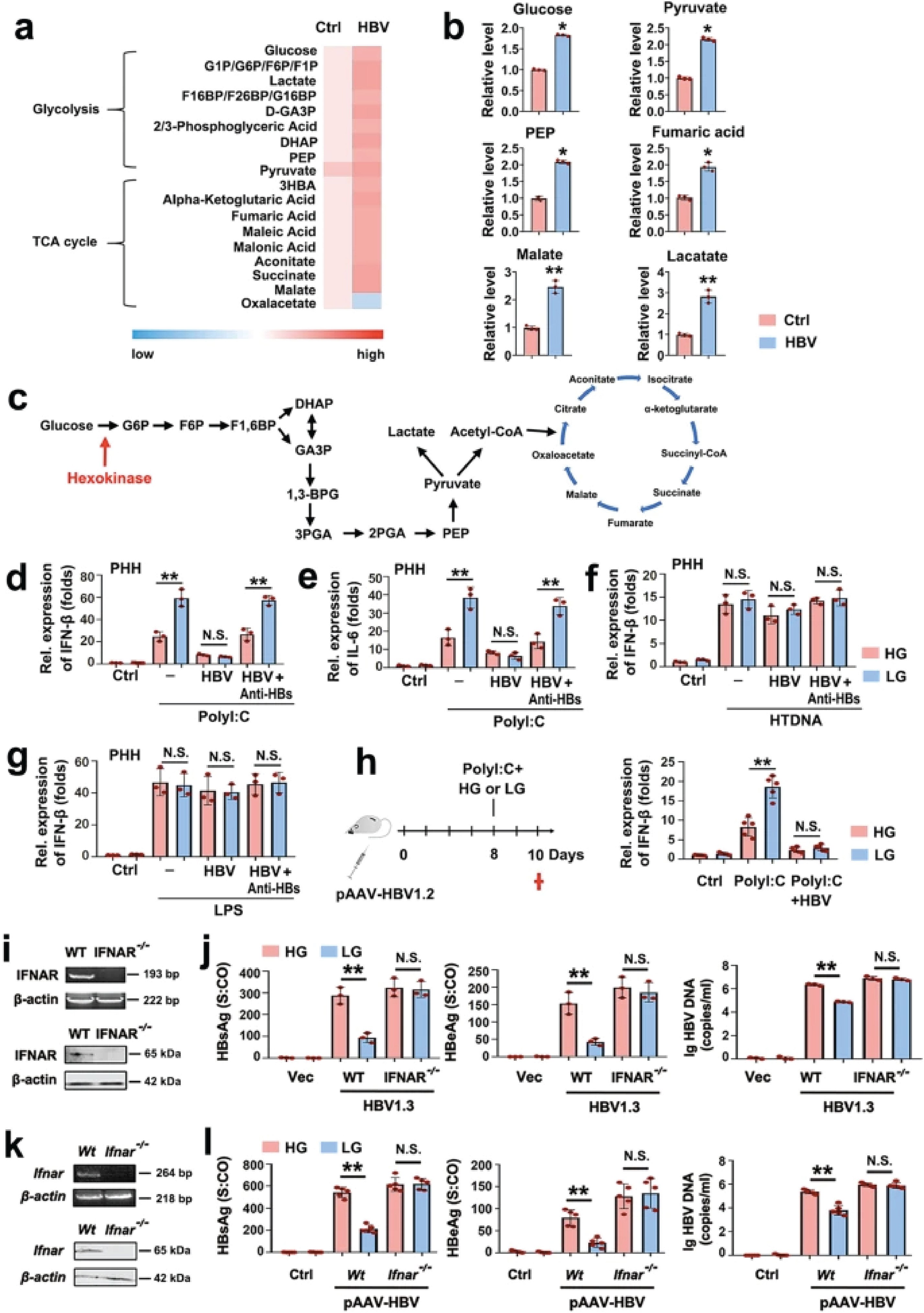
利用一系列药理学和遗传学方法,研究人员提供了体外和体内证据,表明HBV通过乳酸脱氢酶-A依赖性乳酸的产生抑制RLR信号传导。乳酸直接结合MAVS并防止其在HBV感染期间的聚集和线粒体定位。
因此,该研究表明,HK2和糖酵解产生的乳酸在HBV的免疫逃逸中具有重要的功能,能量代谢在HBV感染过程中调节先天性免疫。
原始出处:
Li Zhou et al. Hepatitis B virus rigs the cellular metabolome to avoid innate immune recognition. Nature Communications (2021).
作者:haibei
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#COMMUN#
35
#Nat#
32
#宿主免疫#
49
#宿主#
45
#细胞代谢#
36