好文推荐 | 系统性红斑狼疮相关急性缺血性脑卒中的临床及影像学特点分析
2023-10-31 中风与神经疾病杂志 中风与神经疾病杂志
本研究比较SLE-AIS患者与AIS患者之间的临床及影像学差异,探索SLE对AIS患者短期预后的影响,旨在推动预防和治疗策略的制定。
摘要:
目的 比较分析系统性红斑狼疮相关急性缺血性脑卒中(SLE-AIS)患者的临床及影像学特点,探索系统性红斑狼疮(systemic lupus erythematosus,SLE)对急性缺血性脑卒中(acute ischemic stroke,AIS)患者短期预后的影响。方法 采用巢式病例对照研究的方法,收集2019年10月-2021年5月期间于郑州大学第一附属医院住院且第一诊断为缺血性脑卒中的患者,将伴发SLE的患者作为SLE-AIS组,每一确定的病例按年龄、性别、发病时间选择4例患者作为对照。比较两组间基线指标及影像特征差异。按mRS评分将患者分为预后良好组和预后不良组,探索SLE对AIS患者短期预后的影响。
结果 140例患者被纳入本次研究,平均年龄(48.4±15.6)岁,其中女性占92.9%。低密度脂蛋白(low-density lipoprotein cholesterol,LDL-C)(P=0.049),D-二聚体(D-Dimer,DDi)(P=0.02),和C反应蛋白(C-reactive protein,CRP)(P=0.002)浓度在SLE-AIS组中显著升高;影像学分析发现,同时累及前后循环(P=0.004),多发梗死(P=0.008)及不明原因型卒中(P=0.002)在SLE-AIS组中更常见;多因素Logistic回归分析显示SLE(P=0.045)是AIS患者短期预后不良的独立危险因素。
结论 SLE-AIS患者基线LDL-C,DDi,CRP浓度较高,更严格的降脂、抗炎、抗凝治疗可能是必要的。累及前后循环,多发梗死及不明原因型卒中是SLE-AIS患者主要的影像学特点。SLE是AIS患者短期预后不良的危险因素,因此应在SLE诊断初期对AIS的相关危险因素进行筛查并及时启动预防治疗。
急性缺血性脑卒中(acute ischemic stroke,AIS)是世界范围内致残和死亡的主要原因,在过去的30年,AIS在诊断和治疗上取得了很大进步,但在低中等收入国家,其发病率、死亡率、残疾调整生命年仍居高不下。系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种在临床表现和疾病严重程度上存在很大异质性的自身免疫性疾病,其临床症状从轻度疲劳到严重的脏器损害均可见到,主要影响青春期至更年期女性。尽管SLE的5年生存率已从20世纪50年代的51%增长至90%以上,但中枢神经系统受累仍是疾病晚期阶段死亡的主要原因,3%~20%的SLE患者在其病程中会发生AIS,通常在确诊的前5年,与其相关的机制包括动脉粥样硬化的加速、高凝状态、Libman-Sacks心内膜炎和脑血管炎。最近的荟萃分析证实,SLE患者AIS发病率是普通人群的两倍,随着年龄的减小,其发病风险随之增高。相比于普通人群,AIS传统危险因素如高脂血症、糖尿病和高血压在SLE患者中明显增加。然而,与单纯AIS人群相比,这些特征是否显著是未知的。同时,我们发现SLE-AIS相关影像学研究少见。
因此,本研究比较SLE-AIS患者与AIS患者之间的临床及影像学差异,探索SLE对AIS患者短期预后的影响,旨在推动预防和治疗策略的制定。
1 资料与方法
1.1 研究对象 采用前瞻性与回顾性相结合的研究方法,收集在2019年10月-2021年5月期间于郑州大学第一附属医院诊断为缺血性脑卒中的患者。纳入标准包括:(1)脑卒中发病时间≤7 d;(2)年龄>18岁;(3)住院时间≥4 d。排除标准包括:
(1)缺少相关影像学检查,包括头部MRI和血管造影(MRA、CTA和DSA)或未在我院进行影像学检查;
(2)同时患有恶性肿瘤、妊娠或其他自身免疫性疾病,如抗磷脂抗体综合征、类风湿关节炎、风湿性心脏病等;
(3)随访时间少于3个月。郑州大学第一附属医院伦理审查委员会批准了该项研究方案(NO. 2021-KY-1091-002)。
SLE-AIS组定义为患有SLE的AIS患者,对于以往未曾因SLE于我院就诊的患者,将由我院风湿免疫科根据美国风湿病学会1997年建议的修订标准进行核实。对于每个确定纳入的病例按年龄(±2岁)、性别和发病时间,采用发病率密度抽样法,从危险集中随机选择4例患者作为对照。
1.2 资料收集
1.2.1 通过审查患者的电子病历资料,收集入选患者的一般人口统计学资料,共病(高血压、糖尿病、冠心病)、吸烟史、饮酒史、卒中史、血同型半胱氨酸(homocysteine,HCY)、血脂(总胆固醇total cholesterol,TC;甘油三酯triglycerides,TG;低密度脂蛋白low-density lipoprotein cholesterol,LDL-C;高密度脂蛋白high-density lipoprotein cholesterol,HDL-C)、空腹血糖(fasting lood glucose,FBG)、D-二聚体(D-Dimer,DDi)、C反应蛋白(C-reactive protein,CRP)、NIHSS评分、住院时长、是否入住ICU。对于SLE-AIS组,还收集了SLE病程。血清学指标均是于入院后次日清晨通过空腹抽血获得的。
1.2.2 所有疑似诊断为AIS的患者在门诊或入院后完成头部3TMRI平扫,包括DWI成像。同时建议患者完成MRA或CTA检查。从以下几个方面对患者的影像学进行评估。(1)根据DWI上梗死灶相应的脑血管供血区域,AIS被分为前循环梗死或后循环梗死,或者同时累及前后循环的梗死;(2)根据Tsoi 等对脑卒中伴SLE的研究,将AIS影像学分为以下几类:①直径在2~15 mm的单发皮质或皮质下梗死;②分水岭梗死(主要血管交界区的梗死);③多发(≥2)梗死(多条主要脑血管或次级血管的梗死);④大面积梗死(主要脑血管>2/3的供血区域梗死)。(3)根据Pullicino公式(梗死体积=π/6×长×宽×层数×层厚)确定梗死体积(层厚为5 mm)。小梗死组包括梗死体积≤3 cm3的患者;中梗死组包括梗死体积为>3 cm3、<6 cm3的患者;大梗死组包括梗死体积≥6 cm3的患者;(4)TOAST分型是根据患者的临床症状和实验室检查进行分类的。包括大动脉粥样硬化型、心源型、小动脉闭塞型、其他原因型和不明原因型。影像学分类是由两位神经科医生根据影像学检查结果和神经放射科医生出具的报告进行评估的。梗死体积取两位神经科医生评估结果的平均值。
1.2.3 使用改良Rankin量表(mRS)评估AIS患者短期预后,随访结果通过门诊复诊或电话评估获得的。为了分析SLE对AIS患者的影响,我们根据mRS评分将所有患者分为预后良好(mRS评分0~2)组和预后不良(mRS评分3~6)组。
1.3 统计分析 定量资料以x±s表示,SLE-AIS组与AIS组之间的比较采用独立样本t检验或Wilcoxon-Mann-Whitney U秩和检验。定性资料以频率和百分比表示,使用χ2检验或Fisher精确检验比较两组间的差异。对于多组间的成对比较,使用Bonferroni法调整α检验水准,以减少犯Ⅰ型错误的概率。将单变量分析中P<0.1的因素纳入多因素logistic回归模型,探索与AIS短期预后不良的危险因素。使用SPSS 26.0软件进行统计学分析,使用GraphPad Prism 8.0软件创建多因素Logistic回归分析的森林图。双侧P<0.05认为差异具有统计学意义。
2 结果
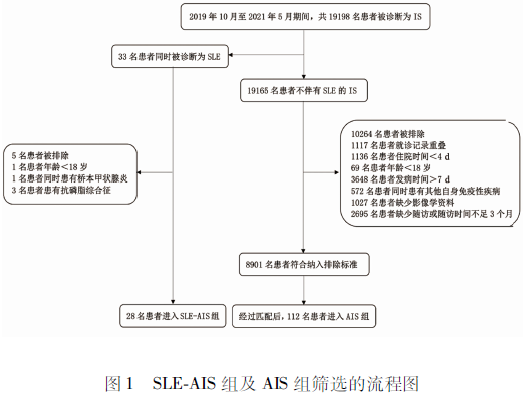
2.1 研究对象的人口学资料 2019年10月-2021年5月期间,共有19 198例患者被诊断为AIS,33名患者同时患有SLE。根据上述纳入和排除标准,我们重新构建了一个包含8 901例患者的AIS队列(见图1),队列中患者的平均年龄是(61.0±12.5)岁,女性占31.3%。最终,28例伴发SLE患者被纳入SLE-AIS组,平均年龄为(48.3±15.9)岁,92.9%为女性,平均发病时间是(2.6±1.9) d,3例SLE患者以AIS为首发症状,SLE的平均病程是(6.2±5.1) 年。经过匹配后共有112例AIS患者被纳入AIS组,平均年龄为(48.4±15.6)岁,平均发病时间是(2.3±1.6) d。
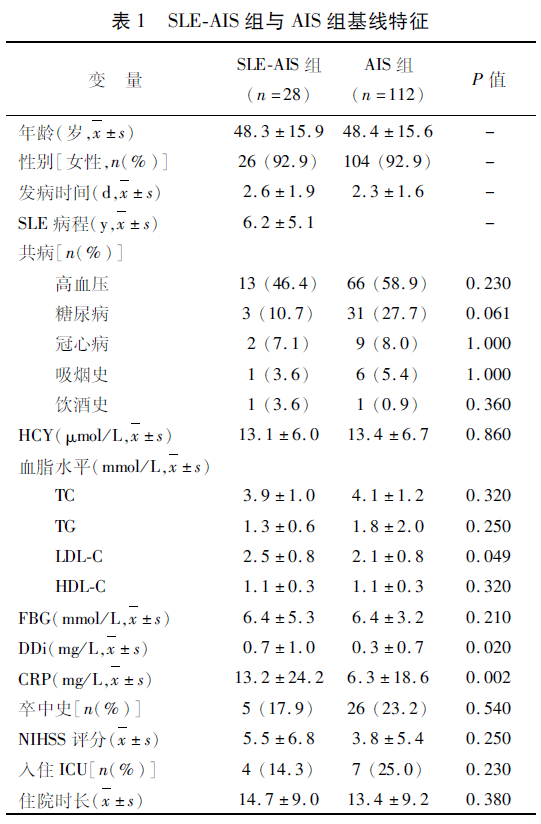
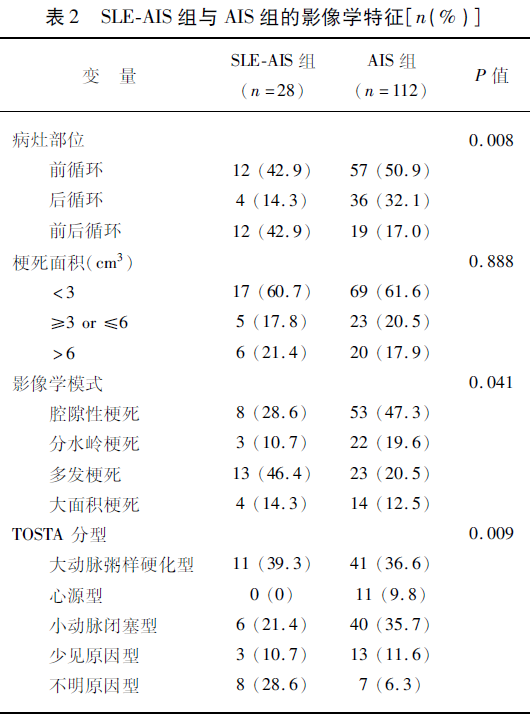
2.2 临床及影像学特征分析 LDL-C平均浓度在SLE-AIS组和AIS组分别为(2.5±0.8)mmol/L、(2.1±0.8)mmol/L,差异有统计学意义(P=0.049);DDi平均浓度在SLE-AIS组和AIS组分别为(0.7±1.0)mg/L、(0.3±0.7)mg/L,差异有统计学意义(P=0.02)。CRP平均浓度在SLE-AIS组和AIS组分别为(13.2±24.2)mg/L、(6.3±18.6)mg/L,差异有统计学意义(P=0.002)。SLE-AIS组与AIS组在高血压、糖尿病、冠心病、吸烟、饮酒、HCY、TC、TG、HDL、FBG、卒中史、入院时NIHSS评分、入住ICU及住院时间差异无统计学意义(P>0.05)(见表1)。与AIS组相比,SLE-AIS组更易出现同时累及前后循环的梗死(42.9% vs 17.0%;P=0.004)。SLE-AIS组中多发梗死的比例明显高于AIS组(46.4% vs 20.5%;P=0.008)。在TOAST分型中,SLE-AIS组不明原因型卒中比AIS组更常见(28.6% vs 6.3%;P=0.002)。在梗死体积方面,两组间差异无统计学意义(P>0.05)(见表2)。
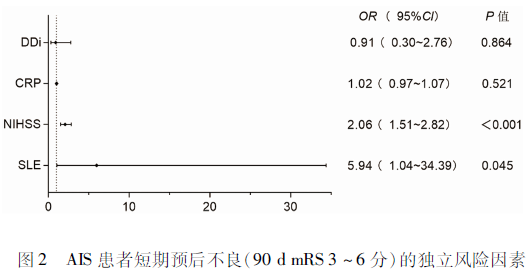
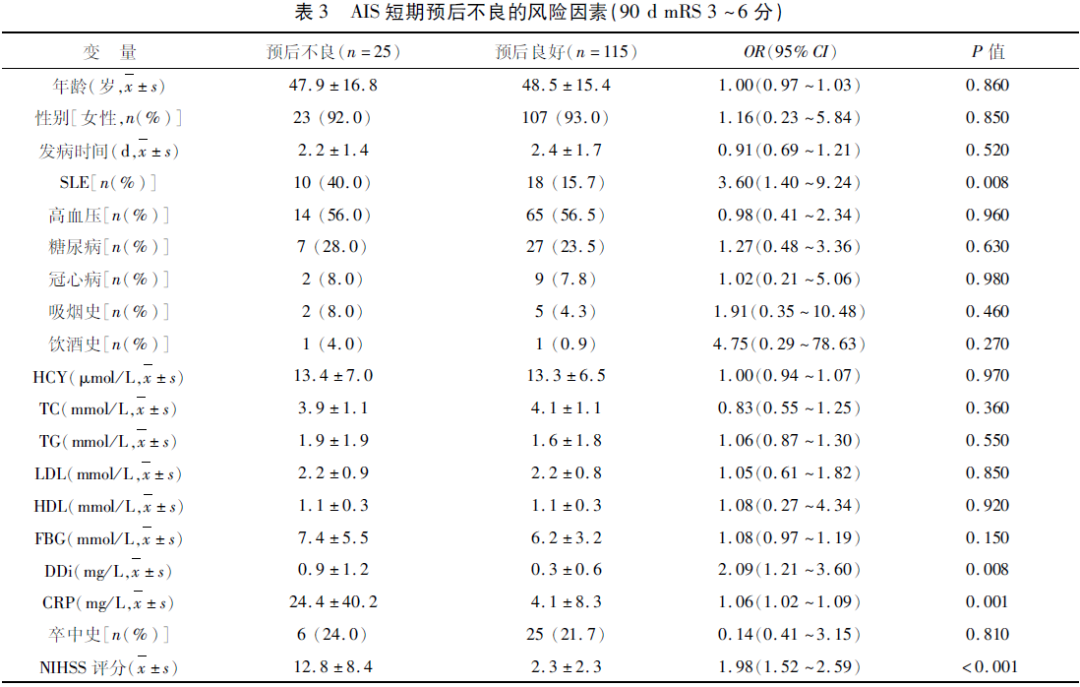
2.3 短期不良预后的危险因素分析 单因素Logistic回归分析显示,SLE(OR=3.60,95%CI 1.40~9.24;P=0.008)、DDi(OR=2.09,95%CI 1.21~3.60;P=0.008)、CRP(OR=1.06,95%CI 1.02~1.09;P=0.001),和NIHSS评分(OR=1.98,95%CI 1.52~2.59;P<0.001)是AIS患者预后不良的危险因素(见表3)。将上述危险因素纳入多变量Logistic回归模型,结果显示,SLE(OR=5.94,95%CI 1.04~34.39;P=0.045)和NIHSS评分(OR=2.06,95%CI 1.51~2.82;P<0.001)是AIS患者短期预后不良的独立危险因素(见图2)。
3 讨论
AIS在我国的发病率逐年上升,且呈年轻化趋势,目前已成为我国居民主要的死亡原因。SLE导致AIS的机制包括动脉粥样硬化的加速、高凝状态、Libman-Sacks心内膜炎和脑血管炎。本研究证实,与AIS患者相比,SLE-AIS患者中LDL-C浓度显著升高,与以往结果一致。SLE中LDL-C改变的确切病理机制尚不清楚,持续存在的炎症反应可能发挥着重要作用。通过炎症介质诸如IL-6和TNF-α影响LDL-C水平,同时炎症反应产生过量的活性氧加速了LDL-C的氧化。其次,用于治疗SLE的常用药物,如糖皮质激素、羟氯喹、环磷酰胺,也会影响患者的脂质代谢。
因此,SLE患者体内LDL-C水平的升高及更容易被氧化的特性是动脉粥样硬化加速的原因之一。CRP是一种急性期时相蛋白,其浓度的升高预示着更严重的神经功能缺损。虽然SLE活动期存在明显的组织炎症,但CRP浓度增高并不明显。本研究发现,SLE-AIS患者体内CRP浓度高于AIS患者,这可能是由于易发生AIS的SLE患者存在CRP等位基因的突变,携带这种突变基因的患者体内CRP水平往往较高。DDi是交联纤维蛋白降解产物,是体内高凝状态的标志物。SLE患者的血浆DDi水平升高是血管事件的独立危险因素。在我们的研究中,排除了抗磷脂综合征对血凝状态的影响,结果显示SLE-AIS患者DDi水平仍远远高于AIS患者,表明高凝状态继发血栓形成是SLE患者发生AIS的原因之一。
前后循环同时受累和多发梗死是本研究中SLE-AIS患者主要影像学特征,表明SLE-AIS患者存在广泛的脑小血管受累。其发生的机制可能是SLE引发全身炎症并累及多个血管区域,同时,免疫复合物沉积在内皮,造成内皮损伤,导致中枢神经系统原位血栓形成或微栓子迁移至中枢神经系统。尸检研究也发现微血管损伤导致微梗死及微血栓形成在SLE患者中十分常见。与Kown和Tsoi等的研究结果相同,我们的研究结果同样证实了SLE是AIS患者短期预后不良的独立风险因素。我们推测,SLE患者神经功能恢复不良的与以下因素有关:首先,SLE相关并发症影响了AIS后神经功能的恢复,如关节痛和呼吸障碍;其次,SLE患者发生AIS后存在较大的心理负担,因此他们更容易出现AIS后抑郁和焦虑;此外,SLE的类固醇治疗也会存在潜在的不良影响。
与以往的研究相比,本研究纳入的脑卒中亚型均为急性缺血性,增强了组间的可比性。此外,纳入患者的影像学检查均十分完整,我们从多个角度分析了SLE-AIS患者和AIS患者的影像学特征,这是以往研究所缺乏的。本研究也存在一些局限性,首先,由于SLE-AIS患病率低,我们的样本量较小,造成了标准差和置信区间范围较宽;其次,我们没有评估SLE患者药物使用情况,长期服用羟氯喹对心血管系统产生有益影响,而长期服用糖皮质激素则会产生不利影响。综上所述,SLE-AIS患者LDL、CRP、DDi浓度显著升高,因此,更严格的降脂、抗炎、抗凝治疗可能是必要的。同时累及前后循环和多发性梗死是SLE-AIS患者主要的影像学特征。由于SLE是AIS患者短期内预后不良的独立危险因素,因此应在SLE诊断初期对AIS的相关危险因素进行筛查并及时启动预防治疗。
参考文献
[1]Campbell BCV,De Silva DA,Macleod MR,et al. Ischaemic stroke[J]. Nat Rev Dis Primers,2019,5(1):70.
[2]Kaul A,Gordon C,Crow MK,et al. Systemic lupus erythematosus[J]. Nat Rev Dis Primers,2016,2:16039.
[3]Brey RL,Holliday SL,Saklad AR,et al. Neuropsychiatric syndromes in lupus:prevalence using standardized definitions[J]. Neurol,2002,58(8):1214-1220.
[4]Schwartz N,Stock AD,Putterman C. Neuropsychiatric lupus:new mechanistic insights and future treatment directions[J]. Nat Rev Rheumatol,2019,15(3):137-152.
[5]Yazdany J,Pooley N,Langham J,et al. Systemic lupus erythematosus;stroke and myocardial infarction risk:a systematic review and meta-analysis[J]. RMD Open,2020,6(2):e111247.
[6]Guraieb-Chahín P,Cantú-Brito C,Soto-Mota A,et al. Stroke in systemic lupus erythematosus:epidemiology,mechanism,and long-term outcome[J]. Lupus,2020,29(5):437-445.
[7]Hochberg MC. Updating the American college of rheumatology revised criteria for the classification of systemic lupus erythematosus[J]. Arthritis Rheum,1997,40(9):1725.
[8]Tsoi LK,Mok CC,Man BL,et al. Imaging pattern and outcome of stroke in patients with systemic lupus erythematosus:a case-control study[J]. J Rheumatol,2021,48(4):533-540.
[9]Park JK,Kim JY,Moon JY,et al. Altered lipoproteins in patients with systemic lupus erythematosus are associated with augmented oxidative stress:a potential role in atherosclerosis[J]. Arthritis Res Ther,2016,18(1):306.
[10]Svenungsson E,Gunnarsson I,Fei GZ,et al. Elevated triglycerides and low levels of high-density lipoprotein as markers of disease activity in association with up-regulation of the tumor necrosis factor alpha/tumor necrosis factor receptor system in systemic lupus erythematosus[J]. Arthritis Rheum,2003,48(9):2533-2540.
[11]Chung CP,Avalos I,Oeser A,et al. High prevalence of the metabolic syndrome in patients with systemic lupus erythematosus:association with disease characteristics and cardiovascular risk factors[J]. Ann Rheum Dis,2007,66(2):208-214.
[12]Kerr G,Aujero M,Richards J,et al. Associations of hydroxychloroquine use with lipid profiles in rheumatoid arthritis:pharmacologic implications[J]. Arthritis Care Res(Hoboken),2014,66(11):1619-1626.
[13][JP3]Luo Y,Wang Z,Li J,et al. Serum CRP concentrations and severity of ischemic stroke subtypes[J]. Can J Neurol Sci,2012,39(1):69-73.[JP]
[14]Linares LF,Gomez-Reino JJ,Carreira PE,et al. C-reactive protein(CRP)levels in systemic lupus erythematosus(SLE)[J]. Clin Rheumatol,1986,5(1):66-69.
[15]Szalai AJ,Alarcón GS,Alén JC,et al. Systemic lupus erythematosus in a multiethnic US cohort(LUMINA). XXX:association between C-reactive protein(CRP)gene polymorphisms and vascular events[J]. Rheumatology(Oxford),2005,44(7):864-868.
[16]Wu H,Birmingham DJ,Rovin B,et al. D-dimer level and the risk for thrombosis in systemic lupus erythematosus[J]. Clin J Am Soc Nephrol,2008,3(6):1628-1636.
[17]Thirunavukkarasu B,Gupta K,Nada R,et al. Neuropathological spectrum in systemic lupus erythematosus:A single institute autopsy experience[J]. J Neuroimmunol,2021,353(4):577518.
[18]Baizabal-Carvallo JF,Samson Y. Microembolic signals in systemic lupus erythematosus and other cerebral small vessel diseases[J]. J Neurol,2010,257(4):503-508.
[19]Kwon HS,Kim YS,Lee JM,et al. Causes,risk factors,and clinical outcomes of stroke in korean young adults:systemic lupus erythematosus is associated with unfavorable outcomes[J]. J Clin Neurol,2020,16(4):605-611.
[20]Haugaard JH,Dreyer L,Ottosen MB,et al. Use of hydroxychloroquine and risk of major adverse cardiovascular events in patients with lupus erythematosus:a danish nationwide cohort study[J]. J Am Acad Dermatol,2021,84(4):930-937.
作者:中风与神经疾病杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言