Nature子刊重磅综述:多发性骨髓瘤
2024-07-02 聊聊血液 聊聊血液
《Nature》子刊《Nature Reviews Disease Primers》近日发表综述,阐述了多发性骨髓瘤的流行病学、机制、诊断、治疗和生活质量等内容。
多发性骨髓瘤
多发性骨髓瘤 (MM) 是一种累及浆细胞的血液恶性肿瘤,通常表现为存在单克隆免疫球蛋白(M蛋白,是MM的标志),是第二常见的血液系统恶性肿瘤,全球发病率呈上升趋势。它仍无法治愈,因为大多数患者会复发或对治疗难治。IgG约占50%,IgA约占20%,IgD和 IgM 表型罕见(分别为2%和0.5%),而在约20%的患者中,恶性浆细胞仅分泌单克隆κ或λ游离轻链 (FLC)(轻链型骨髓瘤,有时称Bence Jones骨髓瘤,预后较差),少数患者为不分泌型或寡分泌型MM。由此可见,MM是一种淋巴组织肿瘤,根据世卫组织造血系统淋巴组织肿瘤分类第五版,属于细胞肿瘤及其他单克隆蛋白疾病。该组中最常见的疾病是意义未明的单克隆丙种球蛋白病 (MGUS),它是一种癌前病变,先于冒烟型 MM(SMM) 或活动性MM而发生。
MM 是一种具有高度异质性的遗传复杂疾病,其发展包括多步骤过程,包括肿瘤细胞获得基因改变和骨髓微环境的改变。症状性 MM 的诊断依据国际骨髓瘤工作组(IMWG)标准,基于骨髓中克隆性浆细胞≥10%,并且存在至少一种骨髓瘤定义事件(myeloma-defining event),即标准 CRAB 特征(高钙血症、肾功能不全、贫血和/或溶骨性病变)或即将发生器官损伤的生物标志物。
年轻和健康患者适合接受移植,患者在诱导治疗后接受大剂量美法仑序贯自体造血细胞移植巩固治疗以及维持治疗。对于老年患者(不适合移植),达雷妥尤单抗、来那度胺和地塞米松联合治疗是首选方案。如果复发并需要进一步治疗,则治疗选择需要考虑既往的治疗和反应。关于疾病的分子机制、免疫系统的参与和肿瘤微环境已有相当多的基础研究,并带来革命性的免疫治疗,如免疫调节剂 (IMiDs)、单克隆抗体和T细胞重定向免疫治疗(双特异性抗体和CAR-T细胞治疗),推动了复发/难治患者和新诊断患者的治疗显著发展。
《Nature》子刊《Nature Reviews Disease Primers》近日发表综述,阐述了多发性骨髓瘤的流行病学、机制、诊断、治疗和生活质量等内容。

流行病学
发病率、患病率和死亡率
MM 是第二常见的血液系统恶性肿瘤(占所有病例的10-15%),且在过去三、四十年中,全球发病率呈增加趋势(不同地区和时间段存在差异),可能与人口增长、人口老龄化、诊断水平提高以及人均GDP相关。2019年全球共报告155688例新发 MM 病例,年龄标化发病率 (ASIR) 为1.92/10万人,而1990年为1.72/10万人,1990年至2019年的发病率约增加1.36倍。1990年至2016年,全球发生率约增加126%,尤其是特定年龄组和高收入国家,可能与更好的诊断水平以及对疾病的认识提高有关。发病率最高的为澳大利亚/新西兰(4.86/10万人)、北美(4.74/10万人)、北欧(3.82/10万人),而东南亚、美拉尼西亚和西非的发生率最低(0.81/10万人)。值得注意的是,在过去几十年中,中东部分低收入国家的病例数及死亡率增长最快(图1)。
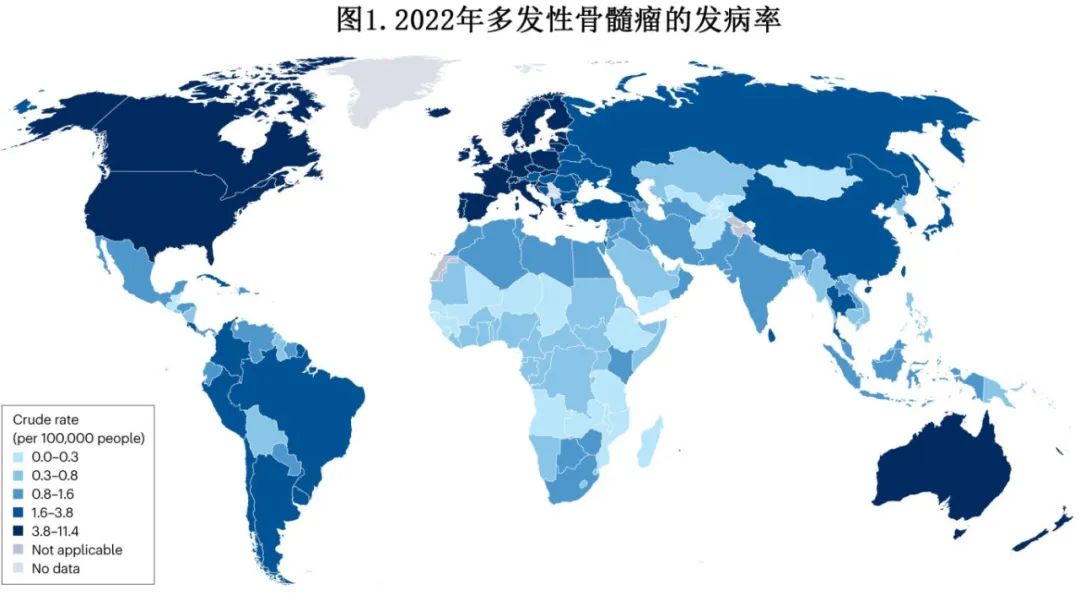
据估计,2023年美国确诊约35730例新发 MM 病例(19860例为男性),患者中位年龄为69岁,占所有新发癌症病例的1.8%,根据2024年国家癌症研究所数据,美国人发生 MM 的终生风险约为0.8%。在一项使用 SEER 数据库的研究中,1993-1997年和1998-2002年间,年龄校正的发病率从5.5/10万人/年增加至6.1/10万人/年,并在2015-2019年期间达到7.1/10万人/年,年龄特异性发病率逐渐增加,在80-84岁人群中达到峰值49.2/10万人/年。MM的发生率随年龄增长而增加,男性(8.8/10万男性vs 5.9/10万人)和非西班牙裔黑人患者(ASIR 14.5/10万人vs 非西班牙裔白人6.4/10万人)中发生率更高,非西班牙裔黑人患者约占每年新发病例的20%,诊断时中位年龄也更低。
2020年全球 MM 死亡人数估计为117077例(死亡率1.14/10万人)。报告的年龄别死亡率 (ASDR) 最高的是波利尼西亚(2.69/10万人)、澳大利亚/新西兰(1.84/10万人)和北欧(1.8/10万人),最低的是西非和密克罗尼西亚(0.37/10万人)。从1950年到1975年,美国人口的死亡率增加了2-3倍,随后下降,估计2023年有12590例死亡(占癌症相关死亡总数的2.1%)。不同研究中黑人 MM 患者的结局有所不同,部分研究显示结局更好,其他研究则显示 ASDR 更高和死亡年龄更小。
在美国和欧洲,由于引入了新药治疗,5年生存率从1975-1977年的25%增加至2012-2018年的约60%,导致不同地区的患病率增加。在瑞典,2014年的患病率增加至34.8/10万人,而1980年为13.1/10万人,丹麦的患病率也增加了3倍。然而,随着新药的可用性和可及性以及治疗方法(包括双特异性抗体和细胞治疗)的变化,不同地区之间仍然存在差异。2022年,国际癌症研究机构报告的5年患病率介于1.5/10万人(非洲)和4.3/10万人(亚洲)至20/10万人(欧洲)和31.3/10万人(北美洲)。
需要强调的是,MM 患者中发病率和结局的概念存在差异,导致记录的变异性,从而确定了与年龄较大、人种和种族以及可能的社会经济地位 (SES) 相关的特定易感人群。除新疗法(包括入组试验)外,所有这些因素均会影响获得用于监测疾病的先进诊断和高灵敏度技术;因此,需要承认、更好地理解并迅速解决这种差异的原因,以确定限制其不良效应的策略。
风险因素和遗传倾向
MM 的风险因素包括年龄、性别和人种等,但尚未发现直接诱因,尽管数据表明暴露于某些化学物质(单克隆丙种球蛋白病的一级类似物)、暴露于环境因素、相关的自身免疫性疾病和炎症状况可增加风险。还报告了 HIV 患者发生 MM 的风险增加,但 MM 未视为 AIDS 定义的恶性肿瘤。未观察到与丙型肝炎病毒感染的相关性。据报告,化学品职业暴露是风险因素之一,各种病例对照研究表明苯和甲苯是潜在风险因素。包括2854例个体(病例)和10743例对照的汇总数据表明,随着苯暴露的累积强度增加,MM的风险有所增加(在最高暴露四分位数中增加高达42%;OR=1.42,P=0.01),且诊断后20年内暴露的相关性更强。多项荟萃分析表明,农民患 MM 的风险增加 (OR为1.12-1.39),但关于杀虫剂影响的结果不一致。在消防员、理发师和暴露于发动机废气的人员中也发现重大风险,但在其他化学品中结果不一致。辐射暴露的影响、暴露后时间和剂量仍存在争议,剂量超过 4Gy 可能增加风险。
SES 作为发生MM的风险因素的影响,以及作为 MM 人种差异的根本原因,目前尚有争议。在基于职业的 SES 最低类别的个体中,MM风险显著增加,且黑人个体占过量发病率的49%。此外,虽然研究表明肥胖和代谢综合征与 MM 的发生和发展相关,但其他研究拒绝了该相关性或这些因素对结局的不利影响。饮食质量似乎由 SES 驱动,因此健康食物更有可能被 SES 较高的人食用,因此需评价混杂因素的各自影响,包括SES、种族差异和肥胖对 MM 风险的影响。值得注意的是,大多数评估肥胖影响的研究存在局限性,包括选择偏倚和缺乏统一的、经验证的肥胖识别和分类评估措施。
MM 中可遗传因素的影响及其对患者结局的影响不断演变,存在家族聚集性,即在有浆细胞疾病家族史的个体中 MM 风险增加,尤其是在黑人患者中(OR为17.4-20.9,白人患者为1.5-2.04)。全基因组关联研究 (GWAS) 已确定超过20个 MM 的风险位点,数据表明自噬相关基因种系遗传变异存在影响,此外还有导致 MYC 激活的多态性。一项包括既往 GWAS 和同步系列(9974例骨髓瘤患者和247556例欧洲血统对照)的荟萃分析确定了额外的风险位点(约占单核苷酸多态性遗传度的16%),而一项包括 MM 患者的2项 GWAS 的荟萃分析在非洲血统个体中确定了2个新位点作为标记。最近,利用大规模的关联研究确定了额外位点,重点是具有预期功能影响的多态性,其更可能与疾病发展相关。重要的是,部分基因座与临床表现和毒性相关,而其他基因座与较差结局相关。需要指出的是,仅少数患者可确定家族史或特定易感基因位点通,而大多数 MM 患者无受累亲属,因此,在不合并其他因素的情况下,遗传性易感作为风险因素的重要性受到质疑。
简单地说,MM的流行病学各方面存在明显的变异性和争议,需要标准化疾病发生率和死亡率的测量,以及建立分层,以加强对这种差异化的原因的理解,同时确定哪些措施可限制其对患者结局的影响。
机制/病理生理学
MM 是一种遗传性复杂的疾病,具有高度异质性。其发展是一个多步骤的过程,包括肿瘤细胞获得基因改变和这些细胞所在的骨髓微环境的变化。抗原与淋巴结生发中心相遇后,导致幼稚 B 细胞转化在类别转换重组(class switch recombination)过程中发生错误(B细胞从产生 IgM 转换为产生IgG、IgE或 IgA 的遗传过程),以及 B 细胞受体的体细胞超突变。这些过程增加抗原亲和力和特异性,并由活化诱导的胞苷脱氨酶 (AID) 介导。AID引起 DNA 双链断裂,如果修复不当,可诱导脱靶突变和重排,从而导致 B 细胞发生致癌转化。
肿瘤遗传学
多种主要和次要遗传学事件在 MM 的发生和发展中至关重要。主要事件包括涉及14号染色体上 IGH 位点的易位,如t(4;14)、t(11;14)、t(6;14)、t(8;14)、t(14;16)、t(14;20),它们将癌基因置于免疫球蛋白重链位点的强增强子控制下,分别导致NSD2/FGFR3、CCND1、CCND3、MYC、MAF和 MAFB 的过度表达,以及奇数染色体(包括3、5、7、9、11、15和19)超二倍体。主要遗传事件发生于早期 B 细胞发育过程中,存在于疾病过程早期,其病因未知,可启动 MM 的发生。10%的 MM 患者存在涉及免疫球蛋白λ (IgL) 基因座的易位,且与预后不良相关,尤其是携带 IgL-MYC 易位的患者,其导致两个基因座的增强子局灶性扩增。模板插入是第二常见的复杂事件,存在于19%的患者中,主要参与超级增强子劫持和致癌基因(如 CCND1 和MYC)激活。MYC是一种中心致癌基因,参与多种细胞功能以及多种增殖和抗凋亡通路,其在大多数 MM 患者中的表达增加,与生存率低相关,因此在 MM 的发生、发展中具有中心功能。因此,MYC结构变异(包括易位、倒位、缺失、扩增、8号染色体单体型和三体以及突变)是与SMM 进展为 MM 相关的常见遗传事件。大多数易位可导致延伸增强子或超级增强子与 MYC 位点和伴侣位点(如免疫球蛋白编码基因 (IGH、IGK、IGL))并列。然而,MYC易位也可与非免疫球蛋白伴侣(如XBP1、FAM46C、CCND1和KRAS发生),其在 B 细胞成熟和 MM 发病机制中非常重要。
次要遗传事件通常更为复杂,包括拷贝数异常,如丢失 (13q、1p32、17p)、获得 (1q21)、MYC相关易位和驱动基因体细胞突变,如KRAS、NRAS、BRAF、TP53和DIS3,可影响关键 MM 信号通路,包括RAS-MAPK、核因子-κB(NF-κB) 和PI3K–AKT。它们在疾病后期发生,并与进展有关。其中部分事件对患者结局有显著影响,包括TP53双等位基因失活,原因在于染色体 17p(del17p) 同时突变和拷贝数丢失以及染色体 1q扩增(1q amp) ,采用现代疗法的生存率仍较低。值得注意的是,单细胞分析表明,大多数继发性基因变化是在复发时观察到的;但它们在诊断时已经存在于细胞的亚克隆部分中,并被治疗所选择。因此,在诊断时鉴定这些亚克隆可以帮助识别进展风险高的患者,这些患者可以从更有效的治疗中获益,以防止这些侵袭性亚克隆的克隆选择。
此外,有研究已经确定了额外的突变标记作为初诊和复发时突变的驱动因素,包括衰老、AID、DNA修复缺陷、APOBEC(载脂蛋白 B mRNA 编辑酶,催化多肽样)和美法仑暴露。这些突变标记显示了亚组特异性的证据,其中 APOBEC 标记与 MAF 易位t(14;16) 和t(14;20)MM、t(11;14) 和t(4;14)DNA修复缺陷以及超二倍体老化的相关性更高。关于APOBEC,研究表明高比例的 APOBEC 突变与高突变负荷和不良预后相关。在 MM 从 MGUS 进展为 MM 进展为原发性浆细胞白血病 (pPCL) 的不同阶段,APOBEC活性的贡献有所增加。
此外,复杂的染色体事件,如chromoplexy(由多重易位串联形成并与拷贝数丢失相关的新染色体结构)、模板插入(由于易位的相同串联导致拷贝数获得)和染色体碎裂(导致拷贝数增加和丢失的单一灾难性事件)也与 MM 的病因学和发展有关。染色碎裂和模板插入似乎参与 MM 发生的早期阶段,而其他事件(如癌基因的局灶性缺失和chromoplexy)则在后期出现,并可能参与耐药性和复发。需要注意的是,这些遗传事件大多是在 MGUS 和 SMM 等疾病癌前阶段的患者中发现的。因此,来自相同SMM 和症状性 MM 个体的配对样本的基因组分析显示具有相似的细胞遗传学、突变和重排特征。此外,涵盖早期浆细胞疾病患者的大型基因组数据集的拷贝数分析证实,大规模 DNA 改变在 MGUS 阶段也是克隆性的,发生于早期,是正常浆细胞最初转化为 MGUS 的基础。然而,部分拷贝数热点随着时间的推移而富集,可能对疾病发展极为重要。综上所述,这些数据证实,此类遗传事件是 MM 发病机制所必需的;但MM并非单纯是一种遗传疾病,其他因素也参与疾病的发生和发展。
骨髓微环境
目前认为,浆细胞生长和增殖的骨髓微环境可提供促进肿瘤生长和促进免疫逃避和耐药性发展的独特微环境(图2)。
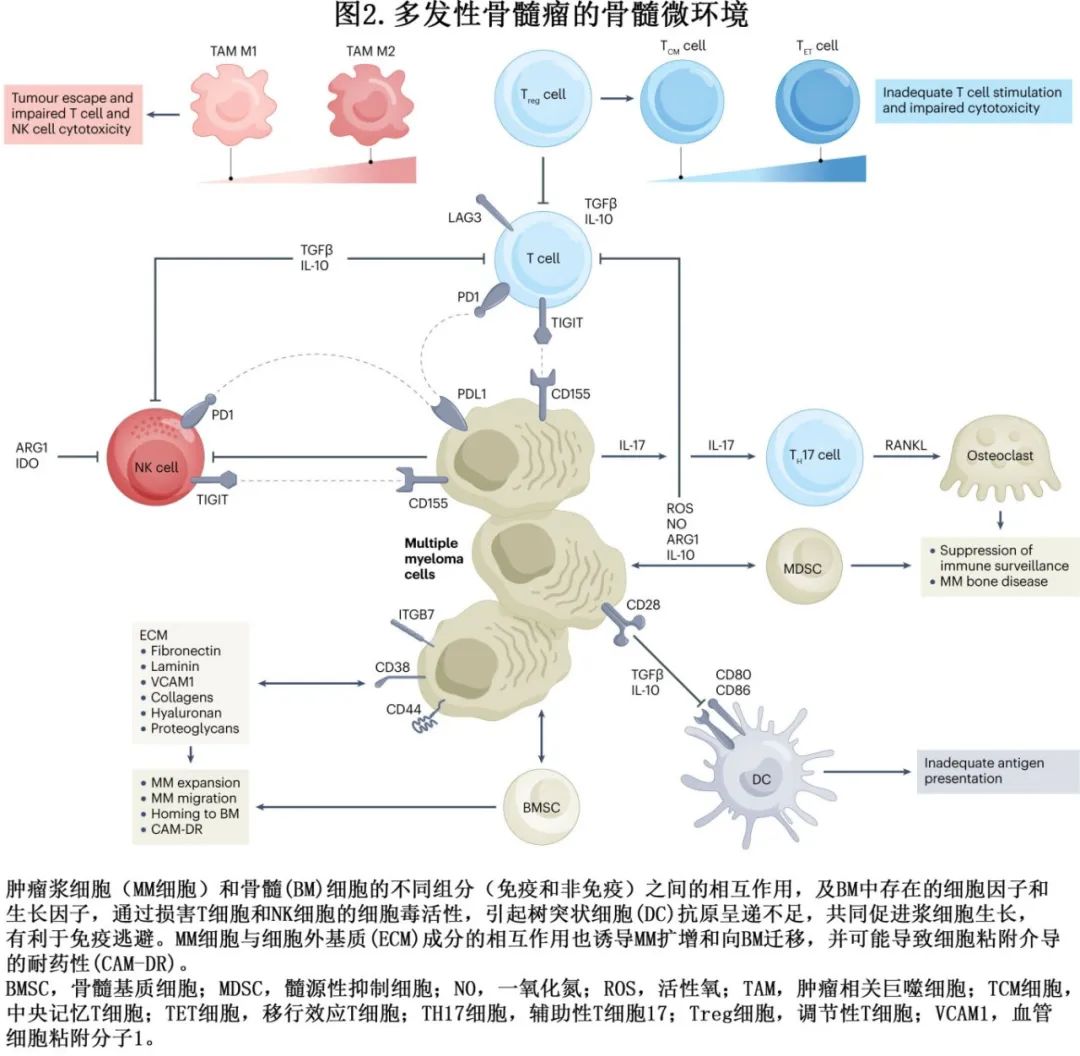
骨髓微环境包括细胞外基质 (ECM) 蛋白和多种细胞类型,包括基质细胞、成骨细胞、破骨细胞、内皮细胞和许多免疫细胞,如 T 细胞、自然杀伤 (NK) 细胞、单核细胞和促进 MM 演化的髓源性抑制细胞 (MDSC)。浆细胞与骨髓微环境的相互作用可导致分泌多种细胞因子和生长因子,包括IL-6、BAFF、APRIL和VEGF,它们可通过激活胞内信号(可调节恶性细胞生长、增殖和迁移,包括NF-κB通路、PI3K–AKT–mTOR信号转导、JAK–STAT和 MAPK 通路)促进浆细胞生长。骨髓细胞成分、ECM成分(如纤连蛋白、层粘连蛋白、血管细胞粘附分子1(VCAM1)、蛋白聚糖、胶原和透明质酸)以及浆细胞表面的多种粘附分子之间存在直接的细胞-细胞和细胞-基质相互作用。细胞粘附分子包括 N-钙粘蛋白、选择素、整合素、透明质酸受体、CD38和硫酸乙酰肝素蛋白聚糖,可通过促进恶性浆细胞的增殖和存活参与浆细胞和骨髓细胞之间的相互作用,促进细胞粘附介导的耐药性发展,以及通过上调 MDSC 和下调树突状细胞和 T 细胞促进免疫功能障碍。
免疫细胞。骨髓中也存在不同类型的免疫细胞,其组成和功能在 MM 进展中至关重要,可促进免疫逃逸。因此,MM患者骨髓中 IL-6 和TGFβ水平升高可损害CD4+ T细胞增殖,改变辅助性 T 细胞1(TH1) 和 TH2 细胞之间的平衡,并增加 TH17 细胞数量,通过分泌 IL-17 和 IL-10 抑制免疫监视并激活破骨细胞生成,导致 MM 骨病。已发现MM 进展期间T 细胞群的多种改变。单细胞基因组学研究表明,从MGUS到MM的转变与具有记忆和干细胞样表型的记忆和初始 CD4 和 CD8 T细胞数量减少相关(TCF1-high),而在 MM 患者骨髓中观察到更多的终末效应 CD8 T细胞(颗粒酶B+)及CD14+和D16+单核细胞增加。而且,MM 中已报道了出现衰老和耗竭的T细胞,其缺乏CD28、CD57和多种抑制性受体(如LAG-3、TIGIT和PD1)的表达上调,增殖能力降低,细胞毒性活性缺陷。值得注意的是,预先存在的 T 细胞的功能状态也是 MM 对 T 细胞衔接器 (TCE) 反应的关键决定因素。对 TCE 无应答的患者表现出基线免疫耗竭,其特征为大量终末耗竭 T 细胞和效应 T 细胞减少。而临床应答患者表现出快速和持续的 T 细胞受体 (TCR) 克隆型扩增,通常早在 TCE 治疗的第1周期后开始,并在整个治疗过程中持续存在。因此,免疫监测和 TCR 细胞库谱分析也可在不久的将来用于选择治疗。
同时,调节性 T(Treg) 细胞、MDSC和肿瘤相关巨噬细胞 (TAM)的扩增维持免疫抑制环境。与健康供者相比,MM患者外周血中功能性 Treg 细胞(以CD4+ CD25+ FoxP3+表型为特征)的频率增加。值得关注的是,MM患者的 Treg/TH17 细胞比值偏向于 Treg 细胞,可诱导免疫抑制状态。MDSC是一组异质性未成熟髓源性细胞,在 MM 患者骨髓中明显更频繁。与年龄匹配的对照组相比,粒细胞 MDSC形成了 MM 患者外周血和骨髓中存在的主要群体。它们可以通过激活 Treg 细胞、分泌活性氧、一氧化氮和免疫抑制细胞因子(如 ARG1 和IL-10)来抑制固有和适应性免疫应答。值得注意的是,与 MGUS 或SMM患者的骨髓相比,MM患者的骨髓也富含CD163+ CD206+ M2(抑制性)表型的TAM。它们通过CXCR4–CXCL12轴募集,可阻断脂多糖诱导的 TNF 分泌(M1反应的标志)。此外,它们的吞噬活性受损,抗原呈递能力较差,并生成 IL-6 和IL-10,导致 T 细胞和 NK 细胞的活性受到抑制。有趣的是,单细胞分析证明,与骨髓相比,巨噬细胞在局灶性病变的微环境中显著耗竭。在配对样本中观察到 T 细胞库的比例变化,但未报告 T 细胞克隆位点特异性扩增或耗竭的差异,从而证实MM的空间异质性。
多项研究也显示在MM进展过程中发生 NK 细胞功能障碍。由于 NK 细胞活化受体(NKG2D和NKp30)下调和脱颗粒标志物(LAMP1或CD107a)低表达,而过表达抑制剂受体(PD1和TIGIT)与 MM 细胞上表达的配体相互作用介导 NK 细胞损伤,NK细胞的细胞毒性功能降低。最后,在 MM 中有报道树突状细胞的损伤。由于骨髓微环境中存在 IL-10 和TGFβ,在 CD40 配体刺激后,树突状细胞无法上调CD80 表达,损害了抗原呈递到细胞毒性 T 细胞。值得注意的是,已报告 MM 患者骨髓中非经典树突状细胞(浆细胞样树突状细胞)数量增加。它们不能刺激 T 细胞增殖,但可通过直接接触浆细胞支持 MM 生长。
间质基质细胞。间质基质细胞 (MSC) 也是非造血骨髓微环境不可分割的一部分。最近的单细胞 RNA 测序工作已经确定 MM 特异性炎性MSC,其在空间上与肿瘤细胞和免疫细胞共定位,并通过激活干扰素应答效应 T 细胞和CD8+干细胞记忆 T 细胞群来诱导炎症。在疾病转化过程中认识MM细胞与骨髓免疫微环境相互作用的进一步进展,也得益于具有免疫功能的小鼠模型。因此,已经开发了类似人类 MM 的基因工程小鼠模型,用于研究 MM 进展中的遗传事件,并检测和预测对免疫治疗药物联合的反应。
骨骼病理生理学
综上所述,这些遗传和微环境变化导致免疫功能障碍,并导致 B 细胞组成发生显著变化,以及SMM和 MM 患者中经常发生的低丙种球蛋白血症、感染风险增加和疫苗接种反应差。伴相关溶骨性病变的骨病是 MM 的常见表现,可表现为骨痛和/或高钙血症,并导致骨骼相关事件,如病理性骨折和脊髓压迫。其发病机制复杂,由骨重建平衡紊乱引起,导致破骨细胞过度活化和抑制成骨细胞。该过程由多个细胞内信号级联和分子介导。RANK–RANKL–OPG通路与浆细胞产生的MIPα和 TNF 一起参与破骨细胞的活化。成骨细胞的抑制是由Wnt-β-catenin级联介导的,是由于骨髓中DKK1、硬化素(sclerostin)和 激活素A(activin-A) 升高所致。细胞因子(如IL-6、IL-17、IL-3和TGFβ)的释放也会损害骨形成的平衡。具体来说,浆细胞与基质细胞之间通过整合素 VLA4 等粘附分子的相互作用,有利于浆细胞的增殖,导致浆细胞产生MIP1α和MIP1β。这些趋化因子可增加RANK-L生成,导致破骨细胞活化,抑制成骨细胞分化和骨吸收。Notch信号通路也参与 MM 诱导的破骨细胞生成。MM细胞上表达的跨膜受体NOTCH1、NOTCH2、NOTCH3和 NOTCH4 与其骨髓基质细胞 (BMSC) 上存在的配体结合,可增加破骨细胞的数量和大小,增强其对骨的吸收作用。N-Cadherin也参与骨病,通过结合LRP5、阻断 Wnt 信号通路和减少成骨细胞骨形成。BMSC还通过与浆细胞的相互作用,获得异常的表观遗传学改变,刺激 MSC增殖并损害 BMSC分化为成骨细胞的能力。此外,成骨细胞、BMSC和浆细胞产生的 DKK1 可抑制 Wnt 信号通路,抑制成骨细胞活性和新骨形成。最后,骨细胞和浆细胞产生的硬化素可抑制骨形成蛋白(bone morphogenetic proteins)结合配体,从而抑制进一步的骨形成。
临床表现
骨病仍是 MM 患者最常见的并发症,可导致骨骼相关事件,如骨痛、病理性骨折和脊髓压迫,损害患者的生活质量(QOL)和生存期。诊断时>80%的 MM 患者存在骨病,并且在复发阶段更普遍。骨病的严重程度与肿瘤负荷和疾病状态呈正相关,且病理性骨折患者的死亡风险显著较高。因此,需要继续研究骨病的机制,以产生更有效的骨保护剂来改善患者预后。
肾损害是 MM 的另一种常见临床表现,高达40%的患者在诊断时表现为肾功能不全。轻链管型肾病 (LCCN) 是 MM 患者急性肾损伤 (AKI) 的主要原因,目前归类为 MM 定义事件(MM-defining event)。其主要是由于浆细胞产生的单克隆FLC对肾小球和肾小管的毒性作用,与Tamm–Horsfall蛋白相互作用,生成 MM 管型,可以阻断肾小球流动,引起肾小管萎缩和间质纤维化。AKI也可由 FLC产生的过氧化氢和NF-κB的 FLC 活化以及凋亡信号调节激酶 1(ASK1) 和 STAT通路所介导,这些通路可诱导炎症,促进肾小管间质纤维化并进一步诱导肾损害。
肾损害也存在其他促发因素,包括脱水、高钙血症和使用肾毒性药物,如NSAID、利尿剂和肾素-血管紧张素-醛固酮系统阻滞剂。虽然使用新药可改善长期预后,但 LCCN 患者的短期死亡率仍显著较高,尤其是在肾衰未逆转的情况下。因此,适当治疗对改善这些患者预后非常重要。
髓外病变(EMD)是一种侵袭性MM,预后不良,其特征是克隆能够独立于骨髓微环境生长并浸润其他器官。诊断时EMD的发生率较低 (0.5-5%),多见于皮肤和软组织。复发时可达3-15%,大多数典型部位包括肝脏和中枢神经系统。MYC 过表达的 EMD 患者多存在高危细胞遗传学,其中del17p13和 del13q14 是最常见的异常。与位于骨髓的 MM 相比,在 EMD 中也报告了较高的基因组复杂性。在 EMD 中也有细胞粘附分子下调和血管生成和自分泌存活因子(如 MALAT1)增加的报道。然而总的来说,其基因组学和生物学尚未得到很好的表征;因此迫切需要对其进行进一步研究,以确定 EMD 患者更好的治疗策略。
从癌前状态至 MM 的疾病进展也与抗肿瘤免疫的进行性丧失和免疫效应细胞的改变有关。T细胞免疫功能障碍和 B 细胞组成变化以及随后的低丙种球蛋白血症可增加发生细菌和病毒感染(包括COVID-19)的风险。因此,与健康个体相比,MM患者在其病程中发生感染的风险较高,且感染是 MM 患者早期死亡的主要原因之一。
此外,MM患者对疫苗接种的应答较差,这是由于 B 细胞组成的变化和抗骨髓瘤方案的使用。例如,接种 SARS-CoV-2 疫苗导致 MM 患者和SMM 患者的抗体应答低于年龄和性别相似且无恶性疾病的健康对照。因此,需要密切监测感染、适当的预防和支持治疗,以尽量减少这些严重并发症。
最后,在 MM 患者中可发现血液学并发症,包括贫血、骨髓衰竭和止血异常。贫血通常是该疾病的首发症状,其诱因包括浆细胞替代骨髓、骨髓中CCL3(抑制造血干细胞祖细胞生成红细胞)表达升高和相对促红细胞生成素缺乏(部分由肾损害引起)。严重粒细胞减少和血小板减少在诊断时并不罕见,常由浆细胞的骨髓浸润引起。相比之下,由于循环单克隆蛋白可增加血液粘度并损害血小板和凝血功能,在 MM 患者中经常检测到止血异常。
总之,一系列疾病相关因素是 MM 并发症和进展的基础。进一步理解前体阶段和疾病进展的免疫功能障碍,对于开发新型免疫治疗策略和优化当前治疗至关重要。
诊断、筛查和预防
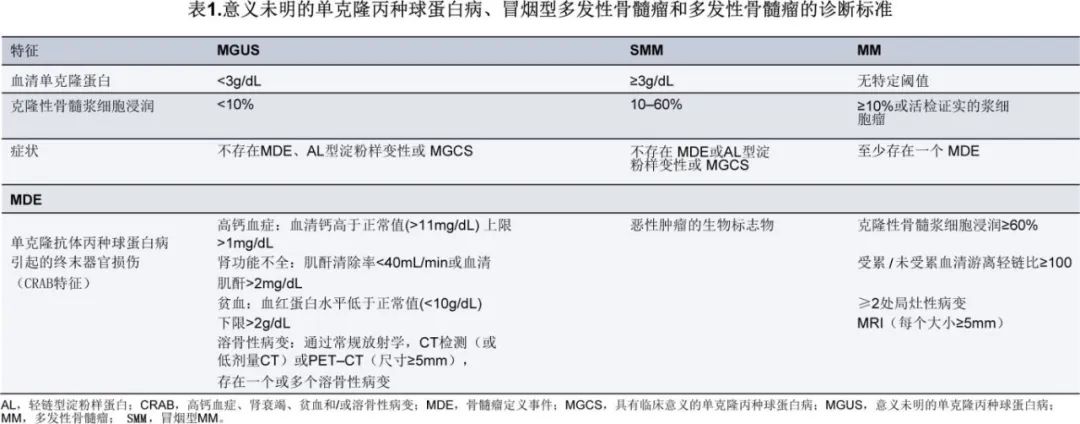
普遍接受国际骨髓瘤工作组 (IMWG) 标准用于确立 MM 的诊断。诊断需要至少10%的克隆性浆细胞的骨髓浸润以及存在至少一个骨髓瘤定义事件。克隆性须通过免疫组化、免疫荧光或流式细胞术证实。骨髓瘤定义事件包括不能归因于单克隆丙种球蛋白病以外原因的标准 CRAB 特征(高钙血症、肾功能不全、贫血和/或溶骨性病变),以及强烈预测即将发生的器官损伤的新生物标志物(克隆性骨髓浆细胞浸润≥60%,受累与未受累血清游离轻链比值≥100,和/或MRI 显示≥2个局灶性病变[每个病灶≥5mm])。无骨髓瘤相关事件时可诊断为前体状态,如 MGUS 或SMM(表1)。
诊断检查
患者病史和体格检查可提供关键信息,用于指导诊断。应记录一级亲属中关注血液肿瘤的家族史,且详细记录既往病史和药物对于器官受累的鉴别诊断和确定最佳定制治疗至关重要。
重要的血液检查包括全血细胞计数和分类计数、全面生化筛查(肌酐、肾小球滤过率、白蛋白、总血清蛋白、钙和乳酸脱氢酶[LDH])、血清免疫球蛋白、κ和λ FLC以及血清β2微球蛋白。外周血涂片出现红细胞呈缗钱状排列提示MM。此外,外周血涂片能够评估是否存在pPCL(定义为外周血涂片中存在≥5%的循环浆细胞)。血清蛋白电泳和血清免疫固定电泳是关键检测,可区分多克隆高丙种球蛋白血症和单克隆高丙种球蛋白血症,以及定量和确定单克隆副蛋白亚型。此外,应在诊断时评估所有患者尿液样本中的蛋白尿,如果24h 尿液样本中存在蛋白尿,应评价总蛋白。考虑到血清 FLC 的优效性,仅当血清 FLC 测量值不可用于诊断轻链型MM时,才应评估轻链蛋白尿(Bence Jones蛋白)。尿蛋白电泳和免疫固定电泳可显示和定量单克隆副蛋白,尽管仍作为推荐,但在大多数中心通常不再进行。然而在蛋白尿患者中,应评估白蛋白尿,如果白蛋白是尿液中的主要蛋白,应排除肾小球病(如轻链型淀粉样蛋白/原发性 (AL) 淀粉样变性或轻链沉积病)。因此,可能需要肾活检来确定肾损伤的潜在原因。
根据 IMWG 标准,骨髓活检和/或骨髓穿刺对于通过识别至少10%的克隆浆细胞来确诊至关重要。通过二代流式细胞术 (NGF) 和/或二代测序 (NGS) 对骨髓浆细胞进行基线分析对于确定克隆型和评价疾病过程中可测量残留病 (MRD) 的状态也特别有价值。在 CD138 阳性分选骨髓浆细胞中进行的荧光原位杂交 (FISH) 也是评价是否存在具有预后价值的细胞遗传学异常的标准程序,包括del(17p)、t(4;14)、t(14;16)、t(11;14)、t(14;20)、del(1p32) 和 1q21 的获得或扩增。尽管 NGS 未常规使用,但也可开发用于检测 MM 的基因组异常,并且可能在未来替代FISH。
影像学检查对确定骨髓瘤骨病的存在和程度具有重要意义。全身低剂量 CT(WBLDCT) 由于其高灵敏度,已取代常规骨骼检查(X线平片)成为 MM 影像学的金标准。18F-氟脱氧葡萄糖 (FDG)PET–CT也是比传统影像学更灵敏的技术,应尽量使用。FDG PET-CT在排除孤立性髓外浆细胞瘤患者存在其他病灶方面至关重要。全身MRI(WBMRI)可提供具有预后价值的重要信息,如是否存在局灶性病变。事实上,如果 WBLDCT 结果不确定,并且如果疑似SMM 患者的 WBLDCT 结果为阴性,则需要 WBMRI 来排除孤立性骨浆细胞瘤患者中存在其他病灶。对于存在影响脊柱的骨病患者,如果未进行WBMRI,脊柱和骨盆MRI对于评估椎管和脊髓至关重要。
鉴别诊断
MGUS和SMM患者通常无症状,M蛋白通常在偶然检查、基础自身免疫性疾病检查或实验室检查值异常时发现(例如,如果总蛋白水平升高、红细胞沉降率升高或血细胞值异常)。而在表现为由骨病引起的骨痛、疲乏、由贫血引起的劳力性呼吸困难和由高钙血症和 AKI 引起的意识模糊的患者中,结合M蛋白和外周血涂片中的红细胞缗钱状,症状性 MM 的诊断相当直接。对于无症状患者,应仔细评估即将发生的器官损伤的生物标志物(克隆性骨髓浆细胞浸润≥60%、受累与未受累血清游离轻链比值≥100和/或 MRI 上有≥2个局灶性病变(每个病灶≥5mm),以区分需要治疗的患者与SMM患者。
值得注意的是,将 CRAB 特征归因于基础单克隆丙种球蛋白病至关重要,应考虑已知和未知的合并症以及合并用药。血红蛋白水平应与以前的测量值进行比较,而胃肠道内镜检查可用来排除失血。可能需要评估原发性甲状旁腺功能亢进,尤其是孤立性高钙血症患者。对于存在溶骨性病变的患者,可能需要对恶性实体瘤进行检查,而对于孤立性病变,可单独进行 CT 引导活检。在无骨髓瘤相关事件的情况下,如果活检确认的骨或软组织单一病灶中含有克隆浆细胞,而骨髓中无克隆浆细胞,则提示为骨或软组织孤立性浆细胞瘤(如果克隆性骨髓浆细胞<10%,则骨髓受累极轻微)。肾损害伴选择性蛋白尿和高水平血清受累FLC (≥500 mg/L) 可提示骨髓瘤LCCN;否则的话,可能需要肾活检来确诊。
此外,即使是少量的单克隆丙种球蛋白病或过量的FLC,也可在无骨髓瘤定义事件的情况下触发器官损伤。从病理生理学角度来看,与具有临床意义的单克隆丙种球蛋白病 (MGCS) 相关的疾病可能归因于所有或部分单克隆免疫球蛋白的组织沉积、自身抗体活性、补体激活、细胞因子激活或其他无法辨别的机制。MGCS需要多学科方法和广泛检查,以排除其他原因,并将临床表现归因于单克隆丙种球蛋白病。脂肪组织或靶器官的活检样本刚果红染色阳性可能提示AL型淀粉样变性。
对于部分特征明确的疾病,如POEMS(多发性神经病、器官肿大、内分泌疾病、单克隆浆细胞病、皮肤改变)综合征、冷球蛋白血症、TEMPI(毛细血管扩张症、促红细胞生成素升高和红细胞增多症、单克隆丙种球蛋白病、肾周积液、肺内分流)综合征、Schnitzler综合征和全身毛细血管渗漏综合征,应满足特定的诊断标准。
风险分层
MM 的国际分期系统 (ISS) 已普遍用于新诊断 MM 患者的风险分层。最初的 ISS 是基于血清白蛋白和β2微球蛋白水平,而在第一次修订 (R-ISS) 和第二次修订 (R2-ISS) 中纳入了 LDH 水平和高危细胞遗传学(BOX 1)。其他多个因素也与不良预后相关,包括体能状态差、衰弱指数增加、循环浆细胞数量多、存在EMD、重度肾损伤、高危基因表达特征(如 GEP70 和SKY92)、非超二倍体核型和同时存在≥3种或细胞遗传学异常。

监测
MM 的缓解通常在每个化疗周期后评价,并基于血清单克隆蛋白浓度(免疫球蛋白或FLC),使用综合速率和单克隆蛋白浓度的不同临界值来评估缓解水平。完全缓解要求血清和尿液免疫固定电泳和骨髓阴性,浆细胞<5%,而严格的完全缓解要求在此基础上FLC比值正常、免疫组化检查骨髓活检样本中无克隆细胞。考虑到在新药治疗下MM患者的完全缓解率较高,故开发了高于传统完全缓解的新的缓解类别,即MRD。使用基于 NGF 或 NGS 的方法在骨髓中评价MRD,最小灵敏度为1/105个有核细胞或更高。持续 MRD 定义为MRD 阴性状态持续6或12个月。最后,患者随访期间可重复进行PET–CT,以评估影像学MRD。
预防
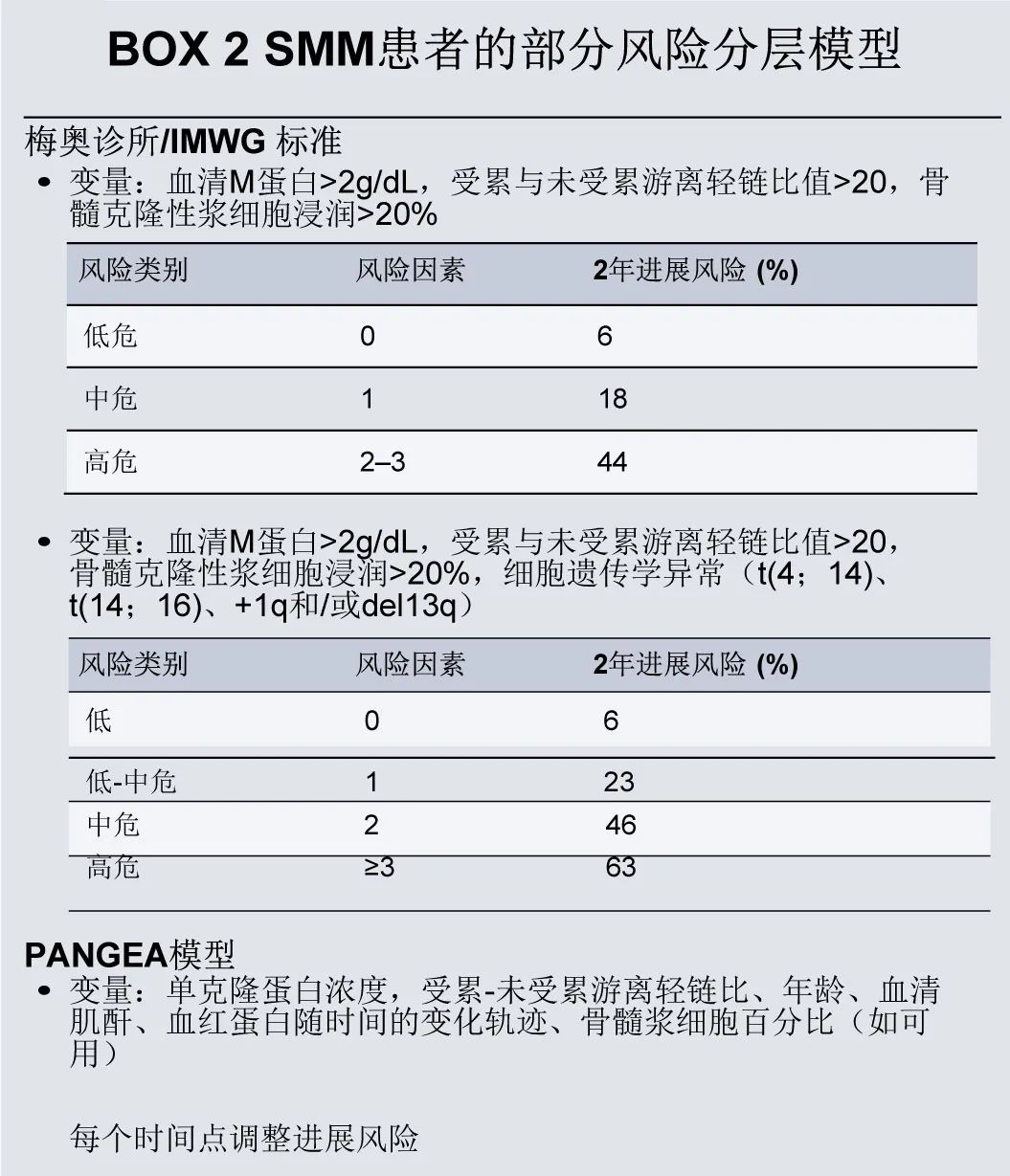
没有强有力的证据支持任何可改变的饮食、环境或生活方式风险因素与发生 MM 风险之间存在因果关系。因此,在 MM 风险因素水平上没有关于预防的建议。然而诊断其前体状态(包括 MGUS 和SMM)由于可给予密切监测和及时治疗干预,可能预防 MM 相关的终末器官损伤并改善生存结局。根据疾病的自然史,每年从 MGUS 进展为 MM 或相关疾病的概率约为1%,但从SMM进展为 MM 的风险在诊断后的前5年为每年10%,在随后的5年中约为每年3%,在随后的10年中为每年1%。有多种简单且经验证的模型可用于预测SMM患者的进展风险(BOX 2),这些评分可以在诊断时和随访期间连续评价。早期治疗高危前驱疾病显示较高缓解率,并可延长至进展为 MM 的时间,但尚未成为标准治疗,应鼓励这些患者入组临床试验,以确定潜在的生存获益。
筛查
不建议对一般人群进行单克隆丙种球蛋白病筛查。然而,年龄增长、男性、非裔美国人和血液肿瘤家族史已确定为风险因素,或可指导定向筛查。PROMISE定向筛查研究和 Mass General Brigham 生物样本库项目的汇总分析显示,MGUS在高危个体(具有非裔美国人或血液恶性肿瘤家族史和≥50岁)中的患病率高达13%,而在相同年龄组的一般人群中为3%。有人提出,MGUS筛查出的患者合并症和全因死亡风险也可能增加。冰岛筛查、治疗或预防 MM (Iceland screens, treats, or prevents MM,iStopMM) 研究是一项在≥40岁冰岛居民中开展的基于人群的筛查研究。在75422例筛查者中,在≥40岁个体中SMM患病率为0.53%。男性和女性中SMM的患病率分别为0.67%和0.39%,且均随年龄增长而增加。尽管早期检测 MGUS 和SMM 或可及时诊断MGCS,并在前驱疾病患者中部分预防 MM 相关终末器官损伤,但这些获益是否超过筛查的社会经济学和心理风险仍存在争议。
治疗
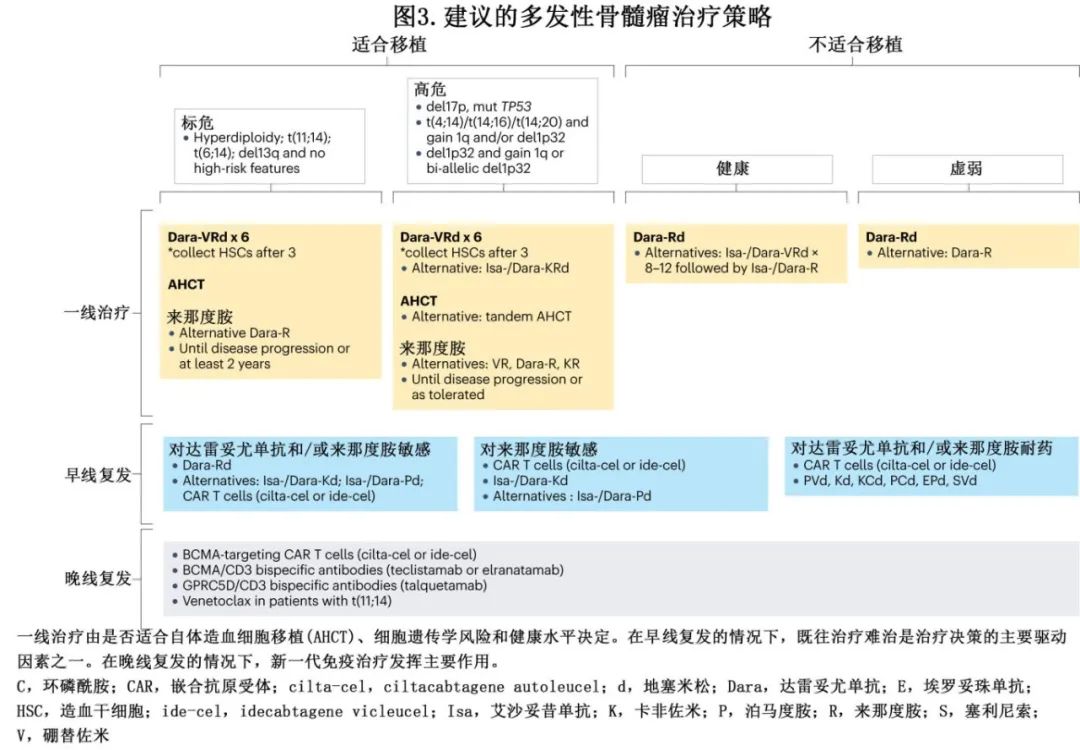
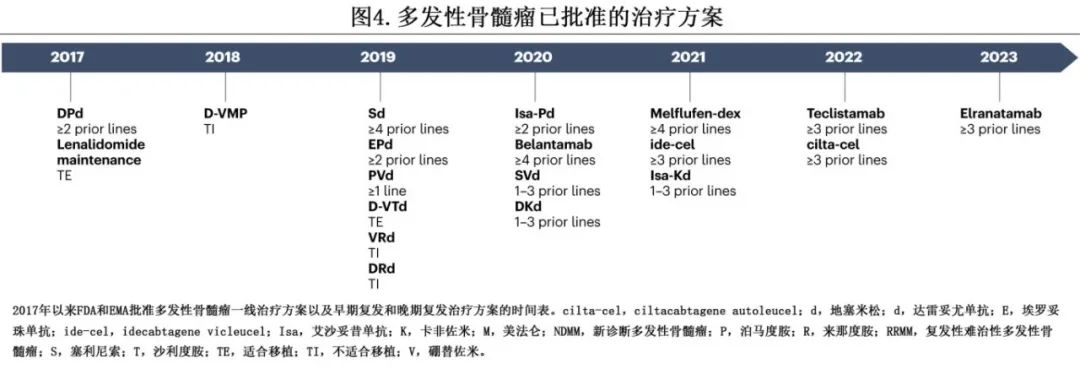
随着 MM 治疗选择范围的扩大,管理也变得越来越复杂(图3、4)。尽管取得了显著进展,但由于反复复发和产生耐药性,该病仍无法治愈。对于CRAB 阳性 MM 或生物标志物定义的 MM 患者可开始一线治疗。但研究表明,生物标志物定义的 MM(骨髓浆细胞≥60%或血清游离轻链比≥100)与 CRAB 阳性 MM 相比,前者的进展风险显著降低。因此,应谨慎考虑此类患者的治疗,考虑频繁随访进行骨骼影像学和实验室检查。
初始治疗
MM 初始治疗的选择需要谨慎考虑多个因素,治疗的目标是获得快速有效的疾病控制,逆转相关并发症,但不同患者可达到的剂量强度也不同。年轻或健康患者的目的是达到深度缓解,理想情况下是实现 MRD 阴性,而老年或衰弱患者应接受强度较低的连续治疗,在减轻毒性的同时管理疾病。尽管新疗法的出现倾向于改变策略,但是否适合移植仍是选择初始治疗的关键决定因素。衰弱评分也是指导治疗决策的重要因素。
适合移植。适合移植患者的治疗包括诱导治疗、大剂量美法仑 (HDM) 和自体造血细胞移植 (AHCT)巩固以及后续维持治疗。四联方案已成为诱导和巩固治疗的标准治疗(如可用),例如达雷妥尤单抗-硼替佐米-沙利度胺-地塞米松 (D-VTd)、达雷妥尤单抗-硼替佐米-来那度胺-地塞米松 (D-VRd)、艾沙妥昔单抗-卡非佐米-来那度胺-地塞米松 (Isa-KRd)等。但四联方案可能不可用,此时经验证的选择包括不含抗 CD38 单抗方案(即 VTd 、VRd及硼替佐米-环磷酰胺-地塞米松[VCd]等)。
诱导后AHCT仍是一线治疗标准,正如IFM2009和DETERMINATION研究所证实。但一线AHCT 与复发时延迟 AHCT 的总生存期无差异,应权衡化疗和 AHCT 的毒性和获益。基于 EMN02/HO95 和 STAMINA 研究,双次AHCT在高危细胞遗传学患者中具有价值。一项基于 MRD 状态的临床试验中正在探索该方案,诱导化疗后 MRD 阴性的患者随机分配至降级策略(联合或不联合AHCT),而 MRD 仍为阳性的患者随机分配至单次或串联AHCT。2017年获批的来那度胺连续维持治疗与单独观察相比具有总生存期获益,但约30%的患者因毒性或第二原发恶性肿瘤而提前停用来那度胺,因此提出了关于来那度胺最佳治疗持续时间的问题(固定 vs 连续)。有研究正在探索来那度胺是否可以联合其他药物来改善维持治疗方案的疗效(PERSEUS研究中联合达雷妥尤单抗,FORTE研究中联合卡非佐米)。此外, MagnetisMM-7(NCT05317416) 和 MajesTec-4(NCT05243797) 研究中正在评价双特异性抗体在维持治疗中的作用。
然而,伴不良细胞遗传学或浆细胞白血病的超高危 MM 患者的结局仍不确定,因此在此类患者中评价了递增治疗。在评价AHCT 前后达雷妥尤单抗、低剂量环磷酰胺、来那度胺、硼替佐米和地塞米松 (Dara-CVRd) 治疗103例患者的 II 期 OPTIMUM 研究中,随访30个月后,无进展生存率和总生存率分别为77%和83.5%。
不适合移植。不适合移植的老年患者具有多样性,衰弱率较高。虽然将衰弱评估纳入 MM 管理相对较新,尚未在所有中心常规使用,但其在治疗策略和总体治疗目标中的重要性越来越得到认识。已经制定了多个衰弱评分,并以IMWG评分作为参照,该评分评价年龄、日常生活活动量表和 Charlson 合并症指数 (CCI)。IFM东部肿瘤协作组体能状态 (ECOG-PS) 指标包括年龄、ECOG-PS和CCI,已在各种试验中广泛用于回顾性衰弱评估。虚弱评分均强调一个关键见解:虚弱患者更容易发生治疗相关不良事件,通常导致治疗中止。因此,治疗策略可因衰弱评估而异。健康(Fit)或中等健康(intermediate Fit)患者接受较高剂量强度的治疗以达到深度缓解,而衰弱(frail)患者接受强度较低的治疗方案以减轻毒性。基于MAIA研究,达雷妥尤单抗-来那度胺-地塞米松 (DRd)是不适合移植患者的首选,适用于老年和衰弱患者。然而,根据MRD,DRd达到深度且持久缓解的可能性相对较低,鉴于 MRD 阴性可预测后续无进展生存期和总生存期,进一步改善不适合移植患者的一线治疗似乎很重要,不仅可改善无进展生存期和总生存期,还可使 MRD 持续阴性患者中止治疗,而非继续治疗直至进展。进一步改善 DRd 的策略正在探索,包括老年健康患者中添加硼替佐米,例如IMROZ研究使用艾沙妥昔单抗-硼替佐米-来那度胺-地塞米松 (Isa-VRd) 和 CEPHEUS研究使用 D-VRd;两研究均以VRd 作为对照组。BENEFIT研究比较Isa-VRd 与Isa-Rd,但对照组可能更优。IFM 2017-03研究在老年衰弱患者中探索了地塞米松减量策略,以尽量减少长期类固醇暴露的毒性。与适合移植的患者一样,包括达雷妥尤单抗在内的一线治疗在部分国家不可用,Rd是这些国家不适合移植患者的有效替代治疗选择。
新一代免疫治疗的作用也正在老年患者中评估。CARTITUDE-5研究(NCT04923893) 正在研究 CAR-T 细胞疗法,而 MajesTec-7 研究 (NCT05552222) 和 MagnetisMM-6研究 (NCT05623020) 正在探索双特异性抗体疗法。
复发性疾病的管理
大多数 MM 患者最终复发,需要进一步治疗。随着连续复发,疾病也会积累基因组和表观遗传学改变,导致药物难治性增加和缓解持续时间缩短。根据大多数专家的观点,复发通常分类为两类:早线复发,通常发生于既往1-3线治疗后;晚线复发,发生于既往≥3线治疗后,且通常伴有三类难治性疾病。管理复发患者时应考虑的因素包括患者特征(年龄、合并症、特定治疗路径的意愿或医院就诊频率)、疾病因素(进展速度、细胞遗传学、AHCT后早期复发和 EMD)和既往治疗状态(既往治疗的疗效和耐受性、残留或持续治疗相关毒性和对不同类别药物的耐药性)。当 MM 对一类药物耐药时,患者在复发时转换为另一类药物。
早线复发。早线复发包括不同情况,主要取决于来那度胺和达雷妥尤单抗治疗难治。对于复发时抗 CD38 和来那度胺未暴露患者,根据 POLLUX 研究的结果,首选治疗为 DRd 联合治疗。但随着来那度胺越来越多作为维持治疗,来那度胺难治性复发在临床实践中经常遇到。在这种情况下,抗 CD38 联合卡非佐米是首选方案,如达雷妥尤单抗-卡非佐米-地塞米松 (DKd)(CANDOR研究)或Isa-Kd(IKEMA研究),也可以考虑抗 CD38 联合泊马度胺(即使来那度胺和泊马度胺之间可能发生交叉耐药),如达雷妥尤单抗-泊马度胺-地塞米松 (DPd)(APPOLO研究)和Isa-Pd(ICARIA研究)。患者复发时对达雷妥尤单抗和来那度胺均耐药的情况越来越常见,这是一种难以治疗的情况,此时常用的选择包括硼替佐米-泊马度胺-地塞米松 (VPd,基于OPTIMISMM研究)和Kd 联合治疗(ENDEAVOR研究)。在这种情况下有时也会使用烷化剂,尤其是联合卡非佐米-环磷酰胺-地塞米松 (KCd) 和泊马度胺-环磷酰胺-地塞米松 (PCd)。其他替代方案包括埃罗妥珠单抗(elotuzumab)联合泊马度胺和地塞米松 (EPd,ELOQUENT-3研究)或exportin-1 抑制剂塞利尼索联合硼替佐米和地塞米松 (SVd,BOSTON研究)。还进行了两项 CAR-T 细胞治疗早线复发的 III 期研究,即KarMMa-3研究纳入了既往接受过2-4线治疗并随机接受 idecabtagene vicleucel(ide-cel) 或5种标准方案之一的患者,以及CARTITUDE-4 研究纳入既往接受过1-3线治疗的患者随机接受 ciltacabtagene autoleucel(cilta-cel) 或标准方案(DPd或泊马度胺-硼替佐米-地塞米松 [PVd])。基于此,CAR-T细胞治疗(如可用)也是早线复发时需要考虑的重要选择。其他临床试验正在评估双特异性抗体在早线复发中的作用,如 Majesific Tec-3 研究(特立妥单抗,teclistamab) 和 MagnetisMM-5研究(elranatamab)。
晚线复发。在既往3线治疗后发生的复发通常为三类难治性(蛋白酶体抑制剂、IMiD和抗 CD38 抗体)或甚至是五药难治性(硼替佐米、卡非佐米、来那度胺、泊马度胺和抗 CD38 抗体),属于未满足的医疗需求。LocoMMotion和 MAMMOTH 研究等回顾性队列试验证明,三类难治性患者的结局较差,中位总生存期分别为8.9个月和9.2个月。新一代免疫治疗的出现是晚线复发管理的重要进展,目前已有抗BCMA治疗获批,包括抗体药物偶联物belantamab mafodotin(DREAMM2,mPFS 2.9个月)、双特异性抗体特立妥单抗(MajesTec-1,mPFS 11.3个月)和elranatamab(MagnetisMM-3,mPFS17.2个月)、CAR-T 细胞疗法ide-cel(KarMMa,mPFS 12.1个月)和cilta-cel(CARTITUDE-1,mPFS 34.9个月)。最近,基于 MomumenTAL-1 研究结果(12个月PFS 54%),首个 GPRC5D 靶向药物双特异性抗体 talquetamab 也获批。对这些免疫治疗进行排序是一个重要问题,临床实践中需要生物学工具来评估 T 细胞组成的健康度和靶点的存在或突变。在这种情况下可用的其他药物包括塞利尼索(STORM,mPFS 3.7个月)和维奈克拉用于t(11;14) 易位患者(未获批)。控制疾病有时也需要常规化疗,如蒽环类药物、烷化剂和苯达莫司汀,但对于计划接受双特异性抗体或单采用于CAR-T 细胞治疗的患者,应避免使用烷化剂和苯达莫司汀,因为它们与 T 细胞衰老增加相关,可能损害免疫治疗的疗效。在复发难治性 MM 中,可进行 NGS 筛查适合靶向治疗的突变(如可用),约8%的复发难治性 MM 患者携带 BRAF 突变,联合BRAF–MEK抑制在这些患者中显示有前景的结果。
最后,终末期疾病患者的症状负担较高,尤其是骨痛,应给予姑息治疗,包括有效的疼痛管理。
对症和支持措施

除 MM 特异性治疗和不良反应管理外(BOX 3),患者通常需要管理疾病的基础症状,包括骨病、疼痛、高钙血症、肾功能不全、贫血、疲乏和感染。需要注意的是,MM患者中最常见的严重急症为脊髓压迫、AKI和高钙血症。
对于骨病变的管理,双膦酸盐可有效延缓溶骨性病变的进展并预防骨折。诸如椎体成形术(将骨水泥注入骨折的椎骨)和球囊扩张椎体后凸成形术(微创手术以对齐断裂的椎骨)等手术是控制椎骨骨折相关疼痛的标准方案。放疗亦可缓解椎体骨折相关的疼痛。骨折患者可能需要手术,属于椎体骨折和脊髓压迫患者的急症。在所有疾病阶段,定期进行疼痛评估至关重要,根据需要使用阿片类或非阿片类药物治疗可获得最佳疼痛管理。NSAID与 AKI 风险增加相关,尤其是在老年患者、慢性肾病患者和肾功能受损的脱水患者中;因此MM患者禁用NSAID,以预防肾衰竭。相比之下,在碘基对比剂给药后,单纯MM并非 AKI 的风险因素,但在肾功能受损的脱水患者和高钙血症患者中风险变得显著,应在对比剂给药前予以纠正。对于高钙血症,MM患者除接受 MM 治疗外,通常还接受静脉输液和双膦酸盐治疗,尤其是地塞米松,可在紧急情况下立即开始。MM患者AKI的管理应与肾病专家密切合作,以确保水电解质再平衡,并在需要时讨论透析,以及MM的具体治疗。BOX 3讨论了疲劳和感染的管理。
生活质量
健康相关 QOL(HRQOL) 定义为“涉及 QOL 或功能方面的概念,其受健康状况影响,并基于可测量的维度(即生理、心理和社会方面)”。MM可深度影响日常生活,导致身体负担(即疲乏和疼痛,以及对活动和体力活动的影响)和情绪负担(即痛苦、焦虑和抑郁,以及对关系的影响)。MM症状可强烈损害患者的HRQOL。
有多种工具可用于评估 MM 患者的HRQOL,每个工具都有其优点,并根据具体情况进行选择。MM临床试验中最常用的是欧洲研究组织和癌症治疗 (EORTC) 生活质量 C30 问卷(QLQ-C30 3.0版)、QLQ-C30补充20项 MM 模块 (QLQ-MY20) 和总体健康 EuroQol 5 维5级 (EQ-5D-5L) 量表。
患者报告结局 (PRO) 由患者直接评价,并基于患者对疾病及其治疗的感知。PRO是直接结局指标,可用作表征治疗获益的有临床意义的终点。它们从患者的角度提供关于治疗效果的独特和重要信息,可能会增进对一种正在测试的新药的整体治疗有效性的理解。临床试验和临床实践中的 PRO 评估在治疗决策、症状监测和患者满意度方面都很重要。
维持 HRQOL 是 MM 的基本目标,重点是了解疾病和治疗对患者的长期影响。尤其是,HDM后 AHCT 可导致 HRQOL 短期恶化和症状负担增加,但该不良影响是暂时的,AHCT 后1-2个月就可达到基线健康状况。此外,在接受 AHCT 的患者中,长期 HRQOL 通常有所改善(与基线时的 HRQOL 相比),可能与疾病控制更优相关。
同样,尽管随机试验表明,长期维持治疗可延长 AHCT 后 MM 患者的生存期,但对持续活性治疗相关潜在不良反应的担忧,也提出了延长生存期与改善生活的平衡问题。CONNECT MM研究比较了 AHCT 后接受任何维持治疗、来那度胺维持治疗或未接受维持治疗的患者的HRQOL,结果显示接受维持治疗与未接受维持治疗的患者的 HRQOL 无差异。
最后,复发或难治性 MM 患者的 HRQOL 显著低于新诊断 MM 患者,并且每次复发和后续治疗后 HRQOL 进一步恶化。因此,除临床结局外,考虑治疗对 HRQOL 的影响也至关重要。然而,在晚期患者中,CAR-T细胞治疗后PRO和 HRQOL 测量值(包括身体和情绪功能评分)显著改善,基于症状的评分降低。同样,在接受双特异性抗体治疗的患者中,也报告了疾病相关症状和 HRQOL 的早期和持续性具有临床意义的改善。
目前有许多 MM 临床试验将综合 HRQOL 作为终点,PRO从患者角度提供关于治疗效果的关键信息,这些结局应与治疗时提供给患者的信息相结合,应努力将 PRO 纳入日常临床实践中。
展望
来自精心设计的临床试验的知识必须与现实世界数据相结合,以改善治疗策略,从而改善各地 MM 患者的结局。根据临床试验人群之间以及临床试验和真实世界队列之间的患者和疾病特征,预后可能存在很大差异,这种差异可驱动结局的差异。一项基于加拿大人群的大型队列研究强调了在真实世界环境中接受治疗的 MM 患者的注册随机对照试验和治疗方案使用之间的显著疗效-有效性差异。研究发现,真实环境下的死亡率比临床试验高75%。
尽管临床试验是评价治疗结局的金标准,但患者选择存在问题,因为许多真实世界患者不符合严格的试验入选标准,因此真实世界环境中治疗的有效性尚未知。
未来的努力应侧重于全面分析:衰弱、MRD、MM风险评估、获得最先进治疗和临床试验的多样性。
老年患者的衰弱
衰弱和/或老年患者很少纳入临床试验,因此该患者组的获益不太明确。然而,包括 IMWG 在内的现有衰弱评分也存在问题,因为它们对年龄的评价权重很大,可能错误地将“健康老年人”归类为衰弱。因此各研究的衰弱患病率差异很大,范围为17%-74%。事实上,并非所有衰弱的人都是老年人;那么健康的老年患者是否与年轻的衰弱患者相同?必须使用易于在真实世界环境中使用的标准化工具更准确地识别衰弱患者。衰弱评分不仅应包括传统的临床参数,还应包括患者健康的生理、心理和社会方面;虚弱评估工具必须易于管理。尽管越来越多地将其纳入试验设计中,但衰弱的分类和临界值仍存在广泛的异质性,从而限制了评价任何相关结局的能力。招募衰弱患者将能够更好地了解治疗毒性,并确定停药是否是该患者组结局较差的真正原因。
MRD作为治疗评价的“新”终点
迫切需要开发 MRD 并将其纳入药物开发和注册的临床试验中。用于初始治疗和复发性 MM 治疗的新药已将无进展生存期和总生存期延长数倍。因此对于评估新药单药或联合发难治疗新诊断MM的试验,不再可能以无进展生存期 和总生存期为终点,因为这些指标需要持续10年以上的临床试验。这种延迟的疗效确证对患者和医护都是不公平的;此外,由于此类试验的成本过高,也会减缓药物开发。因此,迫切需要参数或替代标志物,如MRD,其可在治疗后早期检查,并预测后续无进展生存期和总生存期。MRD阴性可能不是所有患者亚组(例如衰弱患者)的适当目标。是否可以使用 MRD 状态来决定治疗的强度或持续时间?将 MRD 评估更广泛地纳入临床试验,将使得医生能够确定患者是否应接受巩固治疗以达到 MRD 阴性,或维持治疗的持续时间是否可以通过 MRD 状态来定义。在疾病早期使用免疫疗法的时代,使用 MRD 状态定义治疗持续时间将具有重要意义,能够实现快速和深度缓解,包括持续MRD 阴性。
常规实践中在诊断时标准化和细化风险评估,以改善治疗的个性化
建立高危疾病的定义以进行风险调适(risk-adapted)治疗至关重要。诊断时定义风险对于有效设计未来的临床试验和指导在常规实践中需要哪些临床数据都很重要,但高危疾病的定义存在挑战。目前根据R-ISS在诊断时确定高危 MM,R-ISS于2015年建立,是新诊断 MM 的精准预后模型,包括 ISS 分期、血清 LDH 和FISH 评估的高危细胞遗传学。高危细胞遗传学异常定义为存在 del(17p) 和/或t(4;14) 和/或t(14;16) 或 LDH 高于正常上限。关于修订 R-ISS已形成专家共识,包括 FISH 检测到的1号染色体异常、NGS检测到的 TP53 突变或缺失、NGF细胞计数检测到的循环浆细胞量和PET–CT上的多发髓外浆细胞瘤。诊断时准确评估风险很重要,原因包括但不限于:(1) 通过初始治疗已达到最长缓解期,因此首次缓解的持续时间是影响患者预后的最重要因素之一;(2) 准确定义临床试验入组的风险; (3) 确定实践中应常规获得的临床数据,以定义风险。
制定战略,扩大获得最先进治疗的机会
并非所有国家都有所有药品,即使是高收入国家,由于成本高,某些药品也可能无法获得。由于大多数患者需要联合两种或两种以上昂贵新药、连续治疗和延长病程的多药治疗方案,MM中的药物经济学问题得以放大。必须解决下一代新药与基于免疫抗体的治疗联合使用的巨大成本,以确保全球患者获得这些治疗。首先需要能够确定在每个亚型中效果良好的药物的试验,但更重要的是,从成本的角度来看,还需要能够确定在特定细胞遗传学亚型患者中不太可能奏效的药物的试验。其次,需要确定与目前多年长期治疗的方法相比,短疗程治疗是否可以获得同等程度的生存获益。约15%的新诊断 MM 患者在来那度胺和地塞米松单药治疗或与 AHCT 联合治疗的较长时间内表现良好。通过一些现代联合治疗,或可确定在初始治疗约1年后多年表现良好的患者子集。第三,需要确定是否可以根据缓解调整治疗,以便达到 MRD 阴性的患者可以安全地停止治疗,从而提供改善的价值和QOL。
确保MM临床试验中代表性不足组的多样性和代表性
在临床试验中,人种和少数民族 MM 患者的代表性通常不足。在美国,估计约20%的 MM 患者为非裔美国人,但该患者组在临床试验中的比例在5%-8%之间,在导致药物批准的关键试验中更低。因此,需要了解这些药物在不同患者组中的疗效和毒性。例如,非裔患者和西班牙裔美国患者的细胞因子释放综合征和神经毒性发生率存在差异。因此,临床试验团队应确保材料的设计能够由不同的人群阅读和支持,医疗保健提供者接受了解文化敏感性护理的培训,团队应包括多样性官员。已经提出了消除 MM 治疗使用中人种差异的建议,包括批准前和批准后临床试验,以及与患者和行业观点相关的建议。临床试验申办者现在意识到此类建议,因此对行业有积极影响。最终,对 MM 治疗差异的更好理解应转化为临床试验设计,以帮助指导适当的治疗选择,并确保对所有人都有公平的治疗。
参考文献
Malard F,et al. Multiple myeloma.Nat Rev Dis Primers . 2024 Jun 27;10(1):45. doi: 10.1038/s41572-024-00529-7.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#多发性骨髓瘤# #流行病学# #骨髓微环境#
3