论文解读|Yang Liu/Pan Zheng教授团队揭示创新型RNA递送平台在癌症治疗中的前景
2024-03-25 Genes and Diseases Genes and Diseases
这项研究展示了一个新型的递送平台,它使用镁来形成纳米颗粒,实现了有针对性、高效和安全的RNA递送,对乳腺癌的潜在治疗效益也得到了证明。

RNA干扰(RNAi)已成为一种强大的工具,能沉默疾病相关基因,具有治疗疾病的潜力。然而将RNA治疗剂输送到细胞中是一个巨大的挑战,因为它会遇到诸如快速降解、非靶向传递、细胞摄取有限和炎症反应等问题。
美国马里兰大学的Yang Liu/Pan Zheng教授团队在本刊发表了题为“A novel aptamer-based small RNA delivery platform and its application to cancer therapy”的研究论文,揭示了创新型RNA递送平台在癌症治疗中的前景。
1.递送平台的设计
作者团队的递送平台可以成功地将miR-26a递送到靶细胞中,并使其靶基因在体外和体内沉默。该平台包括一个引导链RNA序列、一个与DNA适配体连接的过客链序列,以及一个与胆固醇连接的过客链,产生一种两亲性结构,可能形成以胆固醇为核心的胶束状颗粒。
2.镁在颗粒形成中的作用及其递送效率
然而,寡核苷酸的负电荷使自组装变得具有挑战性。作者团队又在平台中加入氯化镁增强了胶束的形成,表现为胶束形成的荧光强度在加入1 mM的氯化镁后急剧增加。颗粒可视化显示其为直径20–40纳米的球形物体。由镁诱导的纳米颗粒能有效地将miR-26a递送到靶细胞,并沉默Ezh2基因的表达(图1)。
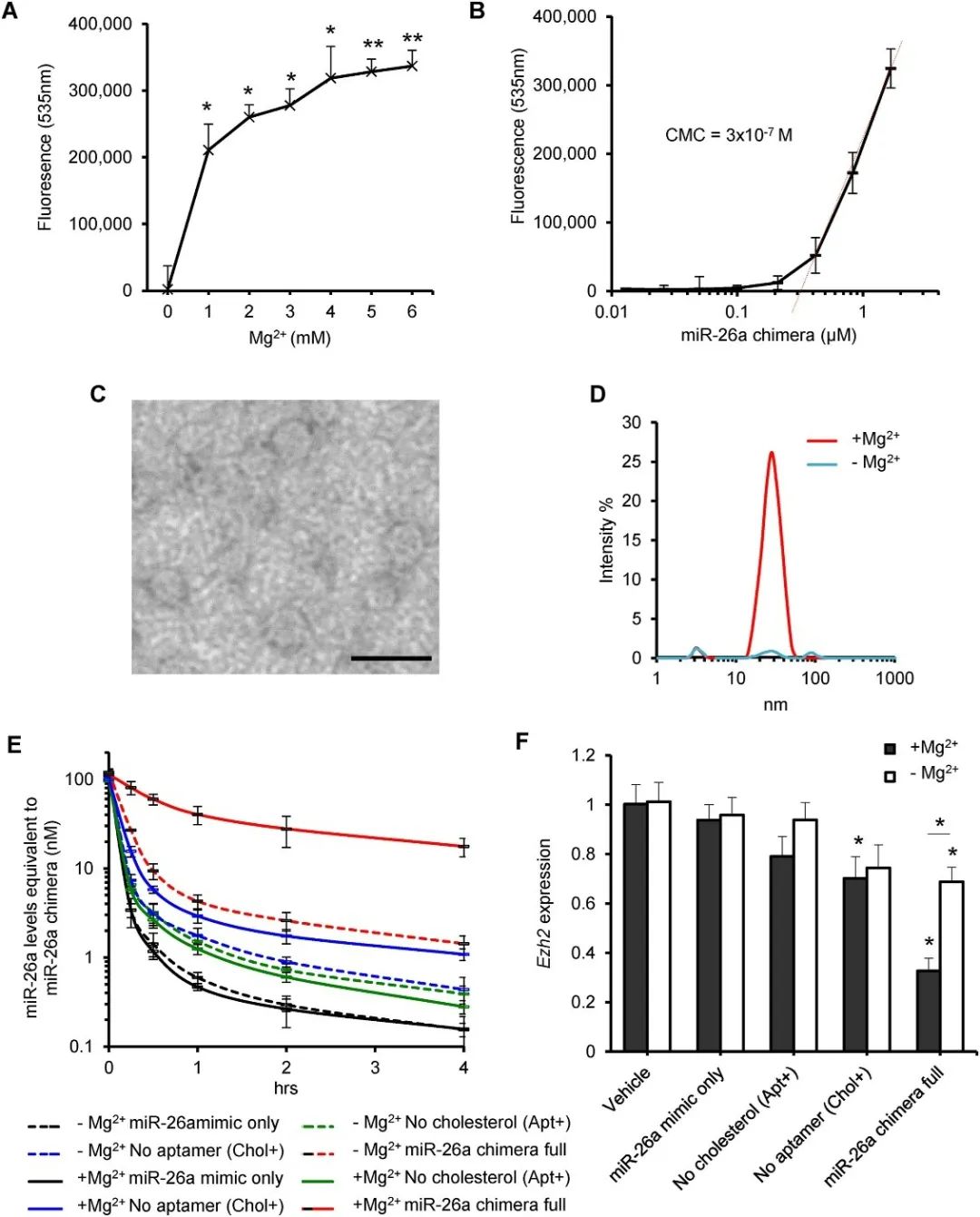
图1 镁诱导纳米颗粒组装,增强其抗降解性和miRNA功能
3.纳米颗粒的特异性及其与细胞的相互作用
由镁诱导的纳米颗粒保持了其靶标特异性。纳米颗粒与靶细胞结合后,通过内吞作用被摄取到细胞内。随后,纳米颗粒在胞内体或溶酶体的酸性环境中被破坏,携带的miR-26a被释放到细胞中。分解的纳米颗粒释放出的胆固醇和镁,可能会诱导胞内体渗漏,但并未引起细胞毒性(图2)。
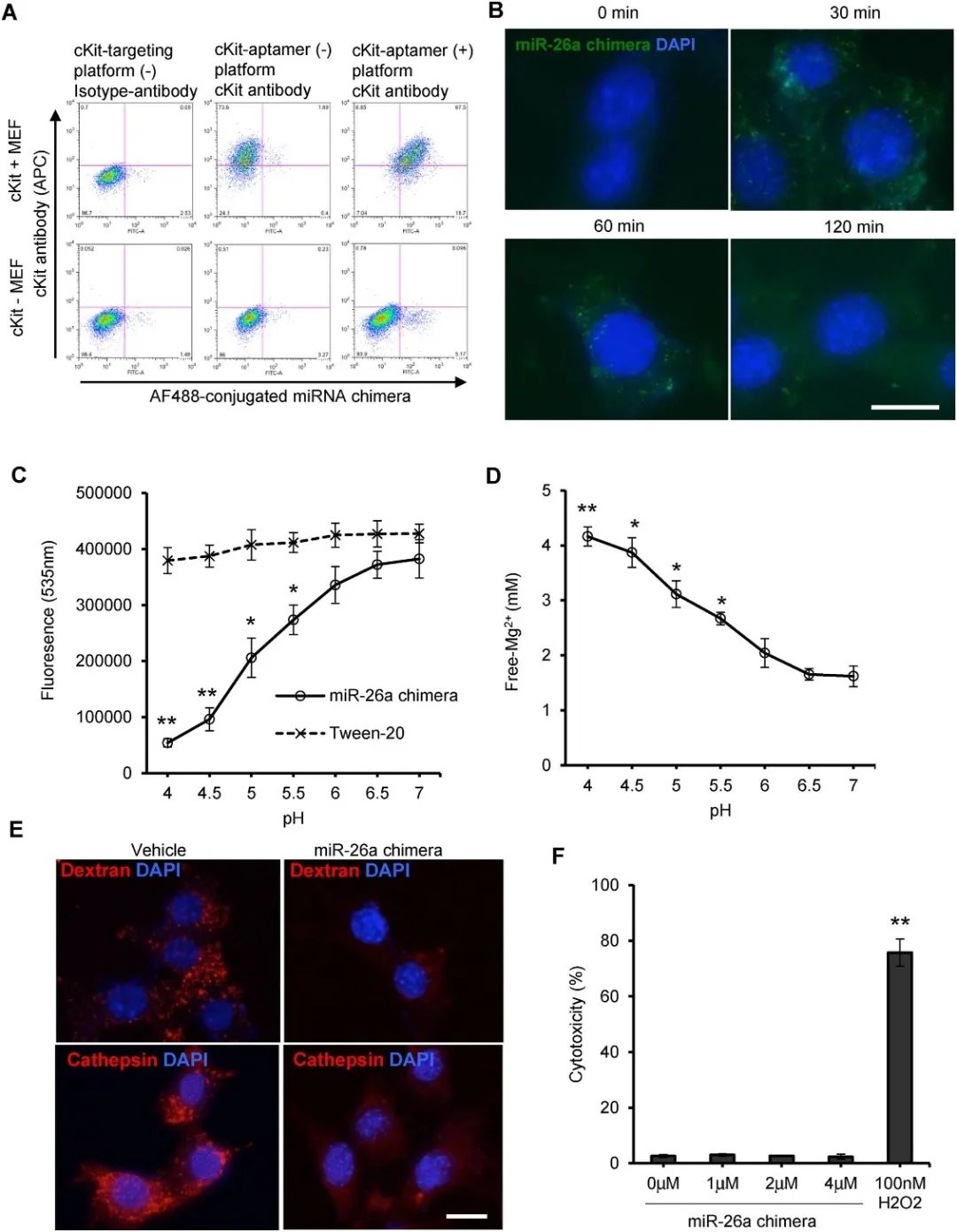
图2 pH敏感的递送平台会诱导胞内体渗漏,但不会引起细胞毒性
4.寡核苷酸的化学修饰
为提高RNA寡核苷酸在体内的稳定性,作者团队通过特定的化学基团对RNA寡核苷酸进行修饰优化。结果显示,轻度修饰对于递送平台更为有效。聚乙二醇(PEG)联合轻度修饰(light_PEG)不影响RNA寡核苷酸的效率,延长了RNA寡核苷酸的半衰期,并减少了炎症反应(图3)。
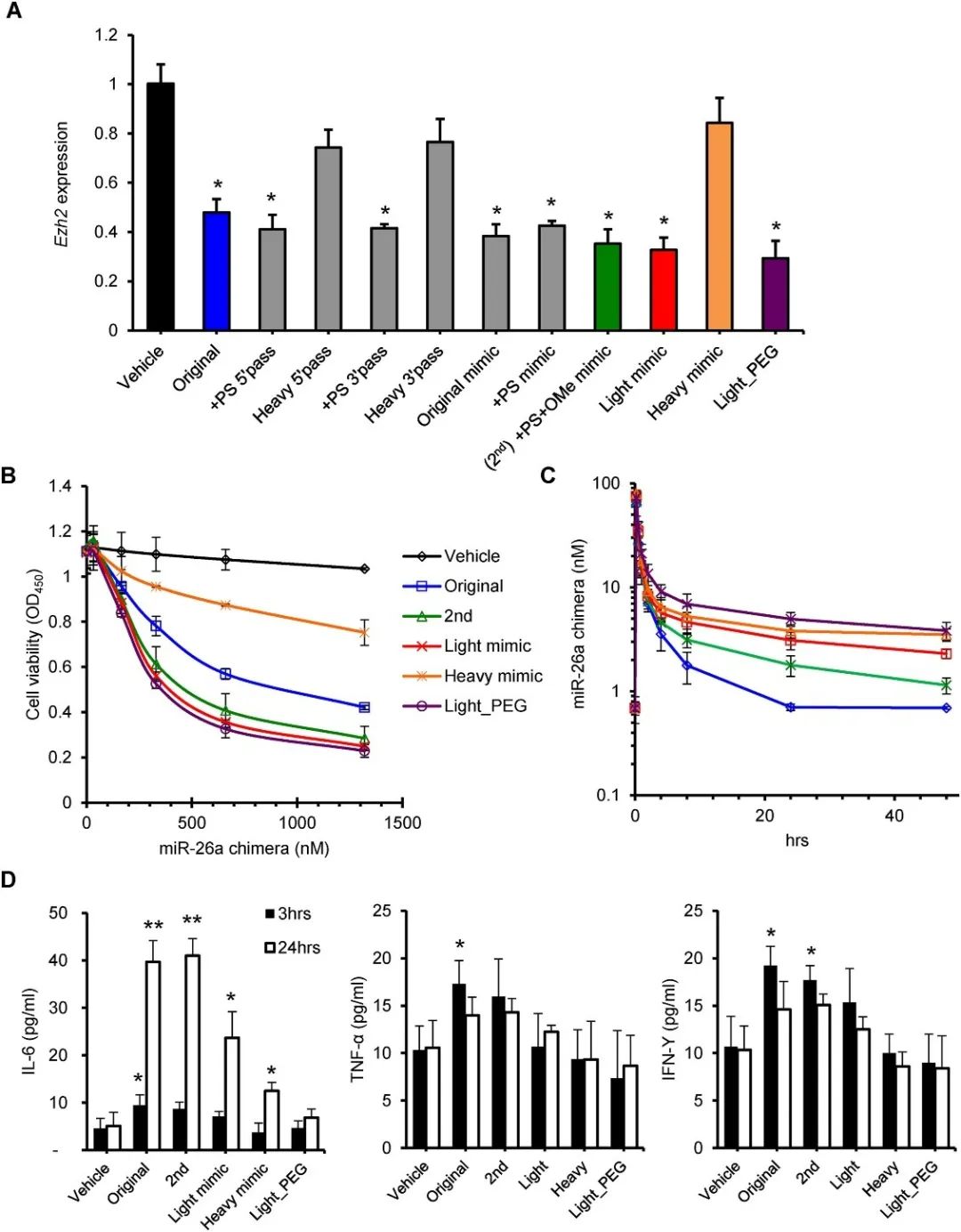
图3 体外miRNA递送平台上化学修饰的优化
5.递送平台的体内安全性
在小鼠中的安全性评估显示,miR-26a嵌合体的light_PEG形式不会改变血液参数,不会引起体重改变或器官异常,表明其安全性(图4)。
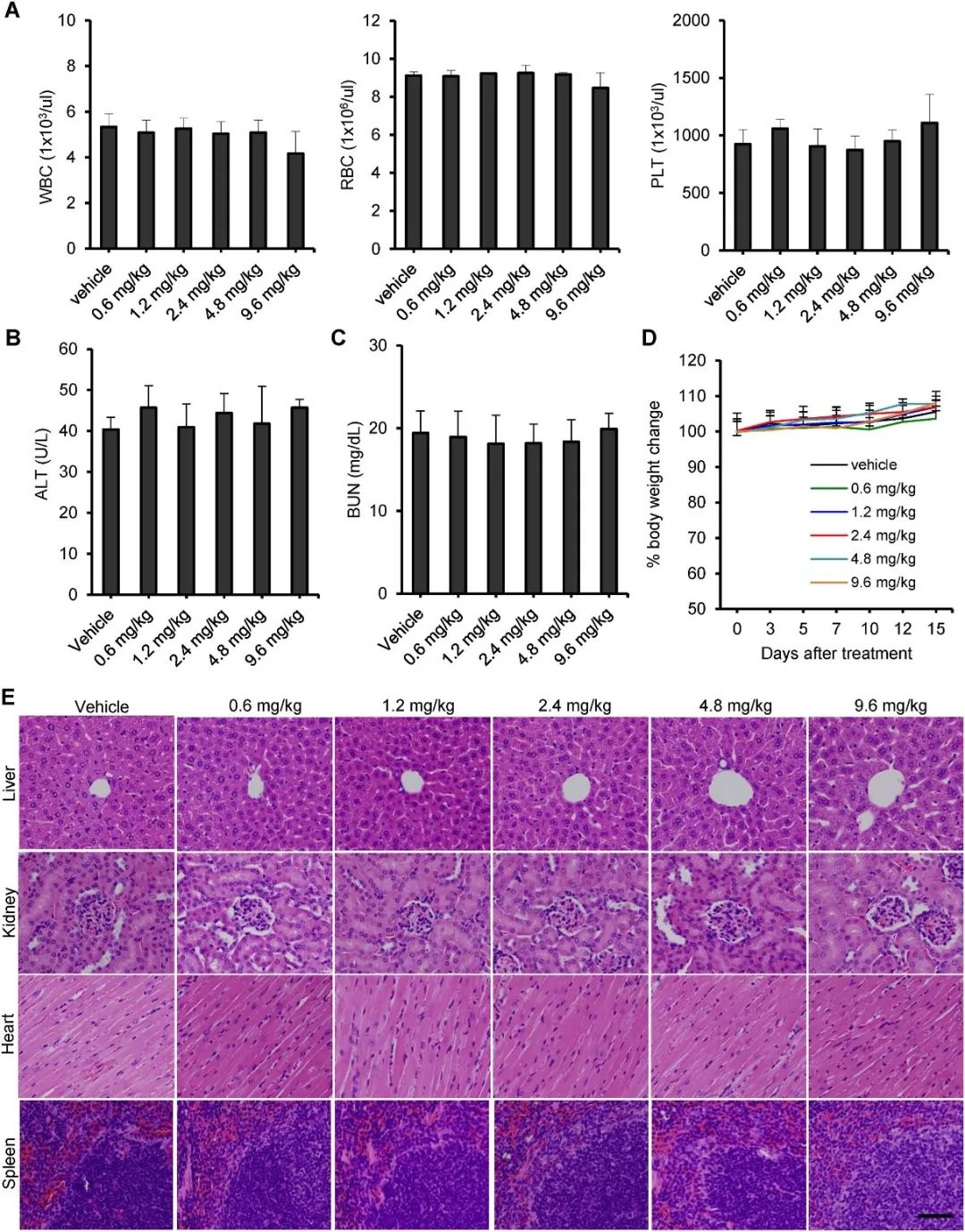
图4 小鼠体内最有效的miR-26a嵌合体的安全性
6.对乳腺癌具有有效治疗作用的miRNA纳米颗粒
作者团队进一步在小鼠乳腺癌模型中验证miR-26a嵌合体在体内的靶向能力以及治疗潜力,发现miR-26a嵌合体增加了肿瘤中T细胞的浸润(图5)。
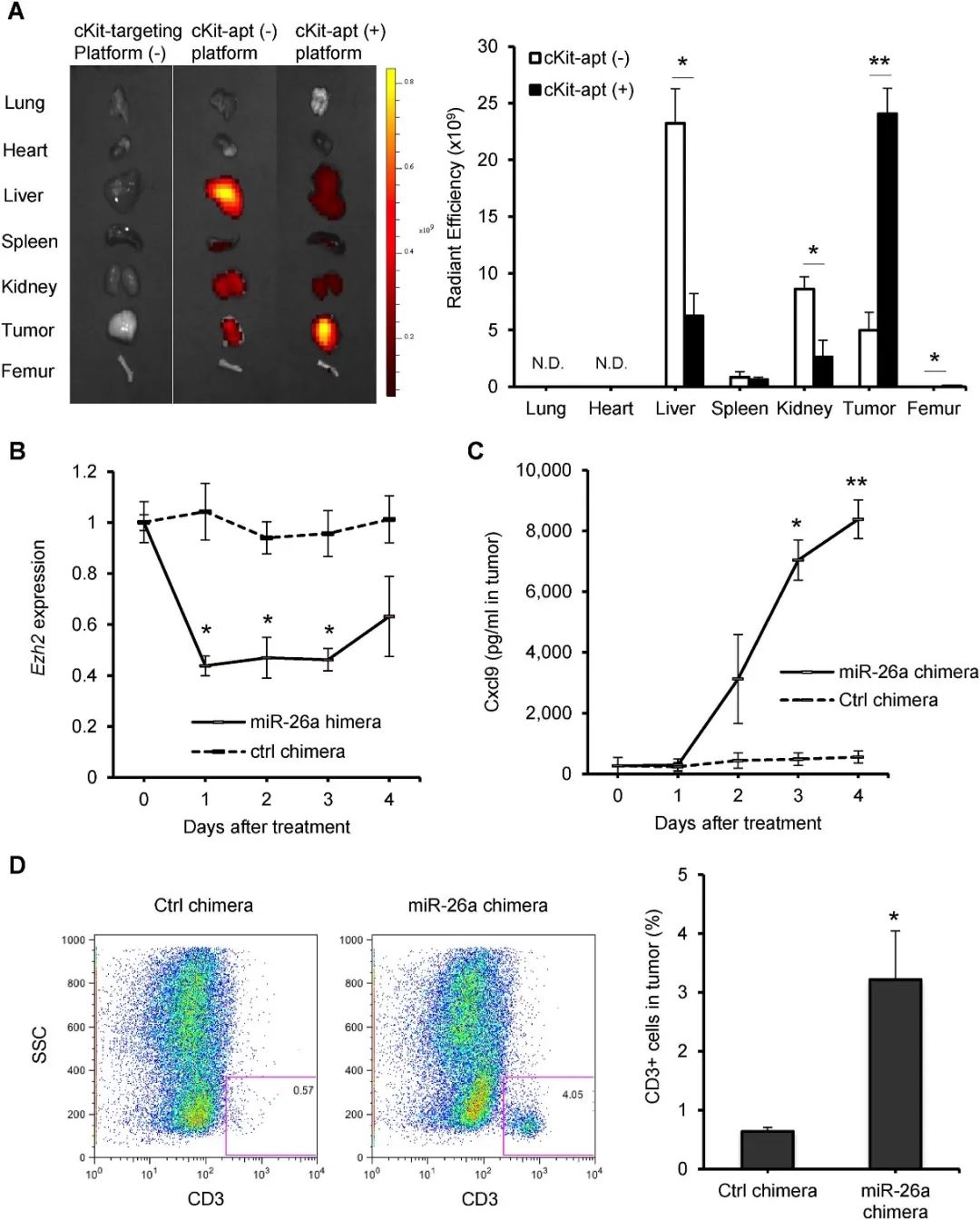
图5 miR-26a嵌合体增加了肿瘤中T细胞的浸润
为了测试miR-26a嵌合体在改善免疫治疗作用方面的潜力,作者团队用miR-26a嵌合体和/或抗CTLA4抗体去处理小鼠乳腺癌模型,发现二者组合的治疗效果比单独使用更佳(图6)。
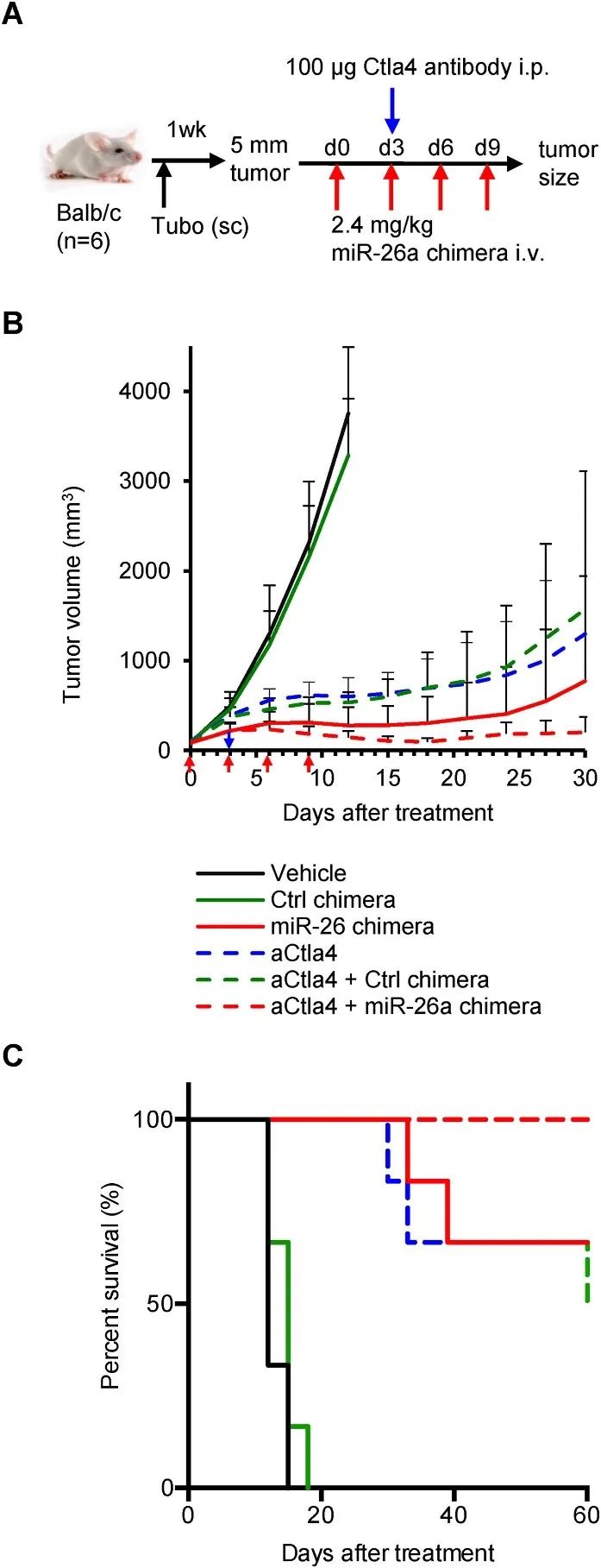
图6 miR-26a嵌合体抑制了乳腺癌的生长并增加小鼠的存活率
总之,这项研究展示了一个新型的递送平台,它使用镁来形成纳米颗粒,实现了有针对性、高效和安全的RNA递送,对乳腺癌的潜在治疗效益也得到了证明。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304222001386
引用这篇文章:
Tanno T, Zhang P, Bailey C, et al. A novel aptamer-based small RNA delivery platform and its application to cancer therapy. Genes Dis. 2023;10(3):1075-1089.
作者:Genes and Diseases
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#乳腺癌# #RNA递送平台#
59