谁在掌控睡眠时间?Nature揭示调控小鼠睡眠时间的关键分子通路
2022-12-08 北京生命科学研究所 北京生命科学研究所
这项研究或许可以帮助我们理解和解决睡眠缺陷与睡眠疾病的问题,进一步促进人类探索高质量睡眠、构建良好的生活状态。
你能做到一周不睡觉吗?良好的睡眠对我们保证生活质量十分重要。不过,有些人每天只需睡4-6个小时,有些人则需要8个小时(可能还不够),这是什么原因导致的?
其实,这也是很多科学家好奇的问题,最近,研究人员在小鼠身上发现了调控睡眠时间的通路机制,揭示了其中的答案。
在我们的生命活动过程中,睡眠不可或缺,它在学习、记忆、运动、代谢和免疫等过程中发挥着重要作用1-3。睡眠行为也保守存在于鸟类、章鱼、水螅等其他动物中4。然而,不同动物的睡眠时长却有着巨大差异,比如长颈鹿每天只需要2-5小时的睡眠5,而考拉需要18-22小时6。
有趣的是,同种动物中不同个体的睡眠时间也不尽相同。人类通常每天需要7-8小时睡眠,而有一些人是天生短睡眠者,他们只需要4-6小时睡眠,就能保持正常工作生活7。目前,调控睡眠时间的分子机制还不清楚。
2022年12月8日,北京生命科学研究所/清华大学生物医学交叉研究院刘清华实验室,与日本国际综合睡眠医学研究所的Masashi Yanagisawa/Hiromasa Funato实验室,在 Nature 背靠背发表了一篇题为“A signaling pathway for transcriptional regulation of sleep amount in mice”的研究论文。
这项研究揭示了调控小鼠睡眠时间的核心分子通路——LKB1-SIK3-HDAC4/5-CREB,并提出了转录调控睡眠的新机制。
这个实验要从2016年讲起,当时,Yanagisawa/Funato实验室在小鼠的正向遗传学筛选中发现了一个“嗜睡”突变体,该突变体中Sik3的点突变造成外显子13的跳读,编码了功能获得性SLEEPY突变蛋白8,从而使小鼠每天睡眠时间增加4-5个小时。刘清华实验室和Yanagisawa/Funato实验室的研究以SIK3为突破口,揭示了一条调控睡眠时间的关键分子通路。
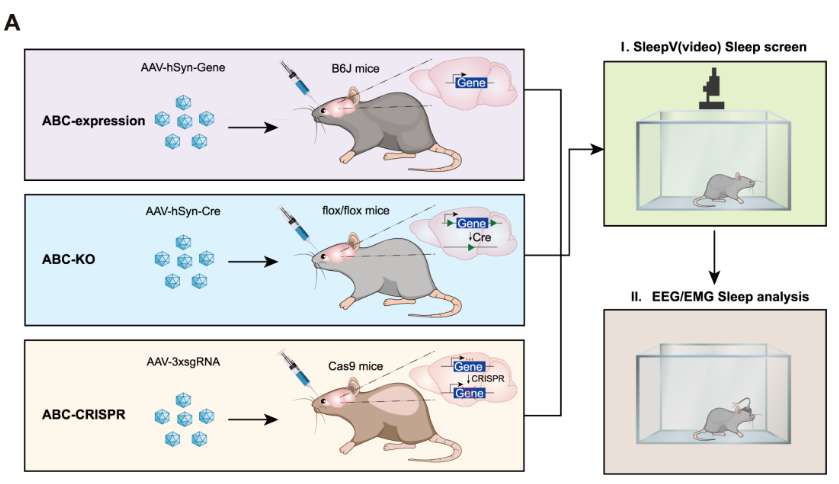
图1 成年小鼠脑细胞特异性基因表达及敲除系统
此前,刘清华实验室建立了小鼠睡眠体细胞遗传学研究的新方法:通过在小鼠中眼眶静脉注射腺相关病毒(adeno-associated virus),实现成年脑嵌合基因表达或敲除(Adult Brain Chimeric-expression/knockout),继而通过视频记录(SleepV)或脑电图/肌电图(EEG/EMG)记录来分析小鼠的睡眠情况(图1)9。
这个系统的优势在于,它极大程度地缩短了小鼠交配时间,将原本需要1-2年才能完成的小鼠交配和睡眠分析,缩减到了1-2个月内,让小鼠遗传分析像果蝇遗传分析一样方便快捷。
此外,这个系统能实现基因的快速表达或敲除,也能避免小鼠发育缺陷,因而突破传统遗传学局限,适于冗余基因和必需基因的睡眠表型分析。
由于SIK3相关分子通路中的基因都是必需基因,所以本研究充分应用这个系统的优势,进行小鼠睡眠的体细胞遗传分析。
研究者发现,在成年小鼠中敲除SIK3的上游激酶LKB1后,小鼠睡眠时间减少了3小时以上,这说明LKB1也是促进睡眠的蛋白激酶。
同时,研究者观察到LKB1敲除大脑中SIK3的T221磷酸化水平下降,而在LKB1缺失小鼠中表达模拟T221被磷酸化,从而持续激活的SIK3-ST221E 或 SLP-ST221E部分重建了LKB1缺失小鼠的睡眠时间,说明LKB1-SIK3激酶级联促进睡眠。
与此相一致的是,研究者也在LKB1敲除大脑中观察到SIK3下游转录调节因子,组蛋白去乙酰化酶HDAC4/5的S245磷酸化水平下降和核质比升高。干扰LKB1缺失小鼠神经元中HDAC4/5的转录活性发现其睡眠时间减少的表型被完全回复,而在小鼠神经元中表达持续位于核中的HDAC4/5CN或敲除Hdac4/5分别减少或增加小鼠睡眠时间,说明HDAC4/5位于LKB1下游,是抑制睡眠的转录调节因子。进一步研究发现HDAC4/5对睡眠的调控作用依赖于对去乙酰化复合体NCoR/SMRT-HDAC3的募集。
立体定位注射结果表明,HDAC4/5在下丘脑后部调控睡眠时间,但并非位于已知调节睡眠/觉醒的VLPO脑区,而可能在全新的调控睡眠/觉醒脑区发挥功能。此外,研究者还发现HDAC4/5的S245磷酸化水平随着黑暗期小鼠觉醒时间的积累或睡眠需求的上升而上升,随着光照期小鼠睡眠时间的积累或睡眠需求的下降而下降,这个现象暗示了反馈调节机制的存在。
HDAC4/5不直接结合DNA,而需要结合其他转录因子来发挥转录调节功能10。研究者通过筛选发现了另一与HDAC4/5相关的转录因子CREB也能抑制睡眠。在HDAC4CN表达小鼠神经元中干扰CREB的转录活性,发现HDAC4对睡眠时间的调控作用依赖于CREB。
同时,转录组分析和ChIP-seq分析发现,HDAC4和CREB可能结合在相同靶基因的同一位置,并且同向调控其转录水平,这一结果与HDAC4和CREB在睡眠调控中扮演的角色相一致。进一步地,在Sleepy小鼠中表达HDAC4CN或CREB均能回补其嗜睡表型,同时也能回复其转录变化,这说明HDAC4和CREB位于LKB1-SIK3下游调控睡眠时间。
研究团队的这一系列工作,首次揭示LKB1-SIK3-HDAC4/5-CREB是调控睡眠时间的关键信号通路(图2),阐明了睡眠时间受转录调控的分子机制。
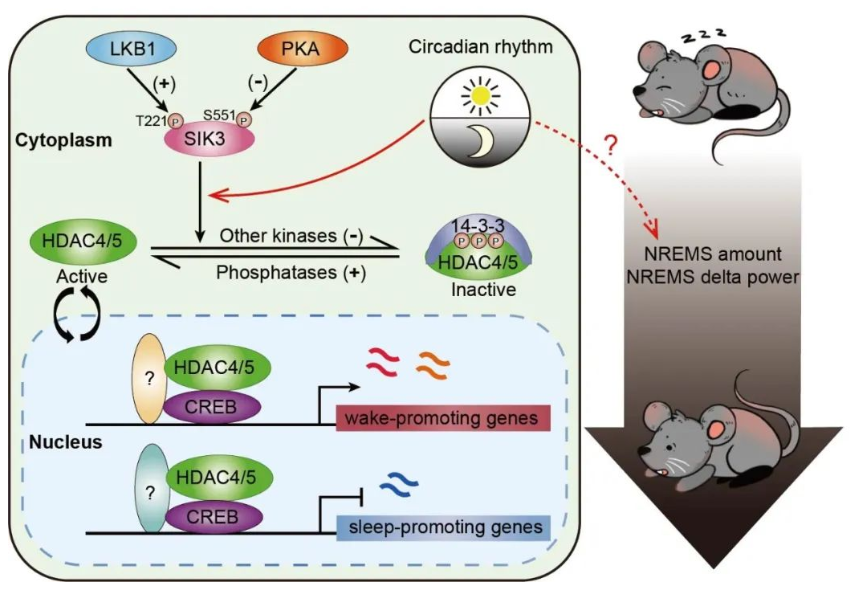
图2 睡眠调控的分子通路模型
在未来,这项研究或许可以帮助我们理解和解决睡眠缺陷与睡眠疾病的问题,进一步促进人类探索高质量睡眠、构建良好的生活状态。
刘清华实验室的博士研究生周瑞和王国栋为本论文的共同第一作者;刘清华博士为通讯作者;刘清华实验室的博士后李祺博士(现遗传筛选中心主任)、刘灿博士、孟凡熙和许俊杰等也对本研究做出重要贡献,我所的张二荃实验室、遗传筛选中心、核酸测序中心、生物信息中心、转基因动物中心和日本国际综合睡眠医学研究所的Hiromasa Funato教授和Masashi Yanagisawa院士也对本研究做出重要贡献。本研究在北京生命科学研究所完成,受到了北京市科学技术委员会的“前沿创新项目”和科技创新2030“脑科学与类脑研究”重大项目等的大力资助。
论文链接https://www.nature.com/articles/s41586-022-05510-6
作者:北京生命科学研究所
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言