Br J Haematol:吉瑞替尼联合方案治疗成人R/R FLT3突变AML的中国回顾性研究
2023-11-24 聊聊血液 聊聊血液
近日发表一项中国多中心回顾性研究,分析了吉瑞替尼联合HMA和/或维奈克拉及吉瑞替尼联合维奈克拉治疗 R/R FLT3 突变 AML 的临床有效性和安全性。
吉瑞替尼联合方案治疗FLT3突变AML
急性髓系白血病(AML)患者中约30%携带FLT3突变,包括FLT3-ITD和FLT3-KTD,患者预后既往较差。已有多种 FLT3 酪氨酸激酶抑制剂 (TKI)开发用于治疗 FLT3 突变AML,其中吉瑞替尼单药治疗R/R FLT3 突变 AML 患者的研究中,证实总生存期(OS)和CR+CRh(完全缓解 [CR] + CR伴部分血液学恢复 [CRh])率优于挽救性化疗。
但FLT3抑制剂单药治疗的疗效有限,深度或持久缓解率较低;达到 CR 的患者通常在数周至数月内出现耐药和复发,原因是出现 FLT3 耐药突变或其他通路激活,需要将 FLT3 抑制剂联合其他抗白血病药物使用。FLT3抑制剂联合去甲基化药物(HMA)或其他靶向药物证实有协同效应,可在 R/R FLT3 突变 AML 患者中诱导更早、更深的缓解和更持久的反应。
《British Journal of Haematology》近日发表一项中国多中心回顾性研究,分析了吉瑞替尼联合HMA和/或维奈克拉及吉瑞替尼联合维奈克拉治疗 R/R FLT3 突变 AML 的临床有效性和安全性,通讯作者为浙江大学医学院附属第一医院金洁教授和王华锋教授。

研究结果
该多中心、回顾性分析纳入2020年6月至2023年4月接受吉瑞替尼为基础三联治疗(吉瑞替尼+HMA和维奈克拉,G+HMA+VEN)或双联治疗(吉瑞替尼+HMA,G+HMA;吉瑞替尼+维奈克拉,G+VEN)的既往≥1线治疗失败的成人FLT3突变R/R AML(原发性)患者。
患者特征
共纳入33例患者,其中18例接受G+HMA+VEN治疗,11例接受G+HMA治疗,另4例接受G+VEN治疗。各组基线特征见表1。
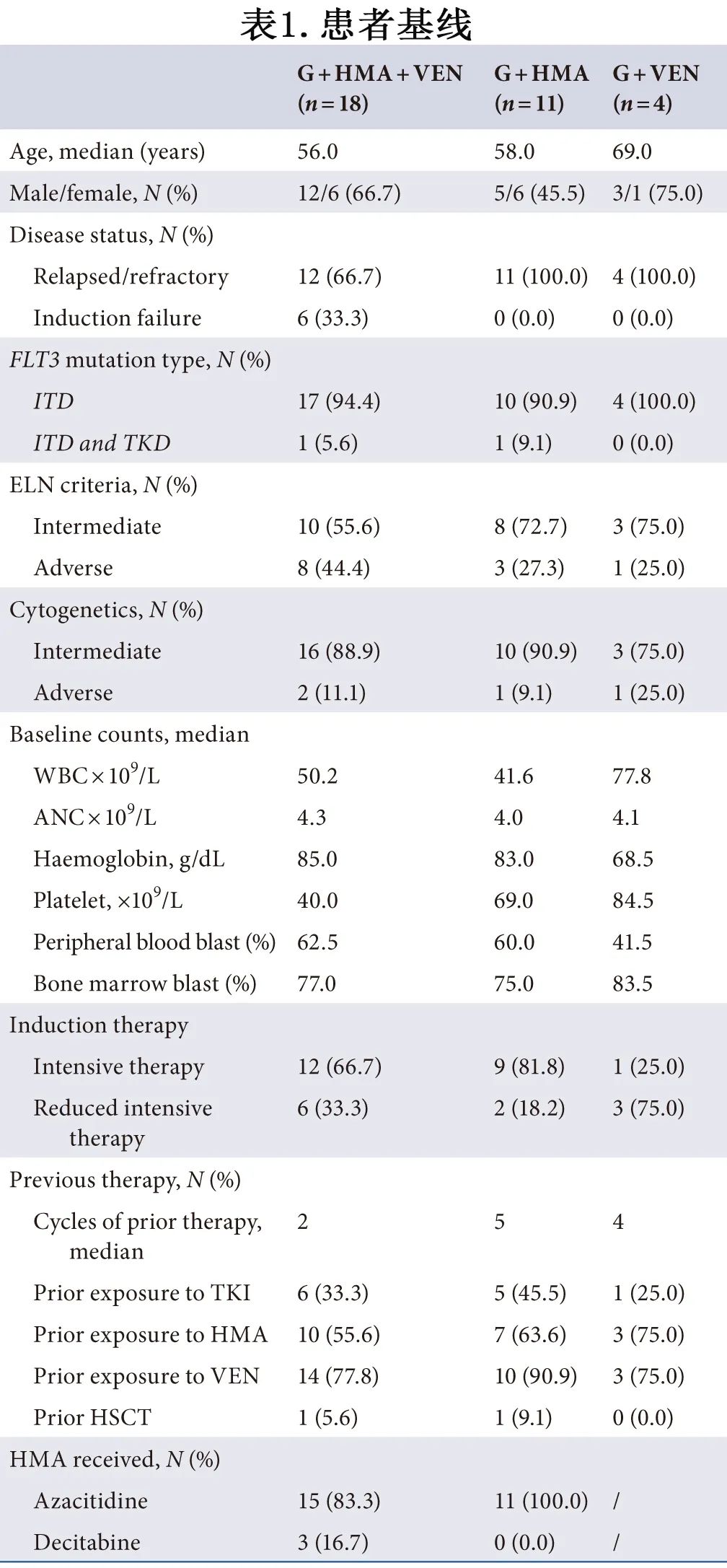
所有复发患者均经骨髓检查证实血液学复发。G+HMA+VEN组12例为R/R,其余6例为诱导治疗1个周期失败;G+HMA或G+VEN组所有患者均为R/R。除2例患者为FLT3-ITD/TKD 双重突变外,大多数患者均为FLT3-ITD 突变。诊断时的中位年龄分别为56.0(G+HMA+VEN)、58.0(G+HMA)和69.0(G+VEN)岁。根据2023年 NCCN 指南,分别有2例 (11.1%,G+HMA+VEN)、1例 (9.1%,G+HMA) 和1例 (25.0%,G+VEN) 具有不良细胞遗传学特征;根据 2022 ELN 标准,分别有8例 (44.4%)、3例 (27.3%) 和1例 (25.0%)为高危;诊断时中位基线白细胞 (WBC) 计数为50.2 × 109/L、41.6 × 109/L和77.8 × 109/L,骨髓原始细胞中位百分比为77.0%、75.0%和83.5%。
由于年龄、并发症或个人意愿,并非所有患者均接受强化化疗 (IC) 作为诱导化疗,部分患者接受减低强度化疗 (RIC),G+HMA+VEN、G+HMA和G+VEN组分别有12例 (66.7%)、9例 (81.8%) 和1例 (25.0%) 患者接受 IC 作为诱导化疗,其他患者接受RIC。既往治疗的中位次数分别为2、5和4。大多数患者曾既往暴露于维奈克拉(14/18[77.8%],G+HMA+VEN;10/11[90.9%],G+HMA;3/4[75.0%],G+VEN);至于HMA,分别有10例患者 (55.6%)、7例患者 (63.6%) 和3例患者 (75.0%) 既往暴露;对于TKI,6例患者 (33.3%)、5例患者 (45.5%) 和1例患者 (25.0%) 既往暴露。有2例患者在既往alloHSCT 后复发;1例患者接受G+HMA+VEN治疗,另1例患者接受G+HMA治疗。
反应
患者的治疗反应总结见表2,更多详细信息见图1。
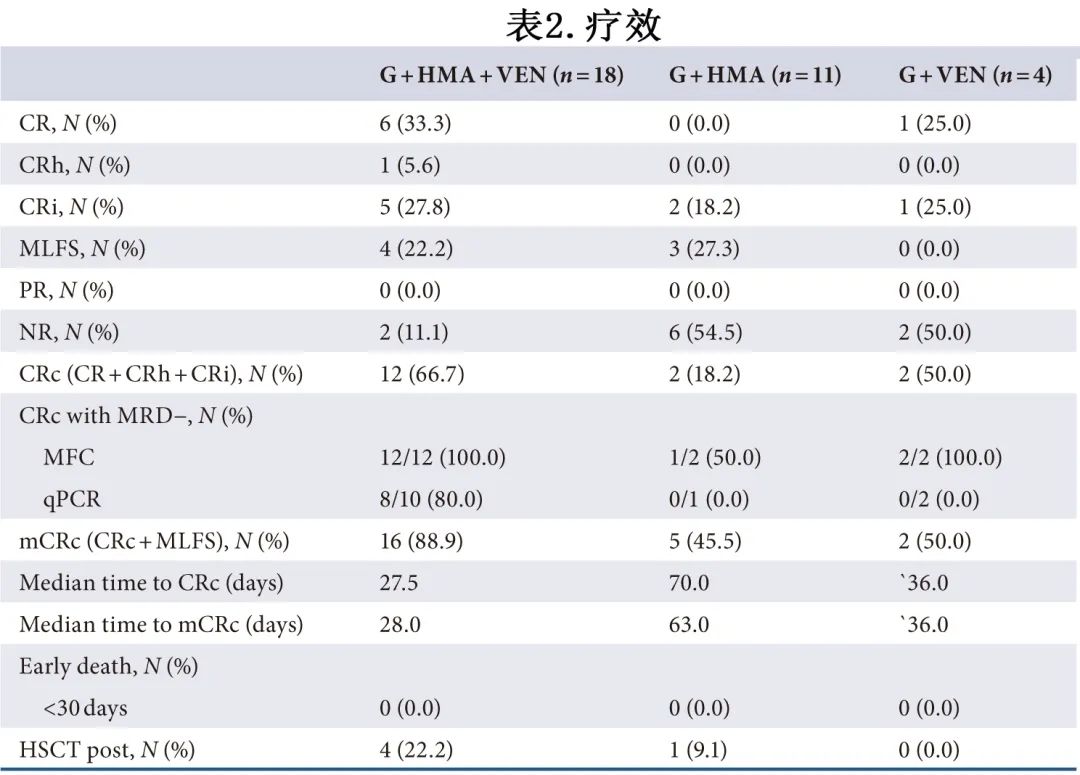
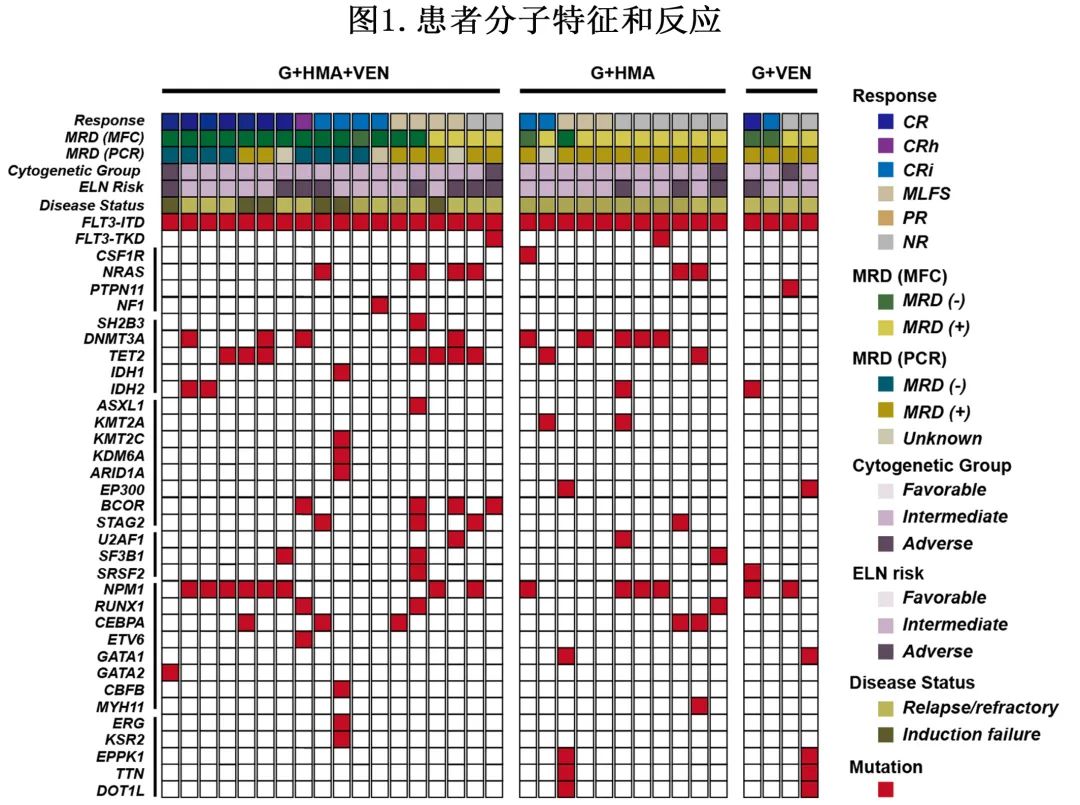
在所有33例患者中,16例患者 (48.5%) 达到复合完全缓解(CRc,CR+CRh+CRi),23例患者 (69.7%) 达到改良CRc(mCRc,(CR+CRh+CRi+MLFS)。在亚组分析中,G+HMA+VEN、G+HMA和G+VEN组的患者CRc率分别为66.7% (12/18)、18.2%(2/11) 和50.0%(2/4),mCRc 为88.9%(16/18)、45.5%(5/11)和50.0%(2/4)(图2)。G+HMA+VEN组的 CRc 和 mCRc 率高于G+HMA组 (CRc,p=0.030;mCRc,p=0.033),但G+HMA+VEN和G+VEN组之间无统计学差异 (CRc,p=0.799;mCRc,p=0.244)。
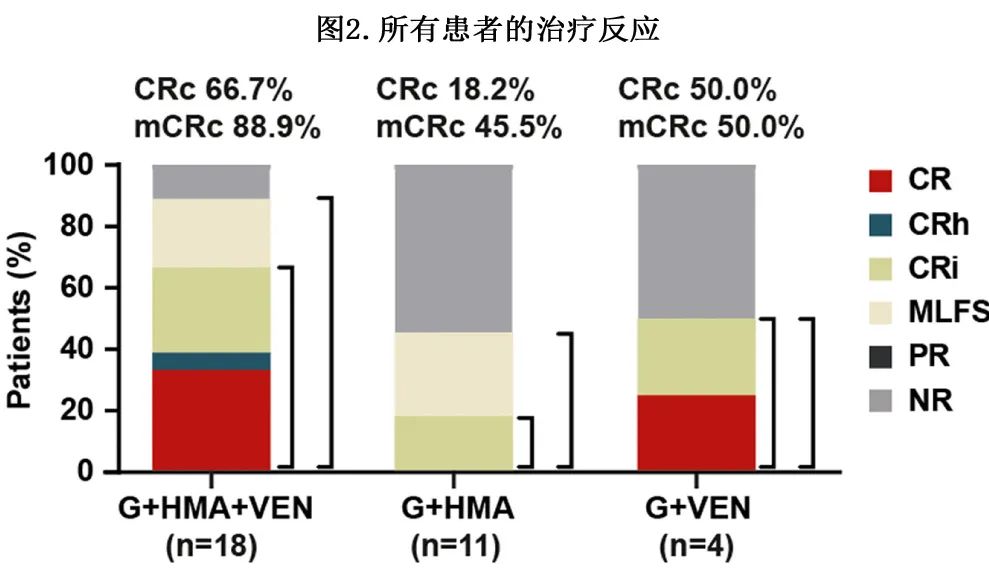
G+HMA+VEN、G+HMA和G+VEN组的中位至 CRc 时间分别为27.5天、70.0天和36.0天,中位至 mCRc 时间分别为28.0天、63.0天和36.0天。此外,G+HMA+VEN组中 MRD 阴性伴 CRc 的比例 (MFC-MRD:100.0%;Mol-MRD:80.0%) 高于G+HMA组 (50.0%;0.0%) 和G+VEN组 (100%;50%)。值得注意的是,1例 alloHSCT 后复发的患者在G+HMA+VEN治疗后仍获得CR;另一例 alloHSCT 后复发的患者在G+HMA治疗下无效。5例 (5/33,15.2%) 获得 CRc 的患者最终接受alloHSCT,包括G+HMA+VEN组4例(4/18,22.2%)和G+HMA组1例(1/11,9.1%)。整个队列中相对更常见的共突变包括NPM1(14/33)、DNMT3A(9/33)、TET2(9/33)、NRAS(6/33)、CEBPA(5/33)、BCOR(4/33)、STAG2(4/33)、IDH2(4/33)、RUNX1(3/33) 和SF3B1(3/33),其中NRAS(5/6,83.3%)、BCOR(3/4,75.0%) 和STAG2(3/4,75.0%) 的突变在未达到 CRc 的患者中相对富集(图1)。
接受吉瑞替尼联合治疗的所有患者的中位随访时间为224.0天,中位 OS 和 DOR 分别为353.0和159.0天。亚组分析中,G+HMA+VEN、G+HMA和G+VEN组患者的中位随访时间分别为214.0天、324.0天和224.0天,中位OS分别为未达到、160.0天和231.0天。G+HMA+VEN组中位 OS 与G+HMA组相比显著延长,但与G+VEN组无显著差异(G+HMA+VEN vs. G+HMA,HR=0.244,p=0.012;G+HMA+VEN vs. G+VEN,HR=0.440,p=0.484,图3A)。G+HMA+VEN、G+HMA和G+VEN亚组中位DOR分别为未达到、82.0天和77.0天(G+HMA+VEN vs. G+HMA,HR=0.358,p=0.072;G+HMA+VEN vs. G+VEN,HR=0.223,p=0.040,图3B)。当在 alloHSCT 时删失时,中位OS分别为未达到、131.0天和231.0天(G+HMA+VEN vs. G+HMA,HR=0.322,p=0.055;G+HMA+VEN vs. G+VEN,HR=0.631,p=0.590,图3C);中位 DOR 分别为159.0天、59.0天和77.0天(G+HMA+VEN vs. G+HMA,HR=0.285,p=0.090;G+HMA+VEN vs. G+VEN,HR 0.277,p=0.162,图3D)。这些结果表明,当在 alloHSCT 删失时,三组的中位 OS 和 DOR 相似。
小样本量可能限制组分析的统计学差异和确定性,因此作者进行了合并分析,包括分析三联治疗和双联治疗(G+HMA和G+VEN)之间的 OS 和DOR(图3E–H),以及G+VEN为基础的治疗(G+HMA+VEN和G+VEN)与G+HMA之间的 OS 和DOR(图3I–L)。结果显示,无论在终点时间删失(三联治疗 vs 双联治疗,HR=0.309,p=0.023,图3F)或alloHSCT时删失(HR=0.288,p=0.010,图3H),三联治疗观察到的 DOR 均长于双联治疗。同样,与G+HMA组相比,G+VEN为基础治疗的 OS 延长,无论在终点时间删失(基于G+VEN vs. G+HMA,HR=0.293,p=0.015,图3I)或alloHSCT时删失(HR=0.317,p=0.048,图3K);而对于DOR,G+VEN为基础治疗与G+HMA治疗之间在末次随访日删失的情况下无显著差异(HR=0.424,p=0.120,图3J),但当在 alloHSCT 删失时,G+VEN为基础组显示 DOR 延长(HR=0.336,p=0.035,图3L)。
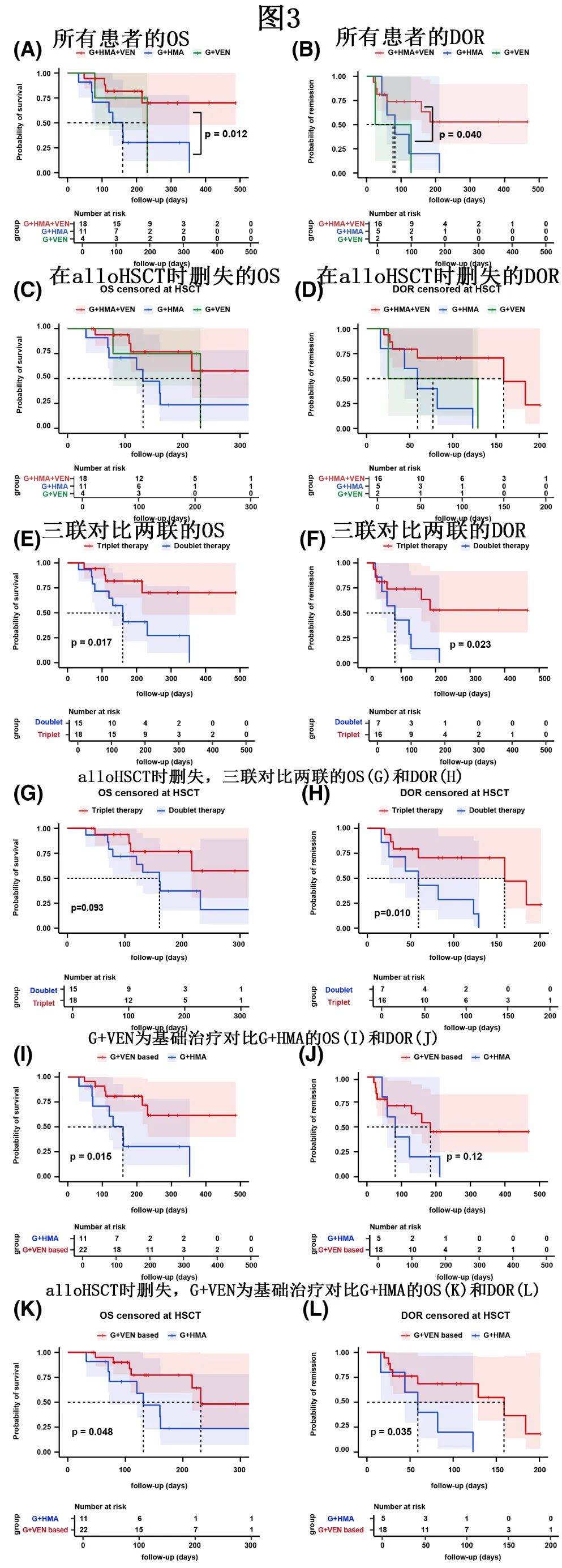
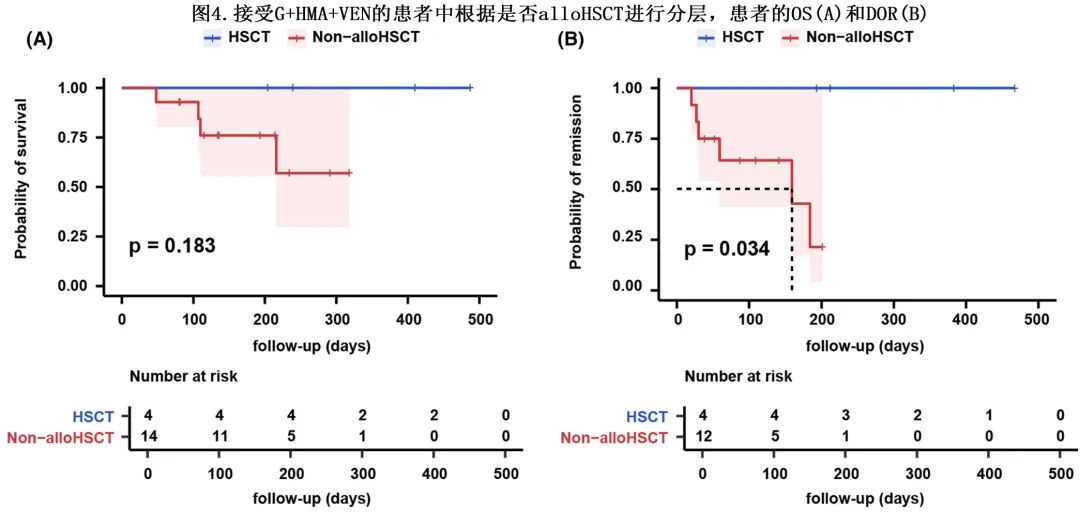
如上所述,G+HMA+VEN组有4例患者在缓解后接受alloHSCT。为了检测 alloHSCT 的临床意义,比较了G+HMA+VEN组按是否接受 alloHSCT 分层的中位 OS 和DOR。结果显示,alloHSCT组和非 alloHSCT 组均未达到中位OS,中位 OS 无显著差异(HR=0.229,p=0.183,图4A),但接受 alloHSCT 的患者的中位 DOR 显著延长(HR=0.154,p=0.034,图4B)。
不良事件
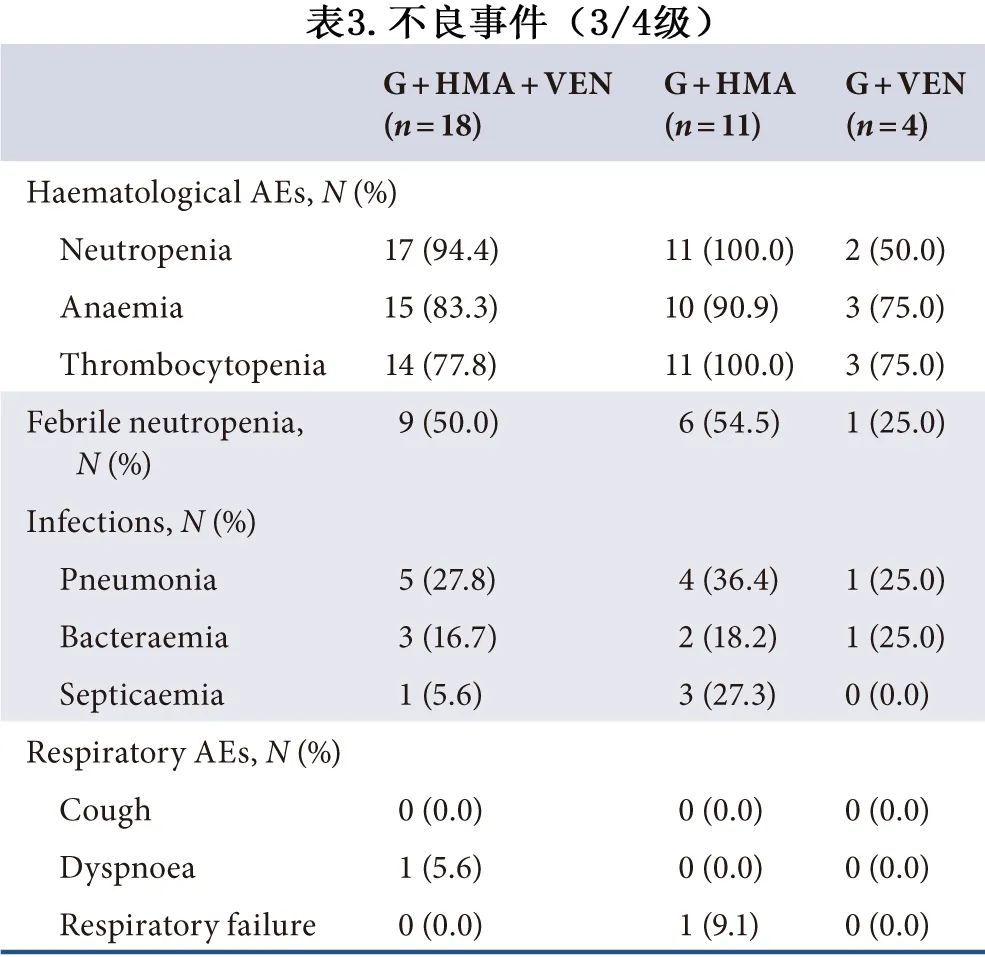
三组间均未观察到5级不良反应 (AE) 或肿瘤溶解。吉瑞替尼联合治疗的3/4级 AE 总结见表3,三个亚组间无显著差异。对于血液学不良反应,G+HMA+VEN、G+HMA和G+VEN组的3/4级中性粒细胞减少、贫血和血小板减少分别为94.4% vs. 100.0% vs. 50.0%;83.3% vs. 90.9% vs. 75.0%;和77.8% vs. 100.0% vs. 75.0%;分别有9例 (50.0%)、6例 (54.5%) 和1例患者(25.0%) 在接受治疗后发生发热性中性粒细胞减少。最常见的非血液学 AE 为肺部感染,共10例患者发生(G+HMA+VEN:n=5,27.8%;G+HMA:n=4,36.4%;G+VEN:n=1,25.0%)。
总结
作者回顾性分析了33例 R/R FLT3 突变 AML 患者接受吉瑞替尼为基础的不同联合治疗(G+HMA+VEN,G+HMA,G+VEN)的有效性和安全性。接受G+HMA+VEN患者的CRc和mCRc 率分别为66.7%(12/18)和88.9%(16/18),高于G+HMA(18.2%,2/11;45.5%,5/11) 或G+VEN(50.0%,2/4;50.0%,2/4)。G+HMA+VEN、G+HMA和G+VEN组中位OS分别为未达到、160.0天和231.0天,中位DOR分别为未达到、82.0天和77.0天。G+HMA+VEN组的4例患者在缓解后接受alloHSCT,显示中位 DOR 延长。最常见的3/4级不良事件为血细胞减少、发热性中性粒细胞减少和肺部感染;三组之间无差异。
总之,该研究数据表明,G+HMA+VEN联合治疗在 R/R FLT3 突变 AML 中具有良好的反应,或可作为移植的有效桥接治疗。应开展前瞻性随机研究,以进一步确定吉瑞替尼为基础的联合治疗的疗效。
参考文献
Chen N, Pan J,Zhou Y,et al.Gilteritinib-based combination therapy in adult relapsed/refractory FLT3-mutated acute myeloid leukaemia.Br J Haematol . 2023 Nov 8. doi: 10.1111/bjh.19182.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










实用,科学合理
57
#急性髓系白血病# #FLT3突变# #吉瑞替尼#
85