【ASH继续教育】改善AML患者强化诱导治疗的长期结局
2023-12-22 聊聊血液 聊聊血液
2023年ASH继续教育项目中,德国Christoph Röllig教授发表综述,阐述了改善强化诱导治疗AML的长期结局的策略。
AML的强化治疗
强化疗联合异基因造血细胞移植和支持治疗,可使适合强化治疗的急性髓系白血病(AML)患者中约50%获得长期缓解。在此基础上,已有多项优化治疗的研究致力于完善“7+3”方案的时间表和剂量,此外加上新型药物后,疗效和耐受性的增加也可改善长期结局。Fit的老年患者和高危遗传亚组患者结局不佳,从而提出了一个问题,即低强度的维奈克拉方案作为替代方案是否有获益。尽管具有诱惑力且值得探索,但在随机对照研究结果出现之前,这个问题仍存在争议。
迄今为止,在固定治疗时间内,强化疗仍是长期疾病根除的唯一治愈性治疗选择。随着更新型药物的出现以及微小残留病 (MRD) 检测和维持方法的进展,强化治疗也可能在许多方面发生变化,部分正在临床试验中进行探索:(1)1种以上新药联合强化方案,(2) 新药的头对头比较,(3) 细胞毒性组分(如蒽环类药物)的替代或剂量降低,(4)MRD引导的剂量递增和递减策略。强化治疗与个体化定制的创新策略相结合,定将减少治疗相关毒性并增加长期缓解的机会。
2023年ASH继续教育项目中,德国Christoph Röllig教授发表综述,阐述了改善强化诱导治疗AML的长期结局的策略。

案例1
在进行性虚弱2周后,67岁女性发生复发性鼻出血,并咨询全科医生。患者动脉高血压控制良好,且略微肥胖。除了全身苍白和脚踝周围瘀点外,实验室结果显示全血细胞减少。转诊至血液科医生后,骨髓检查显示45%髓系原始细胞,根据世界卫生组织 (WHO) 和国际共识分类 (ICC) 标准诊断为急性髓系白血病 (AML)。那么接下来怎么办?
案例2
一名70岁男性因发热和呼吸短促在急诊科就医,使用OCT药物自行治疗后仍未好转。患者存在轻微白细胞增多伴25%的非典型幼稚细胞、贫血和血小板减少。诊断检查显示AML。患者由于先天性单侧肾缺如只有一个肾,但其他方面健康。患者日常较为活跃,喜欢在花园里工作,并花大量时间与孙子一起做运动。该如何建议他?
先看看这名女性和这名男性应该接受强化疗的原因,然后再转向最佳方案和潜在的研究选择。
为什么fit患者应该使用强化疗?
在20世纪60年代之前,由于没有有效的细胞减灭术治疗选择,患者预期寿命仅有2-4个月。几十年前强化疗的出现导致相当多的 AML 患者治愈。在20世纪60年代末发现胞苷和柔红霉素即使单药也能最有效地诱导完全缓解。自20世纪80年代7+3方案确立后,fit患者的治愈率和预期寿命持续上升,主要原因为支持治疗和异基因造血细胞移植 (HCT) 技术的重大进展,以及细胞抑制药物的治疗优化(图1)。最近在年轻fit的 AML 患者中进行的不同基因亚组临床试验的数据显示,长期缓解率约为60%,而即使在继发性 AML 老年fit患者中,联合异基因 HCT也可达到50%的长期缓解。因此,基于成千上万患者的高证据,强化疗是最确定的治愈手段。
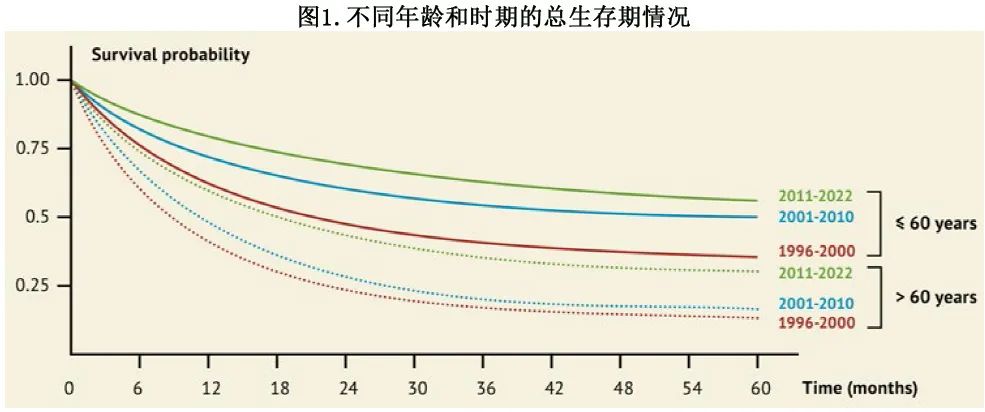
尽管强化治疗在年轻患者中更易于管理并带来更好的结果,但在fit的老年患者中强化疗的毒性增加和长期缓解更少导致对其价值的持续争论;然而许多论点也支持在该患者组中采用强化治疗。
1.在一线治疗中,没有其他治疗可获得比强化疗更好的长期缓解结果。
2.根据遗传风险,超过50%的老年患者可通过强化诱导联合缓解后治疗(包括异基因HCT)实现治愈。
3.在1-2个周期的强化诱导后,疾病根除和预后相关的 MRD 减少迅速且显著,60%-80%的患者实现 MRD 阴性,可在缓解后治疗前或异基因HCT 前提供更强的疾病控制。
4.在过去几十年中,由于更好的支持治疗,强化治疗的老年 AML 患者的早期死亡率持续下降。
5.强化疗多为时间限制性治疗,即患者可在几个月后无治疗。
基于这些论点,对上述病例进行强化诱导治疗。尽管没有普遍同意的fitness定义,但根据所有现有标准,两名患者均视为fit,相关标准通常包括体能状态、充分的终末器官功能、年龄和老年评估。假设患者或家属有医学背景,他们很可能疑惑细胞抑制药物和替代方案维奈克拉联合去甲基化药物 (HMA) 下的克隆性演变。然而,尽管临床前数据支持存在克隆演变和选择进程,但其对长期结局和持续治疗需求的临床影响尚不清楚。尽管对于无法耐受强化疗的患者,维奈克拉联合 HMA 意味着一个突出的飞跃,但其达到治愈甚至优于强化诱导的能力尚未在fit患者的前瞻性随机比较中得到证实,而回顾性分析容易出现围绕选择偏倚和统计匹配方法的相关问题,导致结果混杂和部分矛盾。
因此,虽然维奈克拉会在 AML 未来治疗中发挥作用,也可能在联合治疗中对fit患者发挥作用,但目前而言,HMA联合维奈克拉与强化治疗相比在fit患者中的价值尚未令人信服。
多项临床试验探索了 HMA 联合维奈克拉与标准强化疗相比的作用,见表1。此外,正在临床试验中探索替代使用维奈克拉来代替强化疗(见“AML强化疗的未来”章节和表2)。
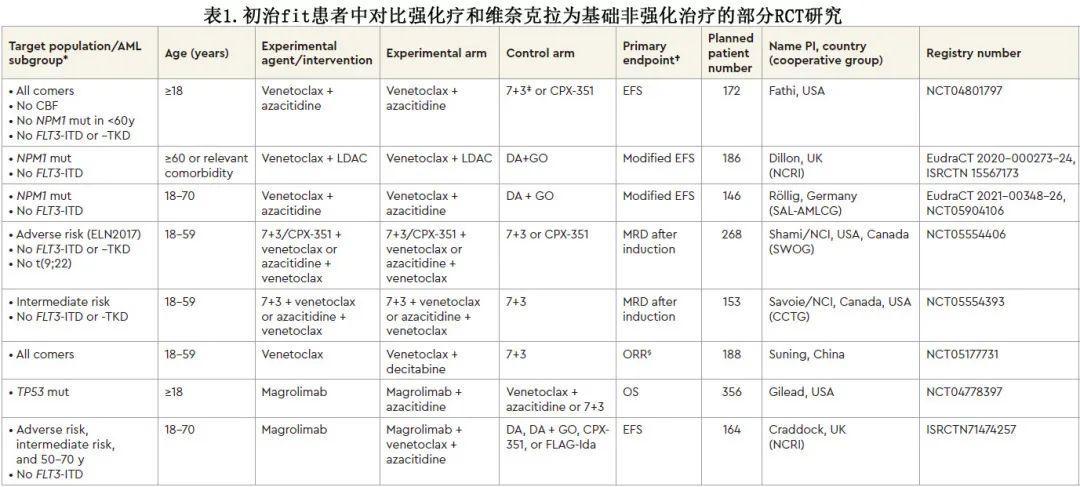
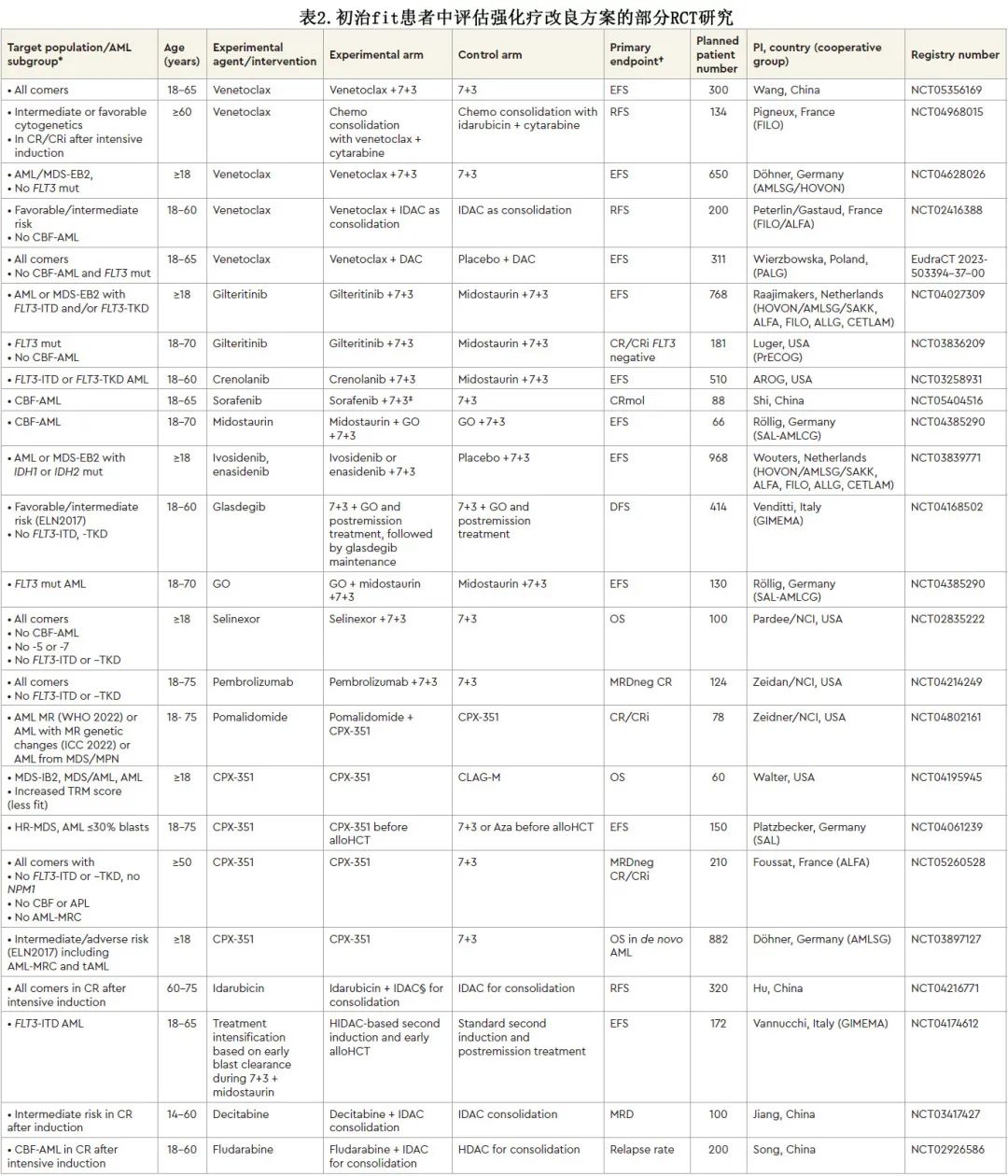
由于两个病例被论点说服并同意强化诱导,下面继续看一下关于其使用的信息,以及诱导过程中应该注意的内容。
如何使用强化诱导治疗
诱导治疗的一般问题
联合阿糖胞苷和蒽环类药物的方法有多种,7+3的变异较多。当正确使用这些组合时,它们应当产生相似的结果。以下几点具有普遍重要性:
阿糖胞苷的剂量和给药方案
随机比较表明,100和 200 mg 连续每日阿糖胞苷同样有效,但无证据表明7天、10天或5天是否更好。但证据最充分的是连续输注7天,因为其应用最广泛,也用于建立新药组合方案。与标准剂量相比,较高剂量的阿糖胞苷可产生更高的缓解率和更优的无复发生存期 (RFS),但未显示所有亚组中均对总生存期 (OS) 有长期获益。诱导治疗的时序分裂(Time-sequential splitting,具体研究见于doi: 10.1038/s41375-018-0268-9)可缩短重度白细胞减少时间,但其抗白血病疗效并不明显优于标准诱导。基于该数据,作者在临床实践中使用 100-200 mg/m2 阿糖胞苷连续输注7天。
蒽环类药物类型、剂量和给药方案
作为应用最久的蒽环类药物,柔红霉素的经验和数据最稳健,但根据随机比较,蒽环类药物伊达比星和蒽醌米托蒽醌同样有效。吖啶衍生物m-amsacrine在诱导治疗中缺乏令人信服的随机证据,即使在心功能受损的患者中也是如此。为降低心脏毒性风险,应将约 500 mg/m2柔红霉素当量的累积剂量阈值或既存心功能不全视为蒽环类药物使用的相对禁忌。无比较表明在第1-3天相对于第3-5天给药更有效。柔红霉素的最佳剂量一直是随机对照试验 (RCT) 的主题,但基于3项随机化试验,90 mg/m2比 45 mg/m2更有效,2项随机化研究显示60 mg/m2与 90 mg/m2同样有效。NCRIAML17 研究显示在 FLT3-ITD 突变患者中 90 mg 的显著获益,但在 DaunoDouble 研究中无法重现,可能是由于 FLT3 抑制剂midostaurin在后者部分使用所致。考虑到这些结果,建议3天给予 60 mg/m2柔红霉素,或者如果无法获得,将伊达比星 12 mg/m2作为替代方案。
其他非靶向药物
业内已经进行多次尝试,通过添加第三种细胞抑制药物来提高阿糖胞苷-蒽环类双联药物的疗效。硫鸟嘌呤历来是多种诱导治疗方案的一部分,但从未在随机比较中评估其潜在的额外获益。加用氟达拉滨未改善新诊断患者的预后,它是大剂量阿糖胞苷为基础的复发方案 FLAG-Ida 的一部分,也用于 MRCAML15 和 NCRI-AML19 研究的一线治疗,显示复发率低但血液毒性较高,也表明在某些形式的继发性 AML 和 NPM1-FLT3 突变的 AML 中,不使用midostaurin的生存疗效高于阿糖胞苷加柔红霉素。但由于氟达拉滨是 FLAG-Ida 的固定组分,其额外的细胞减灭作用无法与其他组分明确分离。在波兰 PALG 研究中,克拉屈滨可将完全缓解 (CR) 率从56%增加至68%,导致克拉屈滨组的 RFS 相似,但 OS 显著延长。在60岁以上老年患者中进行的一项类似研究显示,60-65岁年龄亚组的 CR 显著改善,核型低危和中危患者的 OS 改善,但在整个研究人群中未改善。一项在无高危细胞遗传学的老年患者中开展的法国 RCT 显示,当lomustin联合化疗骨干治疗时(包括诱导、低剂量阿糖胞苷加伊达比星巩固治疗,和6个周期低剂量阿糖胞苷加伊达比星再诱导,以及 6-MP 和 MTX 维持治疗),OS显著长于不使用lomustin。在标准诱导治疗的基础上加用氯法拉滨可显著缩短至 CR 时间和降低复发风险,但由于 CR 率相似和毒性增加,OS与单独标准诱导治疗相似,但ELN 2010 中危患者除外(其生存期显著延长)。检测全反式维甲酸 (ATRA) 联合强化疗的研究结果具有异质性。在1项老年 AML 患者研究获得显著的生存获益,而在年轻患者中开展的另一项RCT 显示,符合方案人群的 OS 改善,但整个意向治疗人群未改善;但另外2项随机研究未显示 ATRA 的获益。最后但同样重要的是,尝试通过添加依托泊苷或通过粒细胞集落刺激因子启动白血病原始细胞来改善白血病结局的研究并不成功。
诱导治疗周期数
欧洲20世纪80年代引入年轻 AML 患者的两药诱导治疗,并确定标准化剂量强度,且不会因缓解评估而导致治疗延迟。对诱导周期1早期缓解良好的患者进行的随机比较显示,单药与双药诱导的 CR 率或生存期无相关差异。对于第1周期7+3未缓解的fit患者,应考虑使用含较高剂量阿糖胞苷的治疗方案。
患者亚组的特定改良
随着新型靶向药物的开发和批准,全面的治疗前诊断变得非常重要,最好在5~7天内获得。在临床稳定的患者中(正如前述的2例患者),等待诊断结果数天并不会对预后产生负面影响,而 AML 相关并发症,即白细胞淤滞、肿瘤溶解综合征或弥散性血管内凝血,必须立即开始特定治疗。
如果初诊显示CBF-AML、NPM1突变 AML 或 FLT3 突变AML,可以为患者提供一种获批的7+3骨架联合新型特异性药物,而如果是治疗相关或骨髓增生异常相关 AML,则提供柔红霉素和阿糖胞苷 CPX-351 的脂质体制剂,而非7+3。治疗方案见图2。
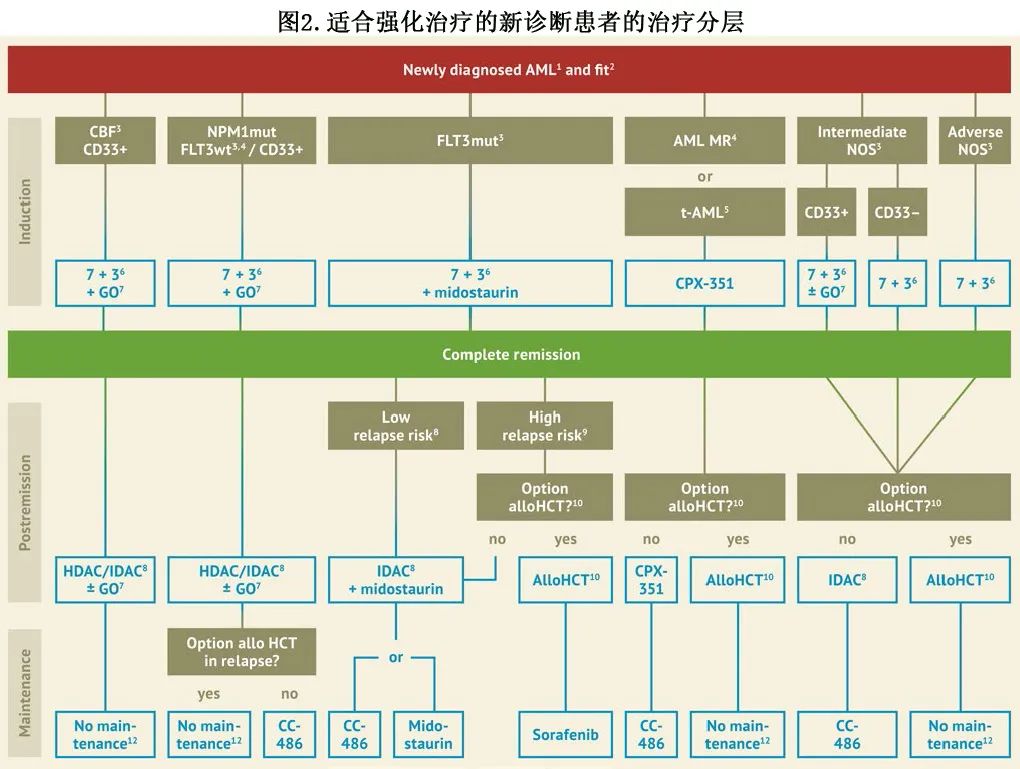
关于新型药物的最新数据和开放性问题,包括第二代TKI quizartinib、NPM1 突变和老年 AML 患者中使用gemtuzumab以及 CPX-351 和 FLAG-Ida 在继发性突变中的价值。
Quizartinib是第二代 II 型TKI,对KIT 和 FLT3-ITD 突变具有高特异性,但对 FLT3-TKD 突变细胞无活性。随机对照 QuANTUM-First 研究纳入539例18-75岁 FLT3-ITD 突变新诊断 AML 患者,在标准诱导和化疗巩固治疗的基础上加用quizartinib或安慰剂,并在化疗巩固或异基因HCT 后维持治疗36个周期。虽然缓解和无事件生存期 (EFS) 相似,但quizartinib可显著延长RFS(中位数39.3个月vs 13.6个月,风险比 [HR]=0.61)和OS(中位数31.9个月vs 15.1个月,HR=0.78),且毒性特征与安慰剂相似。与midostaurin的关键研究 (RATIFY) 不同,QuANTUM-First研究也入组了≥60岁的患者,维持治疗是36个周期而非12个周期,也允许在异基因 HCT 后给药。该研究结果无法与midostaurin进行直接比较,但在18-59岁的年轻患者亚组中,FLT3-ITD患者的 OS HR 约为0.80(RATIFY),而 QuANTUM-First 为0.68(RATIFY),表明quizartinib的疗效至少相当,甚至更高。
Gemtuzumab ozogamicin (GO) 可作为CBF-AML 患者的公认标准治疗,其基于 ALFA-0701 研究的结果和5项随机试验的荟萃分析,在该亚组中显示出相当大的生存期延长,而在中危患者中获益作用较小,而在高危患者中则无获益。AMLSG-0909 研究表明,NPM1突变患者在强化疗的基础上加用 GO 也可获益,GO 单剂量给药即可加深分子学缓解,随后显著延长RFS。GO 与四联化疗基础药物 (ICE+ATRA) 联用时毒性增加,导致≥70岁患者的早期死亡率升高,EFS曲线出现早期交叉。亚组分析显示,18-60岁患者有显著的 EFS 获益,而60-69岁患者有 OS 和 EFS 延长的趋势。NCRI-AML18 研究在柔红霉素和阿糖胞苷 (DA) 诱导治疗中加用1剂或2剂GO,结果显示,在接受异基因 HCT 作为缓解后治疗的患者中,2个周期相对比1个周期后的 MRD 阴性率更高,OS也有获益;但在≥70岁非高危患者中未观察到获益。尽管 GO 的研究设计和数据具有相当大的异质性,但这些研究证实,其在非高危患者中可增加缓解深度、证明存在剂量-反应关系以及限制在≥70岁患者中使用该药物。
CPX-351的关键研究入组继发性 AML 或 MDS 样改变的老年患者,显示CPX-351 与7+3相比可显著改善 OS,此后CPX-351的获批适应症与 AML-MRC 的 WHO 分类相关。尽管从 CPX-351 的定义和治疗适应症中消除诊断时作为 MDS 相关性定义标准的多系发育异常是显而易见的,因为缺乏预后意义和研究代表性,CPX351在继发性突变(STM:ASXL1,BCOR,EZH2,RUNX1,SF3B1,SRSF2、STAG2、U2AF1、ZRSR2)患者中的价值不太清楚。回顾性分析表明,超过40%的新定义 MDS 相关性类别患者仅由 STM 突变定义。CPX-351 关键研究的事后分析显示,在 STM 患者中,CPX-351与7+3相比具有相似的缓解率和更长的生存期趋势,而在 TP53 突变患者中未观察到获益。在 CPX-351 治疗患者中进行的一项小型回顾性法国分析显示,STM患者的 OS 优于其他AML。最后,在年轻fit AML 患者中比较 FLAG-Ida 诱导与 CPX-351 的 NCRI AML19 研究的事后分析显示,对于一小组 STM 且无高危细胞遗传学或 TP53 突变的患者,CPX-351治疗后的生存期显著长于7+3。
前文67岁女性患者首次骨髓穿刺确定 AML 诊断后第二天,基于 RNA 的基因结果揭示了RUNX1::RUNX1T1融合转录本,从而确立了 WHO 和 ICC 对复发性基因异常 AML 的诊断,并根据当前 ELN 标准将患者归类为低危险。后来在经典染色体分析中发现的+8等其他遗传畸变,未改变预后组。根据上述证据,推荐使用标准强化诱导治疗+GO。第15天的早期骨髓评估显示原始粒细胞为3%,第30天确认CR。基于风险-获益考虑,建议患者接受3个周期的中剂量阿糖胞苷缓解后化疗。通过这种治疗,可以预期长期缓解概率在40%左右。如果认为这是非 APL AML 最佳预后组的结局,则很明显仍有相当大的改善空间,包括在风险“良好”的患者中,但在所有其他风险组中更是如此。
前文70岁男性患者的基于 PCR 的突变筛查显示 NPM1 和 FLT3-ITD 的等位基因比率为0.4,使其处于 ELN 2022 中危,因此在7+3诱导中添加midostaurin。由于担心免疫抑制下的肾功能及患者偏好,选择化疗巩固联合midostaurin代替异基因 HCT 作为缓解后治疗,然后CC-486(口服阿扎胞苷)维持治疗。
AML强化疗的未来
作者整理强化疗作为治愈性治疗标准的证据,并审查了联合标准化疗或替代标准化疗的获批新型药物。然而,由于即使是低危患者也不意味着90%~100%的治愈率,因此显然需要进一步制定该标准。在强化治疗背景下仍存在几个开放性问题,包括基于fitness与基因组学的强化治疗资格、MRD指导治疗的价值、异基因HCT 的优化选择、维持治疗和标准化疗的联合药物(图3)。以7+3作为标准基础,有几项正在进行的研究:(1) 检验单药治疗联合7+3或 CPX-351 的可行性,(2) 头对头比较新型药物联合治疗, (3) 探索1种以上新型药物与标准强化治疗可能组合的许多排列。
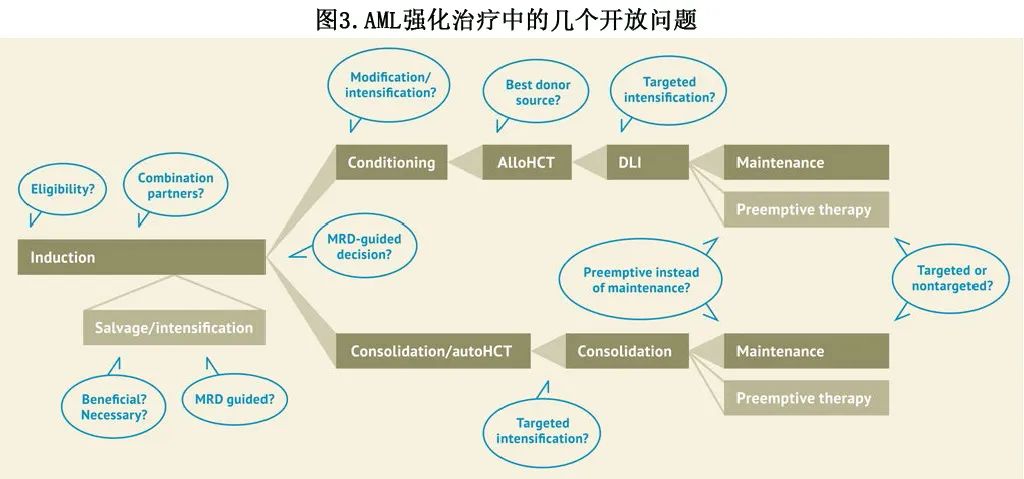
关于目前在随机试验中评价的处于临床后期的强化方案,包括强化治疗标准7+3联合亚组特异性靶向药物,或联合在不同亚组中均可起作用的药物(表2)。
普遍性非靶向方案
脂质体与传统7+3:因为CPX-351 的关键研究重点关注老年患者人群中的 tAML 和sAML,AMLSG 30-18研究正在评估脂质体药物与标准7+3诱导相比在具有中危和高危年轻患者中的价值。
维奈克拉:同样,AMLSG31-19/HOVON 501/AbbVie B18-982 研究纳入新诊断的患者,无论其基因特征如何,维奈克拉或安慰剂均与标准强化疗联合治疗。
靶向方案
在基因定义的 AML 亚组中探索了多种选择性抑制细胞通路的新型药物联合强化疗。第一步通常是检验1种新型药物与安慰剂相比联合强化疗的可行性和疗效。目前评价的新型药物包括IDH 抑制剂 ivosidenib 和enasidenib、menin 抑制剂、XPO1抑制剂塞利尼索、PD1检查点抑制剂帕博利珠单抗或免疫调节剂泊马度胺。
一旦确立疗效,强化疗还可联合其他获批时间更长的新型药物,但除了额外获益,过度的血液学毒性仍是需要回答的最紧迫的开放问题;后者的案例包括在强化标准治疗的基础上联合midostaurin和 GO。
第三种对比研究模式是在两项 RCT 中头对头比较两种新型药物,如第一代与第二代 FLT3 抑制剂midostaurin和吉瑞替尼,以及第二代 FLT3 抑制剂 crenolanib 与midostaurin。
AML 治疗演变的长期目标必须是通过给予强化和利用强化疗来提高长期治愈率,以通过减少剂量或替代特别有毒的成分(如蒽环类药物)来降低毒性并增加耐受性,并使用标准化和精炼的 MRD 技术进一步个体化治疗强度。
尽管案例中的67岁女性患者属于“低危”风险组,但有罕见的 CBF 融合转录,长期治愈率仅在30%到50%左右,因此可从新的选择中受益,应该提供临床试验。基于 KIT 在 CBF-AML 中经常过度表达或突变,而midostaurin是一种 KIT 抑制剂,因此GO联合midostaurin将是一种选择。案例中的70岁NPM1/FLT3-ITD AML患者可以给予临床试验,例如比较midostaurin与第二代 TKI 吉瑞替尼或 crenolanib ,或midostaurin联合GO的试验。
总结
所有fit患者长期缓解的几率约为50%,先接受强化化疗,然后适合移植患者进行异基因干细胞移植,可提供最大的治愈机会,并为进一步临床开发和fit患者治疗优化奠定基础。
与更多新型药物联合使用以及 MRD 检测和维持治疗的进步,可提高缓解率、在缓解后的治疗前加深缓解质量并预防复发,以便在未来治愈更多患者。
参考文献
Röllig C.Improving long-term outcomes with intensive induction chemotherapy for patients with AML. . 2023 Dec 8;2023(1):175-185.
作者:聊聊血液
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#急性髓系白血病# #强化诱导#
61