9月13日,辉瑞公司首席执行官Albert Bourla表示,辉瑞公司与BioNTech SE合作开发的疫苗BNT162b2有望在年底之前提供给美国民众,且该公司正在为这种情况做准备,回应了卫生部门相对谨慎的预期。
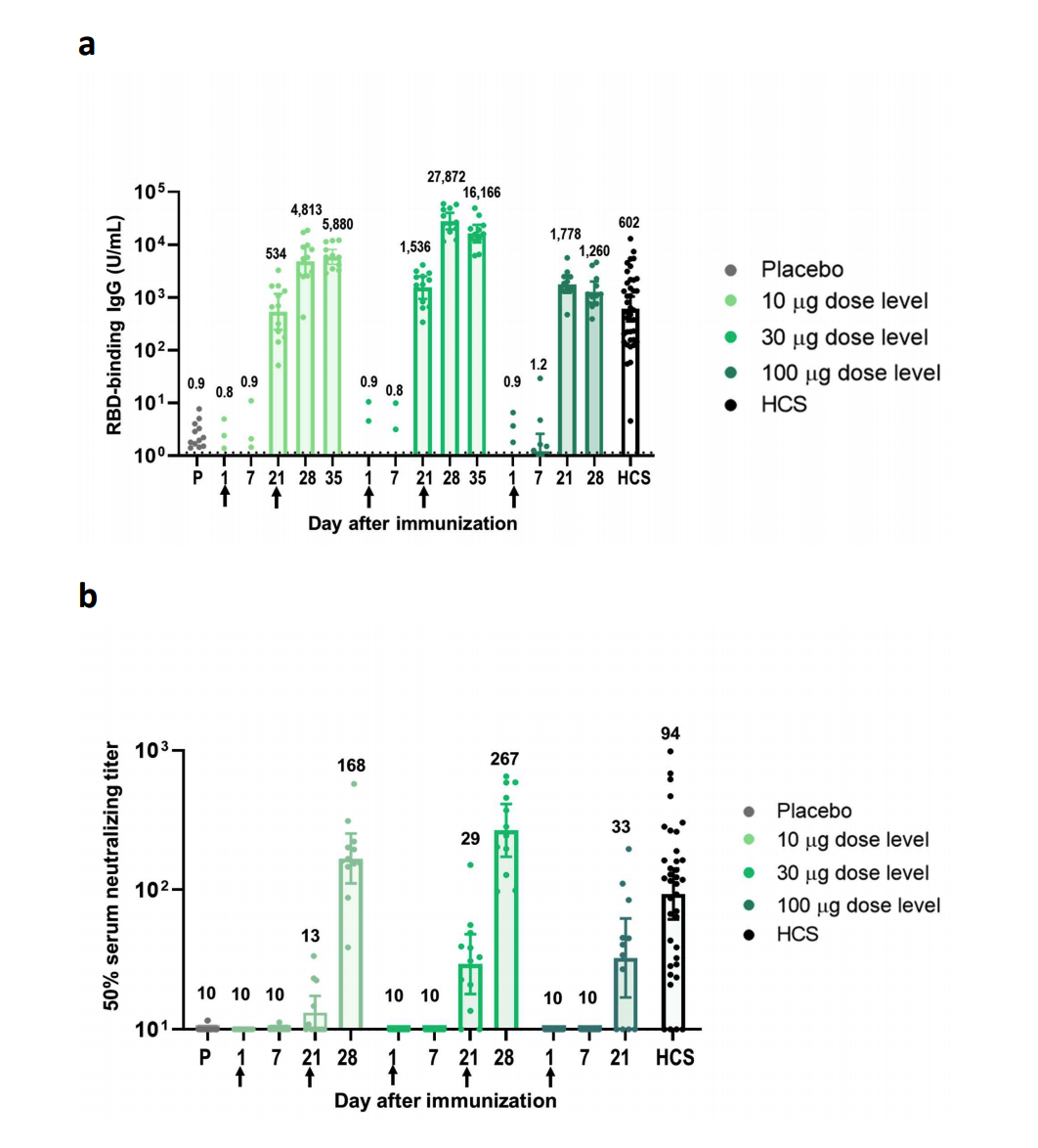
BNT162b1的免疫原性, medRxiv preprint doi: https://doi.org/10.1101/2020.08.17.20176651.this version posted August 28, 202
辉瑞与BioNTech两家公司于7月1日发布了BNT162b1的初步一期临床试验数据,接受两剂低剂量疫苗的24名受试者产生了中和抗体。

BNT162b1与BNT162b2免疫原性,medRxiv preprint doi: https://doi.org/10.1101/2020.06.30.20142570.this version posted July 1, 2020
8月28日发布了BNT162b1与BNT162b2的临床一期/二期的试验数据显示,受试者均产生了相似水平的抗体。BNT162疫苗项目主要包括BNT162b1和BNT162b2,这两种疫苗均为核苷修饰的mRNA(modRNA),包裹在脂质纳米粒中。BNT162b1编码一个优化的SARS-CoV-2受体结合域(RBD)抗原,而BNT162b2编码一个优化的SARS-CoV-2全长棘突蛋白(S)抗原。预计二/三期试验将重点放在BNT162b2上。 预计将在阿根廷,巴西和美国招募多达30000名参与者。

CNBC
Bourla在接受哥伦比亚广播公司(CBS)“Face the Nation”节目采访时说,辉瑞公司在10月底将可提供最后一期病毒疫苗试验关键资料,如果获得美国食品和药物管理局(FDA)批准,该公司将可生产数十万剂疫苗。“我没法确定FDA会怎么做,”Bourla表示。“但我认为,这种情况是有可能的,我们也在为此做准备。”
9月12日(周六),辉瑞公司和BioNTech SE公司向FDA提出提案,将其第三阶段关键性Covid-19疫苗试验扩展至约44000名参与者的计划,并将招募16岁以下的人以及患有慢性HIV、丙型肝炎和乙型肝炎的人,以增加了试验人群的多样性。该试验的最初目标计划是30000人,两家公司表示,他们预计将在下周达到这一目标。辉瑞公司首席商务官John Yang在7月份的美国国会听证会上说:“考虑到Covid-19对美国不同人种产生了不同的影响,临床试验的多样性是目前辉瑞公司的首要任务。”
Bourla在CBS上表示,他们还将集中精力在未来几周内招募更多有色人种,包括非裔美国人和拉丁美洲人。他说,研究对象目前是60%的白人和40%的有色人种,其中年龄较大的志愿者占44%。如果这项研究成功,两家公司可以最早在10月将疫苗提交监管部门批准,使其有望在2020年底之前提供多达1亿剂疫苗,在2021年底之前提供13亿剂疫苗。两家公司在周六的联合声明中补充说:“如前所述,根据目前的感染率,两家公司仍希望在十月底之前有关于疗效的最终结论。”
牛津大学上周六表示,全球约有18000人已经接受了Covid-19疫苗的试验。在研究暂停之前,阿斯利康已经在美国进行了30000人的疫苗试验。
Moderna 上周周五表示,已经有近23500人参加了在美国对其疫苗的后期研究,以实现30000人的目标。该公司表示,已经要求其研究站点的负责人提高少数族裔的入组率,即使这意味着需要更长的时间才能完成该试验的全部入组总数。
强生计划于本月开始对包括美国在内的多个国家的多达60000人的疫苗进行后期研究。
据美国CNBC报道,辉瑞一直在与德国制药商BioNTech合作。7月,美国政府宣布,如果证明疫苗安全有效,将向两家公司拨款19.5亿美元,以生产和交付1亿剂疫苗。该协议是由特朗普政府签署的,为加速开发和生产应对新冠病毒的疫苗和疗法展开的“Operation Warp Speed”的一部分。Bourla表示,目前该公司已经投资了15亿美元用于开发疫苗。“如果该疫苗不能奏效,那将给公司财务造成’灾难’”,辉瑞是唯一参加疫苗研发却没有领取政府补助的美国制药公司,若疫苗研发失败将对公司财务产生极大的风险,Bourla表示这是为了免于受政治角力的影响。
值得注意的是,辉瑞公司是美国目前正在对疫苗进行后期试验的三家公司之一。另外两个分别是Moderna和阿斯利康(AstraZeneca),阿斯利康此前出于安全原因暂停了试验,但已于上周六宣布恢复试验。此前,美国不少传染病专家和科学家曾表示,他们担心特朗普总统会敦促FDA在对疫苗进行充分测试之前就批准疫苗。FDA专员Stephen Hahn坚称自己没有受到特朗普加速疫苗批准的压力,但他在上个月对《金融时报》表示,FDA准备绕开联邦审批程序,以便尽快让新冠疫苗问世。
9月8日,包括辉瑞在内的9家制药公司联合发布了一封声明,承诺在研发新冠病毒疫苗的过程中将安全放在首位,并坚持保证“科学程序的完整性”。特朗普曾公开表示将在11月的选举前批准疫苗。然而包括美国国立卫生研究院(NIH)所长 Francis Collins在内的其他美国高级卫生官员都表示,到今年年底更现实。即使是这样,也要等到2021年,才能有足够的疫苗覆盖大多数美国人。辉瑞董事会成员Scott Gottlieb说:“我认为我们不会在大选前获得批准。”他补充说,“大选后美国人对Covid-19疫苗的不信任感才可能会消失”。
当相关的法规部门批准之后,BioNTech和辉瑞将会在全球各地推出市场(不包括中国,香港和澳门,因为BioNTech已和复星医药合作,于中国进行BNT162疫苗计划的临床研发和商业推广)。
参考文献:
作者:DR.DU & JACK
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#三期临床#
44
#TEC#
37
#三期临床试验#
0
#Bio#
44
#BioNTech#
38