STTT | XELOX联合贝伐珠单抗治疗未经治疗的转移性结直肠癌:一项随机对照Ⅲ期临床试验
2024-04-10 daikun MedSci原创
该研究旨在评估PD1-T细胞联合XELOX化疗加贝伐珠单抗一线治疗未经治疗的转移性结直肠癌患者的疗效和安全性,PD1-T细胞免疫治疗联合XELOX化疗加贝伐珠单抗一线治疗可显著提高患者疗效且安全可控。
结直肠癌是全球常见的恶性肿瘤,其中约1/3的患者会发生远处转移,当前,氟尿嘧啶类化疗药物联合靶向治疗是转移性结直肠癌的标准一线治疗,但生存期仍然有限,免疫检查点阻断疗法在多种实体瘤的治疗中取得了突破性进展,尤其对dMMR/MSI-H的转移性结直肠癌患者效果显著,然而,该疗法对pMMR患者效果有限,需要开发新的免疫治疗策略,过继细胞免疫疗法通过输注免疫活性细胞来发挥抗肿瘤作用,而CIK/DC-CIK细胞在结直肠癌治疗中显示出良好前景,与化疗药物联合应用具有协同作用,该研究团队前期研究发现,PD1-T细胞(抗PD-1抗体激活的DC-CIK细胞)在多种实体瘤治疗中具有良好的安全性和疗效,因此,该研究旨在评估PD1-T细胞联合XELOX化疗加贝伐珠单抗一线治疗未经治疗的转移性结直肠癌患者的疗效和安全性。

方法
该研究纳入了18-75岁之间,经病理或细胞学确认的未经治疗的转移性结直肠癌患者,至少有一个可测量病灶,将符合条件的患者以1:1的比例随机分为两组,免疫治疗组接受PD1-T细胞免疫治疗加XELOX加贝伐珠单抗治疗,对照组仅接受XELOX加贝伐珠单抗治疗,主要观察终点为无进展生存期(PFS),次要观察终点包括总生存期(OS)、客观缓解率(ORR)等。
研究结果
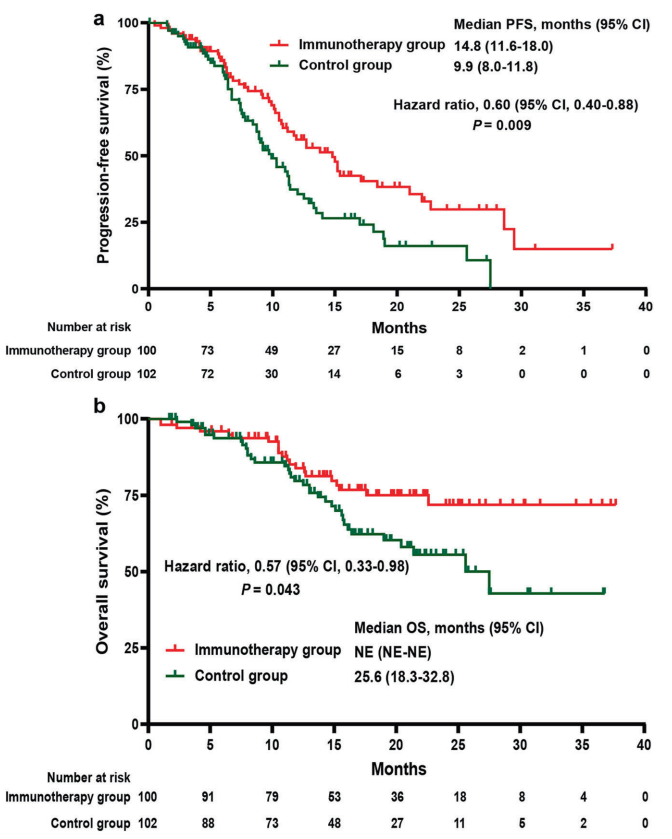
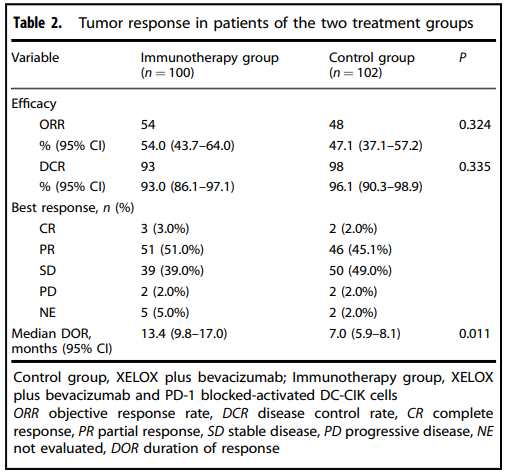
共有202例患者被随机分为免疫治疗组和对照组,两组的基线特征无明显差异,免疫治疗组的无进展生存期中位数为14.8个月,对照组为9.9个月,两组比较差异有统计学意义(HR 0.60, P=0.009),免疫治疗组的总生存期中位数未达到,对照组为25.6个月,两组比较差异有统计学意义(HR 0.57, P=0.043),两组的客观缓解率(ORR)和疾病控制率(DCR)无显著差异。
安全性
免疫治疗组和对照组中分别有94%和96%的患者出现了治疗相关不良事件,两组中3级或以上严重不良事件的发生率分别为20%和23.5%,严重不良事件的发生率分别为13%和14.7%,最常见的3级或以上严重不良事件包括白细胞减少、手足综合征、贫血和过敏,主要与XELOX加贝伐珠单抗化疗相关,PD1-T细胞相关的不良事件主要为1-2级,包括疲劳、发热、低皮质醇血症、甲状腺功能减退和甲状腺功能亢进等,无因毒性反应导致的死亡事件发生,两组因不良反应导致的治疗终止率分别为7%和4%。

结论
PD1-T细胞免疫治疗联合XELOX化疗加贝伐珠单抗一线治疗可以显著提高未经治疗的转移性结直肠癌患者的无进展生存期和总生存期,免疫治疗组的中位无进展生存期为14.8个月,对照组为9.9个月,总生存期中位数免疫治疗组未达到,对照组为25.6个月,两组比较差异均具有统计学意义,PD1-T细胞免疫治疗联合化疗的安全性良好,未增加严重不良反应的发生风险,具有较好的耐受性,PD1-T细胞免疫治疗联合XELOX化疗加贝伐珠单抗可能成为转移性结直肠癌患者一线治疗的新选择,未来的研究需要进一步探索PD1-T细胞免疫治疗在不同人群中的疗效,以及寻找预测疗效的分子标志物。
原始出处
Pan, QZ., Zhao, JJ., Liu, L. et al. XELOX (capecitabine plus oxaliplatin) plus bevacizumab (anti-VEGF-A antibody) with or without adoptive cell immunotherapy in the treatment of patients with previously untreated metastatic colorectal cancer: a multicenter, open-label, randomized, controlled, phase 3 trial. Sig Transduct Target Ther 9, 79 (2024). https://doi.org/10.1038/s41392-024-01788-2.
作者:daikun
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#贝伐珠单抗# #转移性结直肠癌# #XELOX#
59