射血分数保留的心力衰竭 (HFpEF) 的 肺动脉高压病理生理学
2022-05-20 刘少飞 MedSci原创
射血分数保留的心力衰竭 (HFpEF) 的 PH 与 1 型 PH (PAH) 具有相同的特征,但其血液动力学和病理生理学改变时什么呢?
临床实践中最重要的诊断挑战之一是区分由原始肺动脉高压 (PAH) 引起的肺动脉高压 (PH) 和由左心疾病引起的 PH。这两种情况具有一些共同的特征和病理生理途径,使得这两个过程在几个方面相似。它们的诊断差异基于右心导管插入术、心脏结构改变和治疗反应的血流动力学数据。更具体地说,继发于射血分数保留的心力衰竭 (HFpEF) 的 PH 与 1 型 PH (PAH) 具有相同的特征,尤其是当毛细血管前后联合形式 (CpcPH) 发生在疾病的晚期时。右心室 (RV) 功能障碍是与较差的预后和较低的生存率相关的常见后果。这种情况最近已通过基于临床体征和进展标志物的新分类确定。PH 和 RV 功能障碍在 HFpEF 中的作用和患病率仍未确定,最大的临床试验报告的文献存在很大差异。不同的实质和血管改变影响这两种疾病。毛细血管和小动脉血管收缩、血管闭塞和肺血液从基底区重新分布到心尖区是 1 型 PH 的典型表现。相反,与 HFpEF 相关的 PH 主要是由于小静脉/毛细血管壁层纤维化、细胞外基质沉积和肌细胞肥大以及继发性血管“小动脉化”所致。
关于肺动脉高压(PH)患病率和严重程度的数据往往不清楚,由于RHC诊断标准的应用不统一,以及缺乏标准的随机化选择,在疾病的不同阶段获得的观察结果,纳入标准的范围很广。欧洲的PAH患病率和发病率分别约为每百万人口15-60例和每百万人口5-10例。PH-HFpEF的影响更大,但数据的变化也更大;在整个HFpEF人群中,报告的患病率从18%到83%不等,取决于研究的群体。值得注意的是,HFpEF的定义标准在过去几十年中有所改变,最普遍接受的纳入标准主要是基于EF阈值和钠尿酸肽增加。大多数试验没有考虑详细的无创多普勒分析或左心室和左心房的几何测量。因此,选择偏差主要是基于超声心动图对收缩期PAP的估计数据,而不是对PAPm和心房压力的系统有创血流动力学评估。TOPCAT试验的超声心动图子研究显示,36%的患者三尖瓣反流速度>2.9 m/s,相当于估计收缩期PAP至少35 mmHg。在最近的PARAGON-HF试验的子分析中,PH-HFpEF的比率为31%。Gerges等人使用PAPm>25 mmHg的标准分界线对HFpEF患者的PH流行率进行了侵入性评估,报告了54.4%的流行率。很难获得有关Ipc-PH和Cpc-PH亚分类的精确的PH-HFpEF统计数据;由于并非对所有HFpEF患者常规进行右心血流动力学评估,因此很难估计血管阻力增加和PH进展的患者数量。一项对2587名PH-HFpEF患者的回顾性分析显示,使用舒张压梯度(DPG)>7mmHg或PVR>3WU作为血流动力学标准,患病率从8.8%到3.5%。Gergers等人的报告,合并了近4000次心导管检查的回顾性和前瞻性数据,发现使用DPG>7 mmHg的HFpEF的Cpc-PH率为22.6%。在PH-HFpEF患者中识别和选择受CpcPH影响的对象是非常重要的,因为他们的预后比IpcPH患者要差得多,并可能从改善肺血管功能的疗法中受益。
PH-HFpEF的血液动力学和病理生理学改变
PAH和PH-LHD在血流动力学上是以肺动脉楔压来区分的。在PAH中,平均PAWP≤15mmHg,而在PH-LHD中,mPAWP>15mmHg。这种血流动力学差异来自于左心室舒张末期和左心房压力(LAP)的长期升高,这是HFpEF和HFrEF中PH发展的诱因。因此,在PH-HFpEF发展的初始阶段,肺动脉压力(PAP)的升高被认为是肺循环中LAP的被动反映。从微观角度看,主要的肺血管改变最初发生在静脉层面,血管通透性增加,顶层厚度增加,胶原蛋白沉积。气压创伤诱发了一个被称为 "肺泡-毛细血管应力衰竭 "的过程,或者说是静脉和毛细血管的反应,包括内皮渗透性的破坏、肺泡充血以及细胞外基质沉积的触发。在第一阶段,细胞外基质的沉积有可能吸收和容纳液体进入间质,是典型的孤立的毛细血管后PH。如果刺激因素被移除,这种机制是可逆的。然而,长期升高的压力会诱发金属蛋白酶的激活,出现真正的毛细血管重塑、肺静脉的 "动脉化 "和管腔狭窄。此外,当LAP长期增加时,这一过程向后反映,引起动脉血管的改变,有内侧肥大、内膜和内膜纤维化,以及逐渐的管腔闭塞,但没有PAH中看到的血管增生过程(图1)。当静脉和肺小动脉都受累时,会出现PVR增加,并向合并毛细血管前和后PH-HFpEF发展。这一阶段的疾病类似于PAH内皮功能紊乱,毛细血管和动脉血管收缩,血管闭塞,肺部血液从基底区向顶端区重新分布。最初的改变从周围的肺血管开始,但很快传递到中、大动脉管腔,直至累及肺动脉的两个主要分支。共同的病理生理途径可能与一氧化氮(NO)和内皮素-1之间的不平衡有关,可溶性鸟苷酸环化酶(sGC)被抑制。此外,缺氧引起电解质运输的不平衡,导致肺泡液体运输的改变。
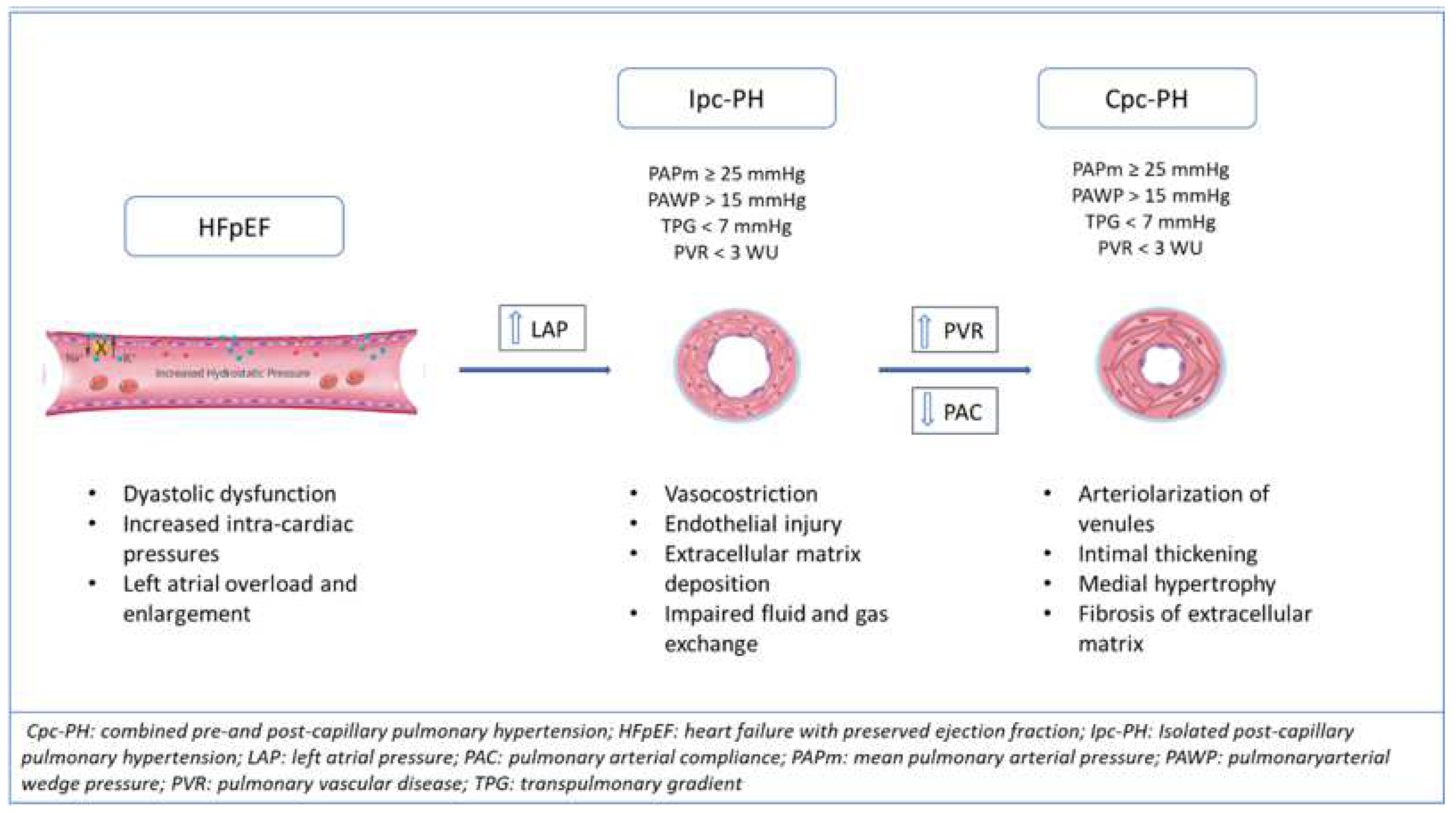
图1. HFpEF肺动脉高压的发展:病理血管的改变和血液动力学的变化,从孤立的毛细血管前(Ipc)到联合毛细血管前和后高血压(Cpc-PH)。
在CpcPH中,肺动脉系统的重塑导致了PVR的增加和肺血管顺应性的降低。也就是说,在肺血管床中,动脉顺应性(PAC)分布在整个血管系统中,远端血管主要决定阻力和顺应性,与全身循环不同,80%的顺应性来自近端主动脉。由于这两个血流动力学特征代表了血管负荷,因此对它们的关系进行了分析。研究报告指出,它们的关系是反向的,而且分布稳定,因为肺动脉顺应性(PAC)×PVR是常数。这种关系在PH中保持不变,肺压的比例性得以保持。PAC可以被认为是肺动脉扩张性(脉动负荷)的代名词,计算方法是每搏量(SV)/脉压(PP),其中不包含PAWP。因此,PAC可以作为PAWP增加的结果而减少,在任何给定的PAWP水平上介导PAPm的变化。在PH发展的早期阶段,PAC的变化早于PVR的升高,而且PVR的增加非常小,无法检测。因此,PAC可作为早期肺血管疾病发展和PVR增加的早期标志。由于PH-HFpEF中PAWP的不间断升高,增强的脉动和阻力负荷向后反映,从而影响右心室后负荷。肺血管疾病和RV功能之间的这种紧密联系是PH的发展的核心,影响着预后和管理。
参考文献:
Barilli M, Tavera MC, Valente S, Palazzuoli A. Structural and Hemodynamic Changes of the Right Ventricle in PH-HFpEF. Int J Mol Sci. 2022 Apr 20;23(9):4554. doi: 10.3390/ijms23094554. PMID: 35562945; PMCID: PMC9103781.
作者:刘少飞
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#病理生理学#
82
#射血分数保留#
84
#病理生理#
113
#PE#
77
#动脉高压#
96