南开大学最新Angew:铜诱导超分子肽组装实现多途径细胞死亡和肿瘤抑制
2024-06-09 BioMed科技 BioMed科技
南开大学生科院高洁研究员和药学院王玲研究员等人设计了一种合成前体FcGH。
尽管自组装已成为制造生物材料的有效工具,但实现对所得组装体的形态和功能的精确控制仍然是一个持续的挑战。受人类血浆中天然存在的铜肽的启发,南开大学生科院高洁研究员和药学院王玲研究员等人设计了一种合成前体FcGH。FcGH可以通过两种不同的途径自组装:自发和Cu2+诱导。这两种组装途径能够通过调节Cu2+的添加量来形成具有可调形态的组装体。研究发现,通过Cu2+诱导的自组装形成的纳米颗粒表现出比自发形成的蠕虫状纤维显著更高的细胞摄取效率。通过与FcGH偶联的10-羟基喜树碱(HCPT)共组装,Cu2+诱导的超分子纳米药物在癌症细胞中可引发多种细胞死亡模式,并提高免疫原性。这项研究强调了Cu2+诱导的自组装是指导纳米药物组装和协同肿瘤治疗的有效工具。相关工作以“Copper-Induced Supramolecular Peptide Assemblies for Multi-pathway Cell Death and Tumor Inhibition”为题发表在Angew。

【文章要点】
本研究的设计灵感来自天然铜肽GHK-Cu2+,这是一种在人类血浆中天然存在的铜肽复合物。生物物理研究已经表明,Cu2+可与组氨酸咪唑侧链的氮原子、甘氨酸的氮、Gly–His肽键的酰胺氮原子和外部配体(如H2 O)进行特异性配位。这种独特的配位模式被称为3N+1O模式。因此,通过将铜结合基序Gly–His接枝到二茂铁–GFFYK肽的侧链上,作者设计了一种具有两种组装途径潜力的底盘分子FcGH。二茂铁(Fc)被设计为驱动GFFY组装的疏水端,而Gly–His基序则可促进Cu2+的配位。同时,作者没有采用平面分子,如萘乙酸作为帽,因为这种分子往往被强烈凝胶化,导致结构可调节性的丧失。
研究发现,FcGH作为组装的底盘分子,可经历两种不同的组装途径:1)通过π–π堆积自发组装成FcGH 0;2)Cu2+通过配位和π–π堆叠诱导自组装成FgGH Cu(图1)。这两种组装途径导致了组装体的可调节形态,即从纳米纤维到纳米颗粒。通过与FcGH缀合的HCPT(10-羟基喜树碱)共组装,引发了多种细胞死亡模式,同时提高了免疫原性。这项研究为构建生物启发的肽组装平台提供了见解,并探索了其在组装增强肿瘤治疗中的潜在应用。
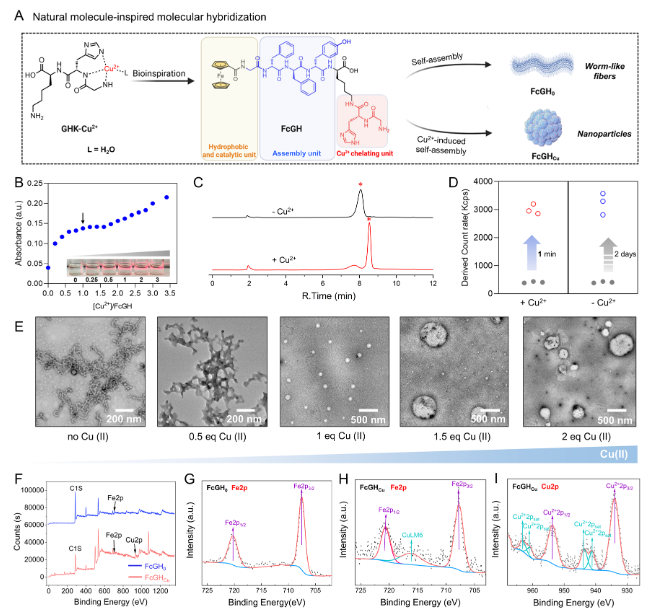
图1 两种组装途径
进一步地,Cu2+通过与FcGH缀合的HCPT(10-羟基喜树碱)共组装形成FcGHCu-HCPT球形纳米颗粒。FcGHCu-HCPT在溶酶体中被激活,诱导溶酶体膜破裂和多因素细胞死亡。与游离HCPT相比,这种多因素细胞死亡也导致免疫原性升高。在体内,由此造成的死亡细胞充当抗原库,募集DC并诱导T细胞活化和肿瘤细胞杀伤回路(图2)。
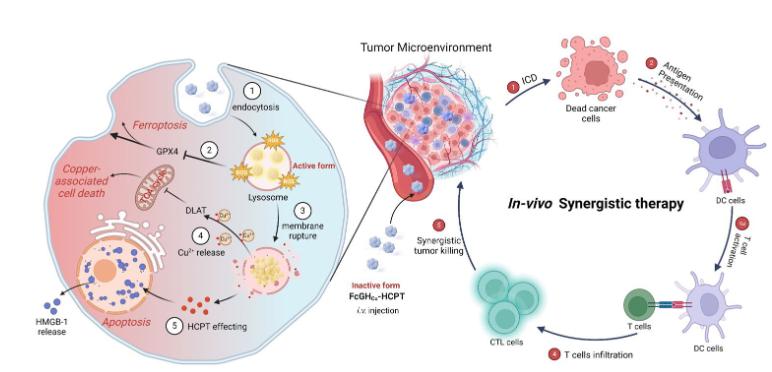
图2 抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/anie.202406602
作者:BioMed科技
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#肿瘤# #细胞死亡# #Cu2+诱导#
9