Nature Nanotechnology:惊呆了,癌细胞学会了三十六计,釜底抽薪,偷走免疫细胞的线粒体,实现免疫逃逸
2021-11-26 “ 生物世界”公众号 “ 生物世界”公众号
该研究提供证据证明,癌细胞巧用“釜底抽薪”的战术策略,通过纳米管窃取T细胞的线粒体(细胞的能量工厂),在增强自身的同时,还削弱了免疫细胞的活性,从而智胜免疫系统,实现免疫逃逸。
《三十六计》,是中国古代战争智慧的集合,古人更是将这些战争策略提炼成简短的谚语,诸如:瞒天过海、暗度陈仓、无中生有和釜底抽薪等等。这些计谋教我们如何在战场乃至生活中如何以智慧击败敌人。
其中,釜底抽薪出自《三十六计》的第十九计,意思是把柴火从锅底抽掉,才能使水止沸。这种战术的本质不是直接攻击敌人的战斗部队,而是通过破坏敌人的后勤工事来削弱他们发动战争的能力。
2021年11月18日,美国哈佛医学院的研究人员在 Nature Nanotechnology 期刊上发表了题为:Intercellular nanotubes mediate mitochondrial trafficking between cancer and immune cells 的研究论文。
该研究提供证据证明,癌细胞巧用“釜底抽薪”的战术策略,通过纳米管窃取T细胞的线粒体(细胞的能量工厂),在增强自身的同时,还削弱了免疫细胞的活性,从而智胜免疫系统,实现免疫逃逸。
随着生命科学的发展,科学家对免疫、代谢和肿瘤的认识越来越深入。此前,有大量的研究强调线粒体对免疫细胞的代谢和激活是至关重要的。例如,增加线粒体生物量和备用呼吸能力已被证明可以增强T细胞的持久性,并提供必要的生物能量优势,以根除癌细胞和防止潜在的复发。
两军对阵,硬实力固然重要,但运筹帷幄也是制胜的关键。癌细胞面对免疫系统的火力压制,是否有会进化出某种机制对其进行削弱,进而智胜免疫系统呢?
在这项研究中,研究团队首先注意到线粒体转移这种容易被忽视的细胞间通讯现象。他们建立了一个简单的共培养系统,在这个系统中,免疫细胞会被荧光染料标记,并选择性地聚集在线粒体中。基于此,研究小组能够观察到接触依赖的染料转移,从而推断出免疫细胞线粒体的移动。

荧光染料示踪显示了肿瘤细胞与免疫细胞的接触
他们发现,当免疫细胞和肿瘤细胞共培养时,免疫细胞的线粒体会转移到肿瘤细胞中。为了排除非特异性游离染料泄漏导致的假阳性结果,还发现了荧光标记的线粒体蛋白——Dendra2绿色标记的细胞色素c氧化酶亚基8的转移。
这些不同的示踪方法的组合,证实了这些看到的现象是真实发生的,即肿瘤细胞会通过某种方式“窃取”免疫细胞的线粒体。

肿瘤细胞通过纳米管劫持免疫细胞的线粒体
因此,研究团队进一步探究了肿瘤细胞是通过何种方式对免疫细胞进行“釜底抽薪”的。细胞间线粒体转移涉及多种机制,包括缝隙连接、纳米管、细胞融合和细胞外囊泡。通过电子显微观察到,肿瘤细胞和免疫细胞之间存在纳米管样结构,及荧光标记的线粒体与已知线粒体转运蛋白在纳米管位点的共定位。

在电镜下,癌细胞和免疫细胞通过物理纳米管连接在一起
紧接着,研究团队靶向敲除了纳米管形成的基因(Sec3,Sec5)和线粒体运输(Miro1)的基因,线粒体转移的现象也随之消失。基于这些证据,研究人员明确地建立了一种因果联系,即肿瘤细胞是通过纳米管“窃取”免疫细胞的线粒体。
更重要的是,研究团队还指出这种线粒体劫持现象并不只是发生在体外共培养系统中,也发生在体内,由此强调了其临床相关性。
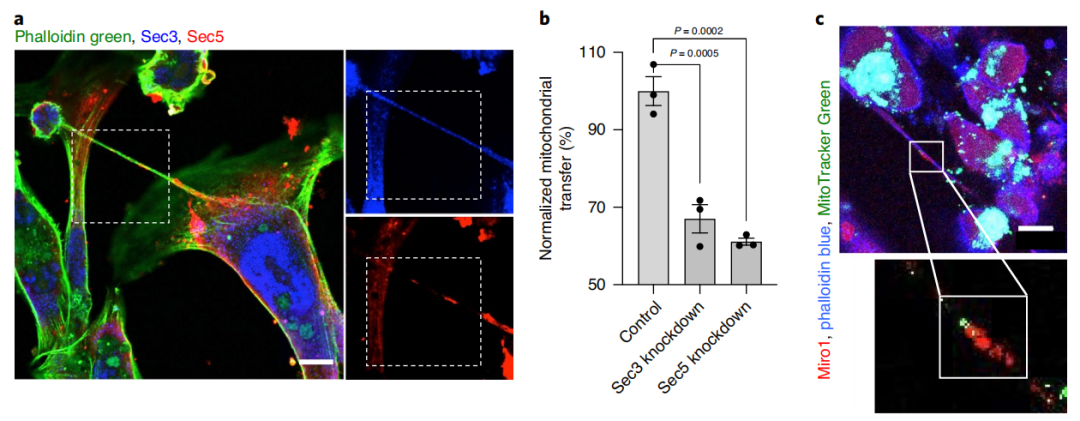
抑制纳米管形成(敲除Sec3,Sec5,Miro1基因)之后,肿瘤细胞无法再窃取免疫细胞的线粒体
既然已经发现了肿瘤细胞的战术策略,那我们又如何防止它们“釜底抽薪”呢?
实际上,在此之前,不少研究已经发现了一些抑制纳米管形成的抑制剂,它们可以阻止肿瘤细胞的这种免疫逃逸策略。研究团队通过将抗PD-1抗体与纳米管抑制剂——L-778123联合使用,在腺癌模型中验证了这一理论。
他们发现,在非细胞毒性浓度下,L-778123能够有效抑制纳米管的形成。与单独治疗相比,L-778123联合PD-1抑制剂显着增加了肿瘤内T细胞的活化和浸润,导致肿瘤进展延迟和肿瘤动物模型生存时间延长。
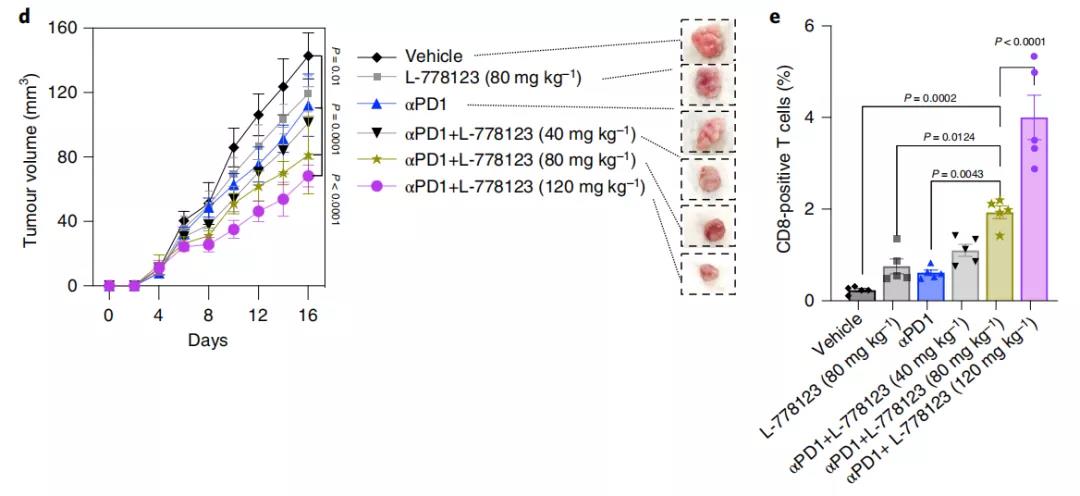
L-778123联合PD-1抑制剂,导致肿瘤进展延迟和带瘤动物生存时间延长
尽管L-778123的全身给药和非特异性妨碍了关于其作用机制的明确结论,但这些发现清楚地表明了联合治疗的潜在治疗价值。研究团队表示,可以通过一种更具体和有针对性的方法将抑制剂直接传递到体内肿瘤中,从而避免其副作用。
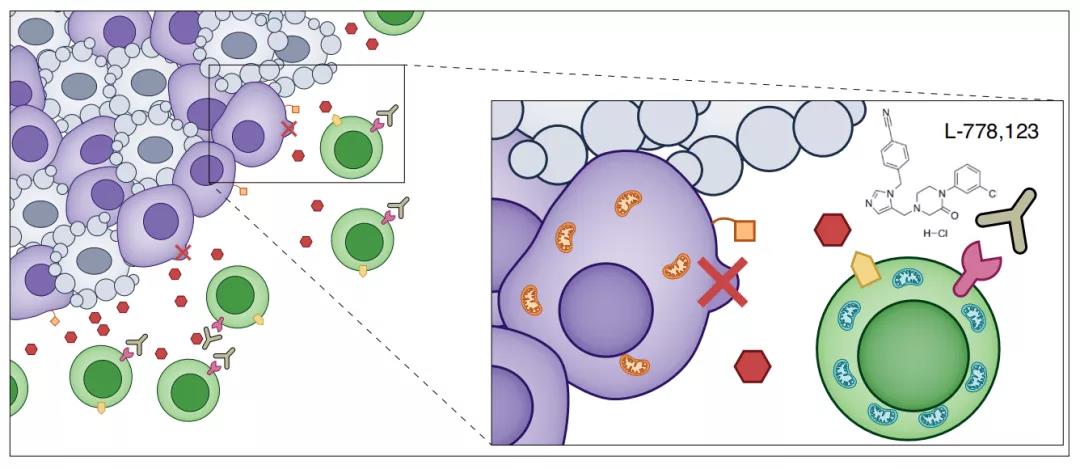
纳米管抑制剂L-778123联合PD-1抑制剂可以增强抗肿瘤治疗效果
总而言之,这项最新研究表明,癌细胞可以通过纳米管介导的劫持来捕获免疫细胞的线粒体,从而削弱免疫细胞的免疫能力。这就像癌细胞也学会了《三十六计》,熟练运用“釜底抽薪”,增强自身,削弱对手,从而实现免疫逃逸。
在后续的研究中,研究团队还证实,纳米管抑制剂L-778123可以联合PD-1抑制剂增强免疫系统对肿瘤细胞的杀伤能力,未来也许能成为一种全新的抗肿瘤治疗方式。
原始出处:
Baldwin, J.G., Gattinoni, L. Cancer cells hijack T-cell mitochondria. Nat. Nanotechnol. (2021). https://doi.org/10.1038/s41565-021-01006-y.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





#TEC#
53
#Nat#
31
#Technology#
49
#细胞学#
44
#癌细胞#
42