Cell:癌细胞存在三种状态!检测它们的状态可以揭示药物敏感性
2021-12-28 细胞 细胞
在过去的几十年里,科学家们在了解能够驱动癌症产生的基因突变方面取得了巨大的进展。对于某些类型的癌症,这些发现已经导致了针对特定突变的药物的开发。然而,仍有许多类型的癌症没有这种靶向疗法。
在过去的几十年里,科学家们在了解能够驱动癌症产生的基因突变方面取得了巨大的进展。对于某些类型的癌症,这些发现已经导致了针对特定突变的药物的开发。然而,仍有许多类型的癌症没有这种靶向疗法。
在一项新的研究中,来自美国麻省理工学院和丹娜-法伯癌症研究所等研究机构的研究人员研究了另一种细胞特征——RNA表达模式是否影响药物反应,以及是否可用于识别肿瘤敏感的治疗方法。相关研究结果发表在2021年12月9日的Cell期刊上,论文标题为“Microenvironment drives cell state, plasticity, and drug response in pancreatic cancer”。
在这项针对胰腺癌细胞的新研究中,这些作者确定了三种典型的RNA表达状态,并发现了它们对多种癌症药物的敏感性存在差异。他们还发现,改变肿瘤微环境可以促使肿瘤细胞从一种状态转变为另一种状态,这可能提供了一种使它们更易受某种特定药物影响的方法。
论文共同通讯作者、麻省理工学院医学工程与科学研究所核心成员Alex Shalek说,“我们在这篇论文中所展示的是,癌细胞状态在对它所在的微环境作出反应方面是可塑的,并对药物敏感性有巨大的影响。这为思考药物开发以及如何为个性化患者选择药物开辟了新的领域。”
细胞状态
对癌细胞的基因组进行测序可以发现与癌症有关的突变,但识别这些突变并不总是提供可以采取行动来治疗特定肿瘤的信息。为了产生可用于帮助选择更有针对性的治疗方法的额外数据,这些作者寻求单细胞RNA测序的帮助,这种测序揭示了每个细胞在某一时刻正在表达的基因。
论文共同第一作者、麻省理工学院研究生Andrew Navia说,“有很多情况下,遗传学是非常重要的,你可以开发这些非常精确地靶向突变或易位的药物。但在许多情况下,仅仅是突变并不能给你提供一种有效的方法来靶向癌细胞而不会靶向健康的细胞。”
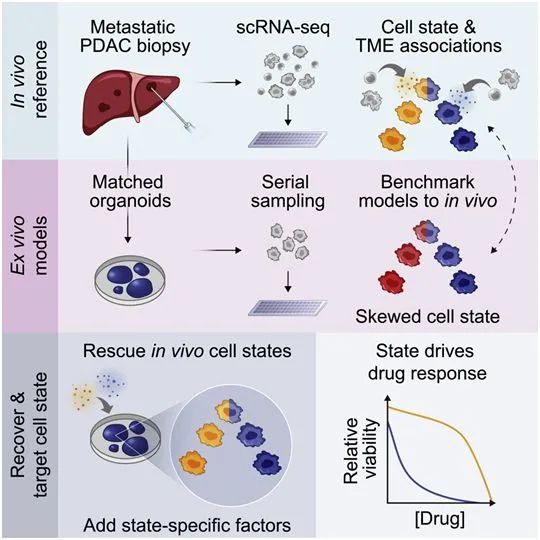
图片来自Cell, 2021, doi:10.1016/j.cell.2021.11.017。
在这项新的研究中,这些作者分析了来自胰腺导管腺癌(PDAC)的细胞。目前很少有治疗胰腺肿瘤的靶向药物,因此大多数患者接受的化疗药物最初可能有效,但往往随着肿瘤的耐药性出现而停止发挥作用。他们利用单细胞RNA测序技术,分析了来自胰腺癌患者的大约25例转移性肿瘤样本。
以前对胰腺肿瘤细胞RNA的分析揭示了两大类细胞状态:基底样细胞状态,这是一种更具侵袭性的状态,以及经典状态。在这项新的研究中,这些作者发现了第三种状态,它似乎是这两种状态的中间状态。他们说,癌细胞在从经典状态过渡到基底样细胞状态时可能会经过第三种状态。
这些作者还发现,癌细胞的生长环境在决定它的细胞状态方面起着关键作用。在这项新的研究中,他们利用每名患者的活组织样本培育出相匹配的“类器官”,即微小的癌症聚集体。这类类器官通常被用于精准医疗管道,为个性化患者的肿瘤进行建模,以帮助确定可能对这些人有用的药物。
当把个体内单细胞资料与匹配的体外类器官模型进行比较时,这些作者发现相比于直接来自同一患者的癌细胞,类器官经常以不同的RNA状态存在。Shalek说,“我们在原始肿瘤及其模型中看到了相同的DNA突变,但是当我们开始检查它们在RNA水平上的样子时,我们发现它们非常、非常不同。”
他说,这表明肿瘤的状态可能受到其生长条件的影响,而不仅仅是其遗传学。这些作者还发现,他们可以通过改变生长条件来驱动癌细胞在不同的状态之间切换,即便是长期建立的细胞系模型,也是如此。比如,用TGF-beta处理癌细胞,会促使它们进入更具侵袭性的基底样状态,而在培养皿中取走TGF-beta则会促使它们恢复到经典状态。
这些作者说,处于这些状态中的每一种癌细胞都依赖于不同的细胞信号通路来生存,因此了解细胞状态对于选择正确的药物来治疗某种特定的肿瘤至关重要。
Navia说,“当我们开始研究药物敏感性时,明显发现同样的模型被推到不同的状态对药物的反应会非常不同。当我们考虑选择药物和避免耐药性时,这些特定状态的敏感性变得至关重要。如果你不知道正确的状态,你可能会选择完全错误的化合物并试图靶向错误的途径。如果你不考虑可塑性,癌症可能只是暂时的反应,直到它的细胞改变状态。”
靶向治疗
这些研究结果表明,进一步分析遗传学、细胞状态和肿瘤微环境之间的相互作用可能有助于科学家们开发有效靶向每名患者肿瘤的新药物。
论文共同第一作者、麻省理工学院博士后研究员Peter Winter说,“我们并没有抹去几十年来对癌症作为一种遗传疾病的理解,但我们肯定地说,我们需要更好地理解遗传学和细胞状态之间的交集。细胞状态绝对与某些模型的潜在敏感性有关系,因此也与患者对特定药物的敏感性有关系。”
癌细胞可以通过改变它们所在的微环境中的信号从一种状态被驱动到另一种状态,这一发现提出了一种可能性,即通过治疗改变肿瘤微环境,以一种可预测的方式将癌细胞锁定在一种特定的状态中,然后给予一种单独的药物来靶向这种锁定的状态并提高治疗效果。
这些作者如今正在进行更大的药物筛选,以衡量每种药物如何影响不同状态的胰腺癌细胞。他们还在研究其他类型的癌症,以确定这些癌细胞是否也能够在不同的状态之间转换,以应对它们所在微环境的变化。
参考资料:
Srivatsan Raghavan et al. Microenvironment drives cell state, plasticity, and drug response in pancreatic cancer. Cell, 2021, doi:10.1016/j.cell.2021.11.017.
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






#Cell#
44
#CEL#
51
#药物敏感性#
46
一
52
#癌细胞#
38