妥妥双靶,更久生存——HER2阳性乳腺癌患者强化抗HER2治疗持续获益
2018-12-26 梁广泉 肿瘤资讯
FXL,女性,发病年龄:51岁。2008年5月,因甲状腺癌接受全甲状腺切除术、RAI和T4替代治疗。
病史简介
FXL,女性,发病年龄:51岁。2008年5月,因甲状腺癌接受全甲状腺切除术、RAI和T4替代治疗。
主诉
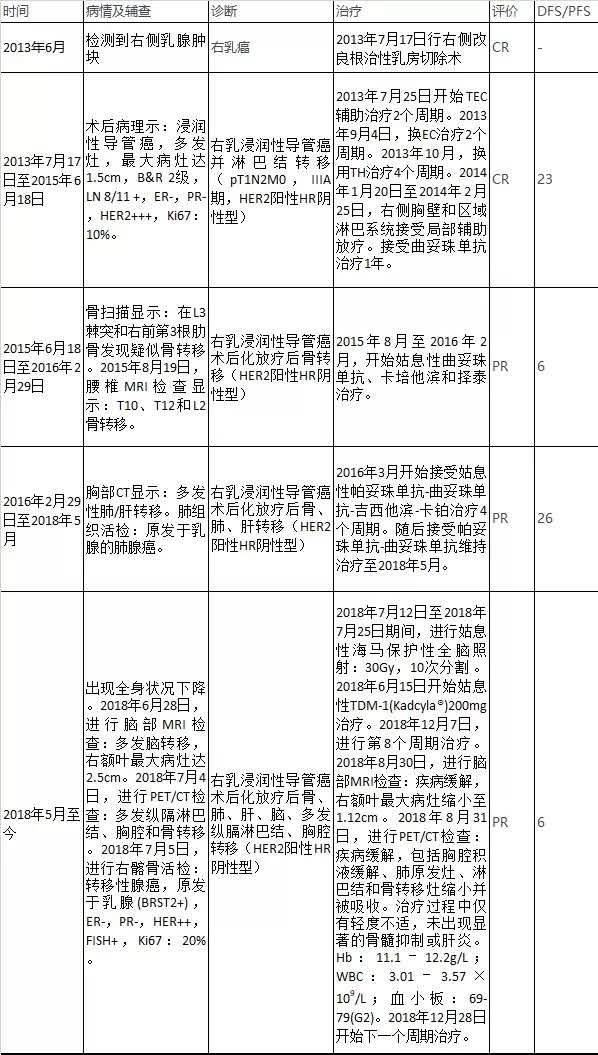
检测到右侧乳腺肿块。初诊时间:2013年6月。
手术及术后病理
2013年7月17日,进行右侧改良根治性乳房切除术。术后病理示:浸润性导管癌,多发灶,最大病灶达1.5cm,B&R 2级,LN 8/11 +,ER﹣,PR﹣,HER2+++,Ki67:10%。
术后诊断
右乳浸润性导管癌并淋巴结转移(pT1N2M0,IIIA期,HER2阳性HR阴性型)
辅助治疗
2013年7月25日,开始接受紫杉醇-表柔比星-环磷酰胺辅助治疗,治疗2个周期。2013年9月4日,换用表柔比星-环磷酰胺治疗2个周期。2013年10月,换用多西他赛-曲妥珠单抗治疗4个周期。2014年1月20日至2014年2月25日期间,右侧胸壁和区域淋巴系统接受局部辅助放疗。接受曲妥珠单抗治疗1年,2014年10月治疗完成。
第一次复发
2015年6月18日,骨扫描显示:在L3棘突和右前第3根肋骨发现疑似骨转移。2015年8月19日,腰椎MRI检查显示:T10、T12和L2骨转移。
诊断:右乳浸润性导管癌术后化放疗后骨转移(HER2阳性HR阴性型)DFS=23个月
一线解救治疗
2015年8月至2016年2月,开始姑息性曲妥珠单抗、卡培他滨和唑来膦酸治疗。
第二次复发
2016年2月29日,胸部CT显示:多发性肺/肝转移。肺组织活检:原发于乳腺的肺腺癌。
诊断:右乳浸润性导管癌术后化放疗后骨、肺、肝转移(HER2阳性HR阴性型)PFS1=6个月。
二线解救治疗及评价
2016年3月开始接受姑息性帕妥珠单抗-曲妥珠单抗-吉西他滨-卡铂治疗4个周期。
后续治疗
随后接受帕妥珠单抗-曲妥珠单抗维持治疗至2018年5月。
第三次复发
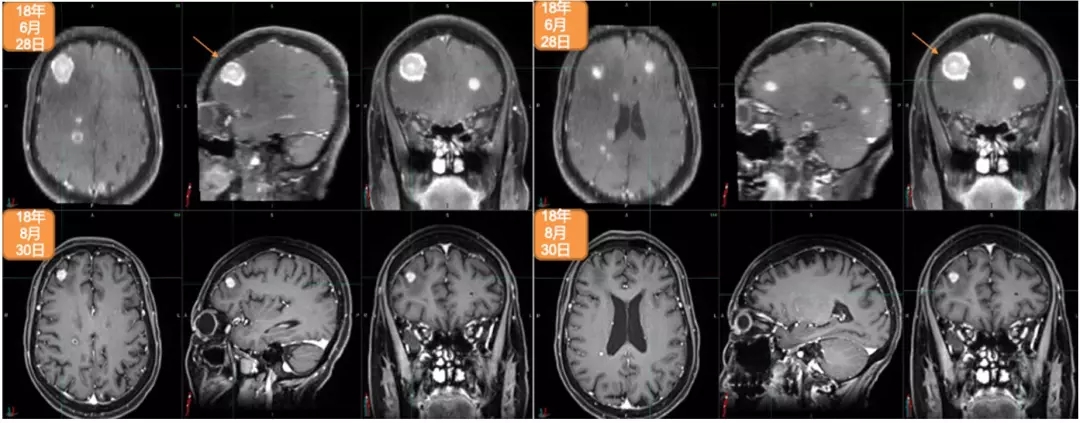
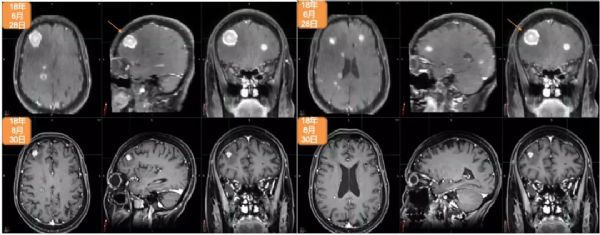
2018年5月,出现全身状况下降。2018年6月28日,进行脑部MRI检查:多发脑转移,右额叶最大病灶达2.5cm。2018年7月4日,进行PET/CT检查:多发纵隔淋巴结、胸腔和骨转移。2018年7月5日,进行右髂骨活检:转移性腺癌,原发于乳腺(BRST2+),ER-,PR-,HER2++,FISH+,Ki67:20%。
诊断:右乳浸润性导管癌术后化放疗后骨、肺、肝、脑、多发纵膈淋巴结、胸腔转移(HER2阳性HR阴性型)PFS2=26个月
三线解救治疗及评价
2018年7月12日至2018年7月25日期间,进行姑息性海马保护性全脑照射:30Gy,10次分割 。2018年6月15日开始姑息性TDM-1(Kadcyla?)200mg治疗。2018年12月7日,进行第8个周期治疗。2018年8月30日,进行脑部MRI检查:疾病缓解,右额叶最大病灶缩小至1.12cm。2018年8月31日,进行PET/CT检查:疾病缓解,包括胸腔积液缓解、肺原发灶、淋巴结和骨转移灶缩小并被吸收。治疗过程中仅有轻度不适,未出现显著的骨髓抑制或肝炎。Hb:11.1–12.2g/L;WBC:3.01–3.57×109/L;血小板:69-79(G2)。2018年12月28日开始下一个周期治疗。
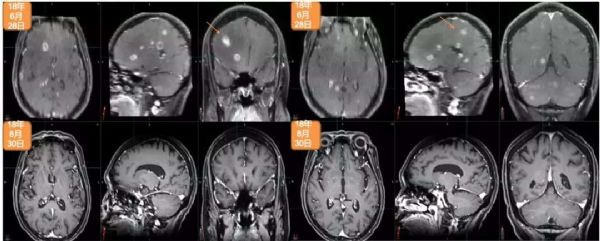
2018年6月28日与2018年8月30日头颅MRI对比
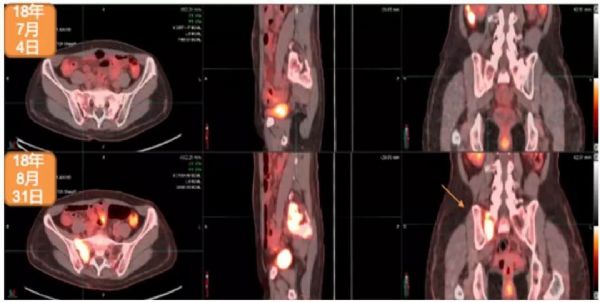
2018年7月4日与2018年8月31日PET/CT检查对比
治疗历程回顾
总结:
患者中年女性,发病年龄51岁。首诊右乳浸润性导管癌并淋巴结转移(pT1N2M0,IIIA期),分子分型:HER2阳性HR阴性型。病理特征:右侧乳房浸润性导管癌,合并淋巴结转移(8/11+),免疫组化提示ER-,PR-,HER2+++,Ki67:10%。患者术后辅助治疗选择紫杉醇+表柔比星+环磷酰胺治疗2周期。后更换为表柔比星+环磷酰胺治疗2周期。后再次更换为多西他赛+曲妥珠单抗进行抗HER2治疗4个周期。并行右侧胸壁和区域淋巴系统局部辅助放疗。曲妥珠单抗维持治疗1年。2015年6月复查骨扫描与8月复查腰椎MRI,提示骨转移。予以曲妥珠单抗+卡培他滨+唑来膦酸治疗。2016年2月胸部CT显示多发肺/肝转移,肺组织活检:原发于乳腺的肺腺癌。2016年3月予以帕妥珠单抗+曲妥珠单抗+吉西他滨+卡铂治疗4个周期,随后予以帕妥珠单抗+曲妥珠单抗维持治疗。研究数据表明20%~25%的浸润性乳腺癌具有HER2的扩增以及过表达,HER2阳性乳腺癌具有侵袭性高,易发生骨、脑转移,预后差等特点。因为HER2阳性与乳腺癌浸润性增加相关,可以导致不良预后。一项名为CLEOPATRA[1](NCT00567190)的随机Ⅲ期临床试验对局部复发、无法切除或转移性HER2阳性乳腺癌一线曲妥珠单抗联合多西他赛方案基础上,增加帕妥珠单抗的疗效进行研究,中位随访50个月,增加帕妥珠可使患者的中位PFS从曲妥珠联合多西他赛治疗下的12.4个月增加至18.5个月(增加6.1个月);中位OS从40.8个月增加至56.5个月(增加15.7个月)。提示晚期HER2阳性乳腺癌一线治疗新标准为曲妥珠单抗+帕妥珠单抗+化疗。同时,有学者对RCTs研究进行系统评估和Meta分析[2],旨在评估帕妥珠单抗+曲妥珠单抗+多西他赛治疗HER2阳性乳腺癌的结果。研究结果显示,帕妥珠单抗+曲妥珠单抗+化疗可以显著降低HER2阳性MBC患者死亡风险,显著改善HER2阳性MBC患者OS和PFS,由此可见HER2阳性MBC患者应接受帕妥珠单抗+曲妥珠单抗+多西他赛治疗。来自意大利真实世界RePer研究[3]评估了帕妥珠单抗+曲妥珠单抗+紫杉类治疗HER2阳性晚期乳腺癌的疗效,研究结果显示以帕妥珠单抗为基础的治疗方案在真实世界缓解率达到77.3%,临床获益率达到93.6%,中位PFS为21个月,无论先前是否接受过曲妥珠单抗治疗的HER2阳性晚期乳腺癌患者,后续予以帕妥珠单抗+曲妥珠单抗联合化疗,PFS均无统计学差异。建议临床实践中将帕妥珠单抗+曲妥珠单抗+化疗作为HER2阳性晚期乳腺癌一线治疗方案。
2018年5月,患者全身状况下降,6月脑部MRI检查提示:多发脑转移,右额叶最大病灶达2.5cm。2018年7月4日,进行PET/CT检查:多发纵隔淋巴结、胸腔和骨转移。2018年7月5日,进行右髂骨活检:转移性腺癌,原发于乳腺(BRST2+),ER-,PR-,HER2++,FISH+,Ki67:20%。2018年7月12日至2018年7月25日期间,进行姑息性海马保护性全脑照射:30Gy,10次分割 。2018年6月15日开始姑息性TDM-1 (Kadcyla?)200mg治疗。2018年8月30日,进行脑部MRI检查:疾病缓解,右额叶最大病灶缩小至1.12cm。2018年8月31日,进行PET/CT检查:疾病缓解,包括胸腔积液缓解、肺原发灶、淋巴结和骨转移灶缩小并被吸收。治疗过程中仅有轻度不适,未出现显著的骨髓抑制或肝炎。今年SABCS公布了一项研究[4],单中心回顾性分析33例HER2阳性晚期乳腺癌患者,其中10例患者为先前未曾接受过帕妥珠单抗的治疗,13例患者先前接受过帕妥珠单抗的治疗,两组均给予T-DM1后观察ORR、CBR、PFS及OS。结果显示,无论先前是否接受过帕妥珠单抗治疗的HER2阳性晚期乳腺癌患者,后续予以T-DM1治疗,疗效均无统计学差异,耐受性良好,由此也确定HER2阳性晚期乳腺癌一线双靶标准治疗后,T-DM1在HER2阳性晚期乳腺癌二线的标准治疗地位。NSABP B-005研究[5]也对T-DM1在既往接受过曲妥珠单抗+帕妥珠单抗治疗的HER2阳性晚期乳腺癌患者进行疗效评价,结果显示双靶后接受T-DM1治疗仍有较高的临床有效率,ORR达到43%(CR 17%,PR 26%)。2018年12月28日该患者将开始下一个周期治疗。目前使用TDM-1后PFS已达6个月,疾病仍控制良好,毒副反应可耐受,持续获益中。
该病例提示:对于局部晚期HER2阳性乳腺癌患者应该强调抗HER2治疗重要性,目前帕妥珠单抗亦已在中国获批,应当尽早选择曲妥珠单抗+帕妥珠单抗+化疗的双靶方案;对于双靶方案治疗进展的病例,后续可以选择T-DM1治疗,仍可获得较好的临床控制,给患者带来生存获益。持续的抗HER2治疗是HER2阳性晚期乳腺癌治疗的关键。
作者:梁广泉
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
小提示:本篇资讯需要登录阅读,点击跳转登录




#抗Her2治疗#
47
#HER2阳性#
32
#乳腺癌患者#
39
学习了,谢谢分享。
92