最全综述:卵巢上皮性肿瘤的分子检测与亚型分类
2024-09-28 苏州绘真医学 苏州绘真医学
这篇综述的目的是概述卵巢癌亚型细分中重要的特定遗传因素、临床疾病状态和微观队列。
卵巢癌包括多种实体,适当的亚型细分是妇科病理诊断的主要目标之一。多年来,卵巢癌列表中增加了几种新实体。此外,最近在新和“旧”卵巢癌发病机制方面的进展使得辅助检测得以发展,这对于亚型细分和预后都很重要。外科病理专家必须吸收卵巢癌的这些新发现,完善其基于形态学的诊断技能。这篇综述的目的是概述卵巢癌亚型细分中重要的特定遗传因素、临床疾病状态和微观队列。
研究背景
自 1973 年世界卫生组织 (WHO) 女性生殖道肿瘤分类的初始版本发布以来,女性上生殖道上皮性肿瘤的分类已发生了重大变化。最初是基于苏木精和伊红 (H&E) 组织形态学,按其假定的器官/组织进行分类,现在已经转变为结合 H&E 形态学、肿瘤细胞免疫表型和分子数据的综合过程。
卵巢癌包括一组异质性肿瘤,准确分类对于临床管理至关重要。大多数卵巢癌可以通过组织形态学和明智使用免疫组化 (IHC) 进行适当细分。在某些情况下,可以通过分子遗传学检测来完善诊断。根据最新版 WHO 女性生殖道肿瘤分类(2020 年),卵巢癌包括以下亚型:低级别浆液性癌 (LGSC)、高级别浆液性癌 (HGSC)、黏液性癌 (MOC)、子宫内膜样卵巢癌 (ENOC)、透明细胞癌 (CCC)、癌肉瘤 (OCS)、恶性Brenner瘤 (MBT)、中肾样癌、未分化/去分化癌 (UC/DC)、混合性癌和高钙血症型小细胞癌 (SCCHT)。大多数卵巢癌为浆液性、黏液性、子宫内膜样或透明细胞,HGSC 是目前最常见的亚型。
在介绍卵巢癌的不同亚类之前,了解几个关键概念很重要,包括在某些类型的 EOC 的发病机制中发挥重要作用的特定基因、遗传性疾病和/或疾病状态(例如子宫内膜异位症)。
关键概念
TP53
肿瘤蛋白 p53 (TP53; 17p13.1) 基因编码 p53 调节蛋白,一种肿瘤抑制因子,通过防止突变在基因组的维持和稳定性中发挥着广泛的作用。它是人类癌症中最常见的突变基因,突变可能发生为体细胞起源,或者较少情况下是遗传的。p53 蛋白通过激活 DNA 修复蛋白、在 G1/S 调节点处停止细胞生长、启动细胞凋亡和细胞衰老来参与细胞周期的调节/进展。TP53 胚系突变与 Li-Fraumeni 综合征 (LFS) 有关,这是一种常染色体显性遗传的癌症易感综合征。据报道,LFS 患者发生的妇科肿瘤包括卵巢和子宫内膜 HGSC。尽管广泛的 TP53 突变导致 LFS,但并非所有临床 LFS 患者都检测到 TP53 突变。
在妇科肿瘤中,p53 突变发生于多种肿瘤类型,包括非人乳头瘤病毒 (HPV) 相关鳞状细胞癌、一部分高级别子宫内膜癌以及卵巢/输卵管/腹膜高级别癌,如 HGSC 和 OCS。从诊断病理学的角度来看,免疫组化 p53 表达已通过 p53 串联分子遗传学检测得到完善,导致了被认为异常并与基因突变相关的 p53 免疫染色模式。随着 p53 IHC 经验的积累,它现在被认为是确定肿瘤 p53 突变状态的可靠辅助手段。一般而言,缺乏 TP53 突变的肿瘤表现出异质性核 p53 表达,染色强度范围从无、弱到强。被认为可以预测潜在 TP53 突变的异常 p53 模式包括弥漫性核过表达、核表达完全缺失 (Null) 和仅有细胞质染色。
BRCA1、BRCA2和PALB2
BRCA1/2 相关遗传性乳腺癌和卵巢癌综合征是一种常染色体显性遗传的癌症综合征,由 BRCA1 和 BRCA2 基因的胚系突变引起。尽管这些蛋白质在结构上无关,但都具有肿瘤抑制功能,并且遗传到突变等位基因会使患者容易发生野生型等位基因体细胞失活。BRCA1 和 BRCA2 突变会增加患者罹患乳腺癌、卵巢癌、输卵管癌和原发性腹膜癌以及子宫内膜癌的风险。BRCA1 和 BRCA2 都参与基因组稳定性,通过形成 BRCA1-PALB2-BRCA2 复合物,与 RAD51 重组酶相互作用,这是修复受损 DNA 的重要步骤。BRCA1 和 BRCA2 胚系突变患者罹患卵巢癌的绝对风险分别为 40-65% 和 15-25%,比散发病例早发生约十年。这些突变约占所有卵巢癌病例的 10%。
BRCA1 胚系突变患者通常发生卵巢/输卵管/腹膜 HGSC,但也有其他亚型的报道。在 BRCA 突变携带者的风险降低输卵管切除标本中,5-10% 出现浆液性输卵管上皮内癌 (STIC) 病变,经彻底检查后通常位于远端输卵管。BRCA1 胚系突变患者的 HGSC 往往表现出“实性、子宫内膜样和移行细胞样”(SET)形态,可能解释了之前报道的卵巢“移行细胞癌”病例。具有 SET 形态的 HGSC 还与肿瘤浸润淋巴细胞 (TIL) 和坏死有关。BRCA2 的伴侣和定位子 (PALB2) 编码 PALB2,这是一种与 BRCA2 共定位的蛋白质,对通过 RAD51 进行 DNA 修复至关重要。胚系 PALB2 突变会增加罹患卵巢癌 (RR,2.91) 和乳腺癌 (RR,7.18) 的相对风险,并且与 BRCA1 突变患者一样,癌症通常表现为由 STIC 病变发展而来的 HGSC。
微卫星不稳定性 (MSI) 和林奇综合征 (LS)
林奇综合征(以前称为遗传性非息肉病性结直肠癌综合征)是一种常染色体显性遗传的遗传性癌症综合征,由至少一个错配修复 (MMR) 基因的胚系突变引起:MLH1 (3p22.2)、MSH2 (2p21)、MSH6 (2p16.3)、PMS2 (7p22.1)、EPCAM (2p21) 和/或少数情况下 MSH1。LS 患者占遗传性卵巢癌病例的 2-15%,罹患卵巢癌的终生风险是普通人群的 4-6 倍。LS 的分子遗传学非常复杂,但一般来说,基因编码的蛋白质作为肿瘤抑制因子,而遗传到 MLH1、MSH2、MSH6 和 PMS2 的胚系突变形式会增加野生型等位基因失活的风险,从而导致 DNA 合成过程中 MMR功能缺陷 (dMMR)。MMR 蛋白形成异二聚体(MSH2 与 MSH6 以及 MLH1 与 PMS2),第一个伴侣的丢失会导致第二个丢失。dMMR 会导致短串联重复 DNA 序列(微卫星)的异常复制,从而导致 MSI 现象。然而,LS 引起的 MSI 仅占肿瘤 dMMR 的一小部分(最多 20%)。相反,MSI 更常由散发性基因表观遗传改变(通常是 MLH1 启动子高甲基化)造成。dMMR 癌症被认为是“超突变”的,因为微卫星中碱基的插入、点突变和缺失不断积累。插入和缺失可能导致蛋白质编码区的移码突变,从而导致具有免疫原性的肿瘤新抗原的表达,这被认为是 H&E 中 TIL 存在的原因。妇科恶性肿瘤通常是 LS 患者的哨兵癌,约 60% 的患者在患上结直肠癌之前发生这类肿瘤。在与 LS 相关的妇科癌症中,子宫内膜样癌、透明细胞癌和未分化癌最为常见,而浆液性癌则不常见。
在子宫内膜癌和卵巢癌中,MMR 功能检测基本上已成为标准治疗方法,尤其是对于非浆液性亚型患者。目前,筛查子宫内膜癌 dMMR 的首选方法是MLH1、MSH2、MSH6 和 PMS2 IHC 检测 (尽管关于是否也应进行 MSI 检测存在争议)。同样,IHC 也已成为筛查卵巢癌 LS 的首选检测。所有四种蛋白的强核表达与微卫星稳定性 (MSS) 相关,而核表达的缺失与 MSI 相关。表达缺失的模式对于选出病例进行额外检测很重要,因为突出了最有可能异常的基因。在大多数情况下,MLH1 和 PMS2 表达缺失提示 MLH1 异常,最有可能是由于 MLH1 启动子体细胞高甲基化,而 MSH2 和 MSH6 表达缺失通常与 MSH2 突变相关。充分的内部对照染色至关重要,特别是在缺失一种或多种 MMR 蛋白的情况下。与子宫内膜癌一样,可能出现异常/模棱两可的染色模式(例如 MMR 蛋白表达的局部缺失),可能提示异质性高甲基化、存在非胚系突变,或 POLE 突变。
PTEN
磷酸酶和张力蛋白同源物 (PTEN, 10q23.3) 编码 PTEN 蛋白,一种肿瘤抑制因子,通过将 PIP3 去磷酸化为 PIP2 来抑制 PI3K-AKT-mTOR 通路,从而调节与细胞生长、存活和迁移有关的细胞过程。在包括卵巢癌在内的多种肿瘤中发现 PTEN 功能缺失,异常情况存在差异,包括移码和点突变。PTEN 胚系突变是 Cowden 综合征(也称为 PTEN 错构瘤综合征)和 Cowden 样综合征最常见的原因。从诊断的角度来看,PTEN IHC 可能有助于对癌症进行亚型分析,因为在许多 ENOC 和 CCC 中观察到了 PTEN 表达缺失。卵巢癌其他亚型中 PTEN 缺失频率是一个活跃的研究领域。在一项研究中,26%(62 例中的 16 例)的 HGSC 病例 IHC 显示 PTEN 缺失。
KRAS
GTP 结合蛋白的 RAS 家族参与多种信号通路,包括与细胞生长、分化、存活相关以及其他由受体酪氨酸激酶(例如 TGFα 等生长因子)触发的信号通路。KRAS 基因 (12p12.1) 编码 K-Ras,这是一种将 GTP 转化为 GDP 的 GTPase,是 RAS/MAPK 通路的一部分。KRAS 是一种原癌基因,致癌突变通常会导致蛋白质的组成性过度活性。KRAS 突变见于各种卵巢交界性肿瘤和癌,主要是黏液性、低级别浆液性和子宫内膜样,但有时也见于透明细胞和高级别浆液性亚型。诊断方面,KRAS 突变检测在肿瘤亚型分类中并不是特别有用;但是,可以出于治疗目的或为了入组临床试验进行该检测。
ARID1A
ARID1A 基因 (1p35.3) 编码富含 AT 交互结构域的蛋白 1A 蛋白,也称为 BAF250a 或 p270。ARID1A 蛋白是开关/蔗糖非发酵 (SWI/SNF) 染色质重塑复合物的亚基之一,参与基因表达的表观遗传调控。ARID1A 与癌症相关,较为复杂,根据具体情况,它可能起到肿瘤抑制因子的作用或在肿瘤发生中发挥作用。在妇科癌症以及推定的前体病变(如非典型子宫内膜异位症)中,ARID1A 起到肿瘤抑制因子的作用,突变发生于高达 57% 的卵巢透明细胞腺癌和 30% 的卵巢子宫内膜样癌。ARID1A 突变通常是截短突变,导致免疫组化表达缺失。ARID1A 突变可能与 PI3K/AKT 突变同时发生,而在 TP53 突变肿瘤中往往不会观察到。
ARID1A 蛋白表达免疫组化检测可及,可用于诊断,并且已用于帮助评估子宫内膜增生病例的异型性。非典型子宫内膜增生 IHC 检测显示 ARID1A 表达缺失似乎与子宫切除标本中存在子宫内膜样子宫内膜癌相关。然而,在一个病例系列中,仅 16% 的非典型子宫内膜增生病例发生 ARID1A 缺失。目前尚不清楚子宫内膜异位症相关卵巢癌中 ARID1A 突变的预后意义。
PI3K/AKT1/mTOR
AKT1 基因编码 AKT 丝氨酸/苏氨酸激酶 1 (AKT1),一个 AKT 蛋白激酶家族成员。AKT1 蛋白包括丝氨酸/苏氨酸特异性激酶结构域、N 末端结构域和 C 末端调节结构域。AKT1 和其他 AKT 蛋白激酶家族成员被磷酸肌醇 3-激酶 (PI3K) 磷酸化。磷酸化会导致活化并影响许多涉及膜结合受体酪氨酸激酶的信号通路。PI3K 蛋白是一种异二聚脂质激酶,由调节 (p85) 和催化 (p110α、PIK3CA) 亚基组成,后者由 PIK3CA 基因编码。PI3K 的激活导致磷脂酰肌醇 4,5 二磷酸 (PIP2) 磷酸化为磷脂酰肌醇 3,4,5 三磷酸 (PIP3),进而驱动多种下游细胞功能通路,包括由 AKT 调控的通路,例如参与细胞凋亡和细胞周期进展的通路。哺乳动物雷帕霉素靶蛋白 (mTOR) 是一种蛋白质,它结合到两种复合物中,即哺乳动物雷帕霉素靶蛋白复合物 1 (mTORC1) 和哺乳动物雷帕霉素靶蛋白复合物 2 (mTORC2),前者在细胞生长和代谢中发挥作用,而后者参与细胞增殖和存活。mTORC1 和 mTORC2 参与多种在肿瘤发生中起重要作用的信号转导通路,包括 PI3K/AKT,最终在调节细胞凋亡、生长和自噬中发挥作用。mTORC1 过度激活可导致肿瘤增殖、组织侵袭和转移,而 mTORC2 可调节 mTORC1 的表达。
CDKN2A
CDKN2A 编码两种主要蛋白质 p16 (p16INK4a) 和 p14arf,它们均起肿瘤抑制因子的作用。p16 通过阻止 Rb 的磷酸化来帮助调节 G1 到 S 的转变,进而阻止转录因子 E2F1 的释放。在妇科病理诊断中,p16 的意义通常仅限于 HPV 相关病变和癌;然而,CDKN2A 突变见于大多数卵巢黏液癌(在一项研究中,48 例病例中的 76%),可能代表癌变早期事件。在黏液性卵巢肿瘤中,有人提出肿瘤发生始于 CDKN2A 或 KRAS 突变(黏液性囊腺瘤);然后,在黏液性交界性肿瘤中观察到 CDKN2A、KRAS 和拷贝数变异;再后来疾病的进展与获得 TP53 突变以及更多的拷贝数变异有关。
SWI/SNF
哺乳动物开关/蔗糖非发酵 (SWI/SNF) 染色质重塑复合物包含多个亚基。SWI/SNF 复合物的总体功能是作为肿瘤抑制因子。由于对 SWI/SNF 缺陷型肿瘤的临床病理特征的研究进展迅速,不同实体的分类一直不一致。目前,在妇科病理学中具有最重要临床意义的基因是 SMARCA2(编码 BRM)、SMARCA4(编码 BRG1)、SMARCB1(编码 INI1)和 ARID1B(编码 BAF250B)。SWI/SNF 缺陷型卵巢肿瘤包括未分化/去分化癌,高达 70% 的病例与 SMARCA4、SMARCB1、ARID1A 和 ARID1B 缺陷有关,以及卵巢高钙血症型小细胞癌 (SCCOHT),几乎所有病例都与 SMARCA4 突变有关。未分化/去分化癌也可能表现出 BRM(由 SMARCA2 编码)的缺失,但这通常与 BRG1/SMARCA4 缺失有关。已经开发了 IHC 标记物来帮助识别 SWI/SNF 缺陷病例,其使用在诊断上非常有用。
CTNNB1
Catenin beta-1 (CTNNB1) 编码 β-catenin 蛋白,它是参与 Wnt 信号通路信号转导的钙粘蛋白复合物的亚基。因此,该基因在细胞间粘附中很重要。CTNNB1 突变已在多种肿瘤中发现,包括纤维瘤病、胰腺实性假乳头状肿瘤和妇科肿瘤,尤其是子宫内膜样癌。CTNNB1 是一种原癌基因,大多数突变赋予对 β-catenin 降解的抗性,导致 β-catenin 易位到细胞核以及靶基因转录。在诊断上,β-catenin IHC 可用于辅助一些妇科肿瘤的亚分类,尤其是子宫内膜样肿瘤,CTNNB1 突变的肿瘤通常显示细胞核 β-catenin 表达。然而,在对 β-catenin IHC 的解释中存在一定的细微差别,因为免疫染色通常是异质的,一些病例显示强烈的细胞质和膜表达,这可能会使识别真正的核染色变得复杂。此外,CTNNB1 突变可能对子宫内膜样癌具有预后意义。然而,这一点存在争议,特别是在子宫内膜原发癌中。
POLE
DNA 聚合酶 ε (POLE) 参与核 DNA 的复制,并通过内在的核酸外切酶活性纠正 DNA 合成中的错误。它由四个亚基组成,最大的亚基由 POLE 基因编码,包含催化和核酸外切酶功能。POLE 通过纠正 DNA 合成过程中的异常碱基对替换,在防止基因组不稳定性方面发挥着重要作用。在核酸外切酶域中发生体细胞 POLE 突变的肿瘤具有异常的 DNA 校对,导致“超突变”肿瘤,具有大量碱基替换、高级别组织形态(包括浆液样成分)和 TIL。在子宫内膜癌中会进行 POLE 突变检测,但在输卵管卵巢和腹膜癌中并不常规进行检测。
子宫内膜异位症
子宫内膜异位症是一种常见的妇科疾病,影响 6-10% 的育龄女性。由于子宫内膜异位症也会随着激素变化而循环,因此它常常会导致炎症,临床表现为痛经、性交困难、不孕和腹盆腔疼痛。几十年来,人们观察到某些肿瘤(通常是透明细胞腺癌,随后是子宫内膜样癌)在子宫内膜异位症的背景下出现或与同时性子宫内膜异位症有关。在过去的 10-15 年里,子宫内膜异位症越来越多地被视为癌前病变或“前体”病变,因为非典型子宫内膜异位症可能携带 ARID1A 和 PI3K/AKT 通路基因突变。子宫内膜异位症也可能与其他亚型的卵巢癌有关,例如低级别和高级别浆液性癌,以及子宫内膜样癌的“浆黏液性”亚型。
腹膜假黏液瘤 (PMP)
PMP 是一个临床术语,用于描述腹腔内黏液物质的现象。卵巢黏液性肿瘤的早期报告包括出现 PMP 的患者。多年来,已确定大多数肿瘤通常位于卵巢外,主要来自阑尾。继发于结肠直肠、脐尿管、胰腺和胆囊的黏液性肿瘤的 PMP 也有报道。尽管罕见,但继发于畸胎瘤环境下卵巢黏液性肿瘤的 PMP 也有报道;在这些情况下,分子遗传学证据表明卵巢黏液性肿瘤(具有肠道分化)与成熟囊性畸胎瘤之间存在克隆关系。
PMP 的分类也经历了许多变化和迭代。2022 年 WHO 女性生殖系统肿瘤分类引入了 PMP 组织学分类和分级标准。简而言之,(A) 如果 PMP 检查仅发现黏蛋白而没有肿瘤细胞,则该病例可归类为“无细胞黏蛋白”;(B) 如果有由低级别黏液上皮组成的低细胞黏液沉积物,“腹膜假黏液瘤,1 级”;(C) 如果沉积物细胞多,包括黏液上皮(>10% 为高级别),并显示浸润型侵袭,“腹膜假黏液瘤,2 级”;(D) 如果发现具有印戒分化或肿瘤细胞呈片状排列的黏液性肿瘤沉积物,“腹膜假黏液瘤,3 级”。分级通常与原发性肿瘤相关。低级别或高级别 PMP 中的黏液上皮通常含有 KRAS 突变。高级别病例显示更高的肿瘤突变负荷和其他突变,包括 TP53。最后,分级将患者分为预后组。低级别肿瘤和完全肿瘤细胞减灭术的患者预后最好(59-170 个月)。PMP 的治疗包括去除原发病因以及肿瘤细胞减灭术和腹腔内化疗。建议将 PMP 患者转诊至专门的中心进行治疗。
高级别浆液性癌 (HGSC)
目前,在全球,HGSC 占大多数卵巢癌病例(70-80%)以及卵巢癌死亡病例。大多数患者为绝经后患者(平均 65 岁);但年龄范围很广。不幸的是,卵巢 HGSC 的体征和症状多样且通常不具特异性,因此,高达 80% 的 HGSC 患者通常诊断时为 FIGO III 期(盆腔外疾病和/或腹膜后淋巴结转移)或 IV 期疾病(远处转移)。血清 CA 125 在高达 80% 的患者中升高,与 LGSC 一样,用于监测治疗反应或可能的复发。
10% 的卵巢癌患者存在 BRCA1 或 BRCA2 胚系突变,这是发生卵巢癌的最强遗传风险因素,其中绝大多数是 HGSC。TP53、PALB2 和 PTEN 胚系突变患者发生 HGSC 的风险也增加。RAD51C/D 胚系突变也会增加罹患卵巢癌的风险,但尚不清楚是否包括 HGSC 亚型。
卵巢、输卵管和原发性腹膜 HGSC 的起源细胞基本上是输卵管,起源于前体病变 (STIC)。卵巢、输卵管或腹膜 HGSC 的 FIGO 和 AJCC 分期是相同的,无论具体原发部位如何,因为具有共同的临床病理特征。有确定 HGSC 起源部位的指南;简而言之,只有当两条输卵管都完好无损且广泛检查未识别任何 STIC 或黏膜 HGSC 时,才认为肿瘤是卵巢原发性的。
形态学上,HGSC 由一群具有高核质比、囊泡染色质和显著核仁的高度多形性细胞组成。多核或完全间变性特征并不罕见。有丝分裂像,包括非典型形式,很明显(通常 >5 个有丝分裂/10 HPF)。结构上,HGSC 可以表现出各种模式,通常是组合的,包括乳头状、实性或腺状;在实性生长的病例中,通常存在裂缝或裂缝状空间,类似于穿过肿瘤的闪电。在具有胚系 BRCA1/2 突变的患者中,HGSC 可以显示实性、子宫内膜样和移行细胞 (SET) 生长模式,可能解释以前被归类为“卵巢移行细胞癌”的病例。罕见的形态亚型包括印戒状和具有透明细胞质的细胞。通常存在钙化,包括砂砾样钙化。
免疫表型上,大多数 HGSC 对 CK7、PAX8、MOC31、BerEP4 和 WT1 呈强阳性(图 1)。p53 IHC 几乎总是异常的,与 TP53 异常的存在相关。尽管诊断不需要异常的 p53 表达,但 p53 的野生型免疫染色模式应促使病理专家在鉴别诊断中考虑其他实体。大多数 HGSC 病例还表现出强烈、弥漫性细胞质和细胞核 p16 免疫染色。HGSC 通常对 CK20 和 Napsin A 呈阴性,并且通常保留 PTEN 核表达。ER 表达通常是斑片状或阴性的。Calretinin 和 D2-40 IHC 通常为阴性,尽管在某些情况下观察到局部染色。HGSC 通常对 Claudin-4 呈强阳性。在 HGSC 中 CA-125 IHC 通常呈阳性;然而,由于它不具特异性,很少有助于解决鉴别诊断。
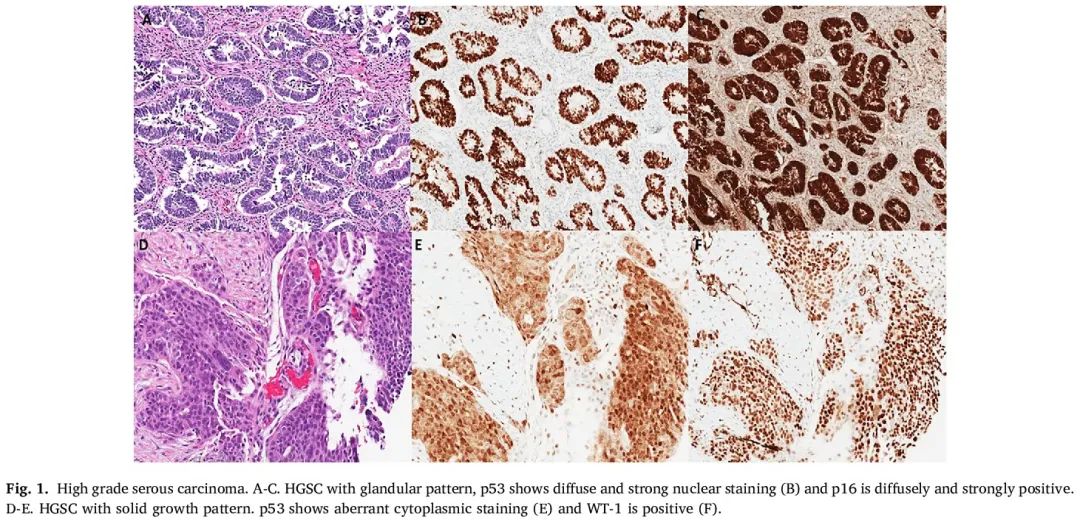
图1
对卵巢 HGSC 前体病变的认识改变了大多数 EOC 的发病机制,并将焦点转移到远端输卵管作为原发部位。STIC 被认为是输卵管癌最早可识别的形态学特征。在常规标本中发现 STIC 的频率估计非常低 (< 1%)。超过 90% 的 STIC 具有 TP53 突变,这进一步证明了 TP53 基因突变是 HGSC 的早期事件这一理论。STIC 病变集中在输卵管远端,包括伞端。形态学上,STIC 由一群深染细胞组成,通常是分层的,没有散在的纤毛细胞。这些细胞具有较高的核质比,并且具有核异形性,其特征是核增大、染色质粗、核仁明显和核极性缺失。可能存在有丝分裂像。辅助检测,尤其是 p53 和 Ki-67 IHC,对于确立诊断至关重要,因为如果仅依靠形态学,观察者之间的差异性很大。STIC 中的非典型细胞显示异常的 p53 表达,通常为强/弥漫性核染色,少数情况下完全没有染色。与非非典型输卵管上皮相比,Ki-67 标记增加,Ki-67 阳性非典型细胞的百分比为 40% 至 95%。在一种常用的 STIC 病变分类算法中,当满足以下所有标准时,可诊断为 STIC:细胞异形性、异常 p53 IHC 表达和 Ki-67 阳性细胞 >10%。在 Ki-67 阳性细胞 <10% 的病变中,提出了“浆液性输卵管上皮内病变”。有趣的是,随着 IHC 越来越多地用于评估潜在的 STIC 病变,在远端输卵管的“背景”非典型分泌细胞中,异常 p53 表达的情况越来越多。在诊断上使用术语“p53 特征病变”。孤立性 STIC 病变的临床意义有限;然而,5–11% 的女性在 2.7 至 6.0 年后患上腹膜癌,但 STIC 患者患上 HGSC 的相对风险尚不清楚。STIC 患者的治疗可能包括盆腔/腹膜冲洗和腹膜分期,尽管不同机构之间可能存在显著差异。
诊断时的分期和手术期间减瘤的程度是最重要的预后因素。HGSC 患者的新治疗方案是一个活跃的研究领域,因为患者诊断时通常处于高分期,五年生存率较低。聚(ADP-核糖)聚合酶 (PARP) 抑制剂通常用于 HGSC 患者,包括具有胚系 BRCA1/2、体细胞 BRCA1/2 突变或没有突变的患者。同源重组缺陷 (HRD) 检测也可以在 HGSC 患者中进行,因为 20% 的没有 BRCA 突变的患者可能存在对 PARP 抑制剂敏感的缺陷。
FIGO III 期或 IV 期患者是术前新辅助化疗的候选者,尤其是在无法实现最佳肿瘤细胞减灭术时。卵巢 HGSC 的病理化疗反应评分 (CRS) 已被提出并用于网膜切片(不包括其他部位(包括卵巢)的反应模式)。根据具体评分,它具有中等可重复性和患者预后分层。简而言之,评分由网膜转移对化疗的反应决定:当没有反应或反应很小时使用 CRS1;如果肿瘤反应明显但肿瘤存活,则使用 CRS2,很容易识别;如果完全或接近完全缓解,则使用 CRS3。
HGSC 的鉴别诊断包括 LGSC、ENOC、CCC、腹膜间皮瘤、子宫内膜原发 HGSC 转移以及非女性生殖道原发肿瘤转移(例如肺、乳腺)。
低级别浆液性癌 (LGSC)
LGSC 并不常见,约占所有卵巢癌的 5%,年发病率为 1.8 - 5.5/10万女性。患者的年龄范围很广(中位 40-50 岁),其中三分之一的患者年龄小于 40 岁。该疾病的症状包括单侧/双侧实性囊性卵巢肿块,伴或不伴腹水。大多数患者因肿块效应而出现症状(例如盆腔腹部饱胀、慢性疼痛等)。然而,高达 14% 的患者可能无症状,偶然发现疾病。血清癌抗原 (CA)-125 可能升高,治疗期间测量 CA-125 水平具有预后意义。LGSC 中最常见的突变涉及 KRAS 和 BRAF。
形态学上,LGSC 代表具有轻度至中度的细胞核异形性的管型上皮细胞的分层增生。结构上,这些细胞排列成层状分支、宽基乳头状突起,并经常形成小芽、簇或微乳头(图 2)。一部分细胞应具有发育良好的顶端纤毛。极少数情况下,可能存在其他细胞类型,例如非肠黏液细胞,但它们应该不显著。鳞状分化,尤其是桑葚样分化,不是 SBT 或 LGSC 的特征,如果存在,病理专家应将其归类为不同类型的肿瘤。微钙化(通常为砂砾样)很常见。LGSC 中的有丝分裂指数范围为 1 至 12 个有丝分裂/10 HPF(平均 4/10 HPF)。可能存在表面受累,通常为赘生物或结节的形式,这对于分期很重要。卵巢外侵袭性植入通常涉及大网膜、腹膜表面、盆腔/腹部器官的浆膜表面以及盆腔/主动脉旁淋巴结。尽管明确的破坏性间质侵袭是 LGSC 的最重要特征,但 2014 年或 2020 年 WHO 分类中并未明确列出间质侵袭的确切数量。这几乎肯定是因为卵巢外种植的重要性,因为浸润性种植是任何低级别浆液性肿瘤最重要的预后特征,并且如果存在,会显著降低患者的总生存率和无病生存率。当破坏性侵袭在低倍镜下很容易观察到时,浸润性种植的预后意义最为明显。因此,如果观察到卵巢外浸润性种植,即使原发性病变是 SBT,疾病过程也会与 LGSC 相似。
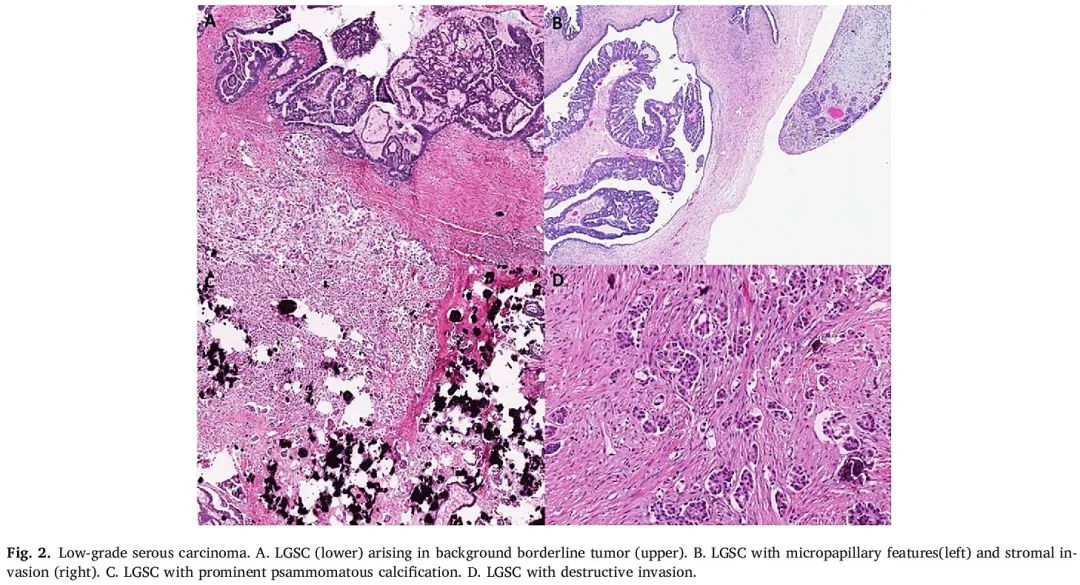
图2
LGSC 和 SBT 的免疫组化特征相同:大多数肿瘤对 MOC-31、BerEP4、角蛋白 (CK) 7、PAX8、雌激素受体 (ER) 和 WT1 呈阳性;显示斑片状 p16 阳性和野生型 p53 表达模式。p53 IHC 在区分低级别和高级别浆液性癌方面尤为重要,因为几乎所有 HGSC 都具有异常 p53,与突变一致。
LGSC 的鉴别诊断包括浆液性交界性肿瘤 (SBT)、HGSC 和间皮增生(反应性和肿瘤性)。即使对于经验丰富的妇科病理专家来说,区分 LGSC 与 SBT 也可能很困难,诊断可能部分取决于卵巢外种植(如果存在)是“浸润性”还是“非浸润性”。SBT 和 LGSC 的诊断标准随着时间的推移而演变:在 2014 年 WHO 肿瘤分类中,具有显著上皮生长(即连续范围内微乳头状和/或筛状生长≥ 5 mm)的 SBT 被指定为“SBT,微乳头/筛状亚型”或“非浸润性 LGSC”。在 2020 年 WHO 分类中,不建议使用“非浸润性 LGSC”作为诊断术语,并且SBT 微乳头/筛状亚型无论有无间质微浸润(微浸润定义为浸润 <5 mm)都不应归类为低级别癌。此外,建议将“浸润性种植”替换为“转移性 LGSC”。大多数 HGSC 病例可以通过存在高级别核特征而易与 LGSC 区分。此外,虽然这两种肿瘤通常都具有乳头状细胞结构,但 HGSC 可以形成实性片状。如果对浆液性肿瘤是低级别还是高级别有任何疑问,p53 IHC 非常有用。最后,HGSC 显示强、融合 p16 表达,而 ER 表达在 LGSC 中通常比 HGSC 更强。LGSC 和间皮病变可能表现出相当大的组织学和免疫表型重叠,特别是考虑高分化或“低级别”间皮病变时。这两种实体均由具有低级别核异形性的细胞组成,可形成包括微乳头在内的乳头状细胞结构,与砂砾样钙化有关,并且经常涉及盆腔器官表面。然而,大多数 LGSC 病例显示具有顶端纤毛的细胞,这是间皮病变所没有的特征。LGSC 的细胞也往往是分层的或至少是假分层的,而高分化/低级别间皮病变通常由单层扁平立方形细胞组成。免疫表型上,高分化/低级别间皮增生通常对 CK5/6、CK7、钙网蛋白、D2-40 和 WT-1 呈阳性,而对 ER 几乎总是呈阴性,后者在区分 LGSC 与间皮病变方面非常有用,即使在少量标本中也是如此。在 LGSC 中可以看到钙网蛋白阳性,这可能会使鉴别诊断复杂,但是,钙网蛋白染色在 LGSC 中通常是局灶性的,而在间皮细胞中则更为弥漫性。PAX8 表达对浆液性癌不具有特异性。良性和反应性间皮增生可能对 PAX8 呈阳性(在一个病例系列中,25 例中有 8 例),高达 61% 的高分化乳头状间皮瘤 (WDPM) 也呈阳性。
与 HGSC 相比,LGSC 的临床病程更为缓慢。虽然 LGSC 和 HGSC 通常起源于不同的生物学途径,但也有少数LGSC 进展为 HGSC 的报道。当局限于卵巢时,其预后良好。然而,与 HGSC 一样,LGSC 通常诊断时处于晚期,因此长期预后不佳。治疗的主要手段是最大程度的肿瘤细胞减灭术,以实现最小残留病灶。晚期患者通常使用化疗和内分泌治疗形式的辅助治疗。LGSC 对化疗的反应通常不如 HGSC,更有效的治疗方法是一个活跃的研究领域。在无法进行初始手术的 LGSC 患者中,通常不使用新辅助治疗。基于形态学、免疫组化和分子证据,低级别和高级别浆液性癌被认为是浆液性癌变的两种不同途径。
卵巢子宫内膜样癌 (ENOC)
ENOC 约占原发性卵巢癌的 10%。与 HGSC 不同,大多数 ENOC 患者诊断为 FIGO I 期疾病(肿瘤局限于卵巢,未累及表面);因此,生存率相对较高。ENOC 患者的临床表现与其他类型的卵巢肿块患者相似:体征和症状通常不明显(例如盆腔/腹部疼痛或压迫感、出血),如果出现,通常提示晚期疾病,或者完全没有。很大一部分 ENOC 发生于子宫内膜异位症患者,在出现疑似子宫内膜异位症体征和症状的患者中,可能在诊断检查期间“偶然”发现卵巢肿块。CA-125 和 CA 19-9 都可能升高,尤其是在伴有子宫内膜异位症的情况下。由于存在共同的突变,无论是否存在细胞学或结构异形性,子宫内膜异位症越来越多地被视为 ENOC 的前体病变。高达 25% 的 ENOC 与子宫内膜子宫内膜样癌同时发生。与子宫内膜子宫内膜样癌一样,降低雌激素暴露的情况(经产和早期绝经)可降低患 ENOC 的风险。在 ENOC 中观察到的基因异常与子宫内膜子宫内膜样癌中的相同,包括 Wnt 信号通路(CTNNB1)、PI3K 通路(PTEN、PIK3CA)、ARID1A、KRAS 和 MMR 蛋白突变。与之前的 2014 年 WHO 分类相比,一个重要变化是删除了“浆黏液性”卵巢癌作为一个独立亚型,因为许多病例可以分为 ENOC 或 LGSC。
ENOC 在形态学和免疫表型上与子宫内膜样腺体一样多变,并且可能是 EOC 中微观异质性最强的。Talia 和 McCluggage 对诊断 ENOC 遇到的诸多挑战进行了出色而深入的概述。大多数 ENOC 病例相对简单,显示子宫内膜样腺体融合增生,没有累及卵巢基质。通常可观察到复杂的筛状结构和迷宫状腺腔。在某些情况下,还有微乳头状腺内丛,在低倍镜下形态学上类似于浆液性病变。与子宫内膜样子宫内膜癌一样,ENOC 可显示明显的实性生长;然而,在大多数情况下,这代表鳞状桑葚样化生。肿瘤细胞通常呈柱状,胞浆嗜酸性,细胞核圆形,核仁明显,核极化消失。可能存在不同数量的输卵管/纤毛细胞、黏液细胞和鳞状分化细胞。结构上,子宫内膜异位症病例通常具有囊性改变,并且可能存在重叠的囊内非典型增生。实性病例通常表现出经典的腺纤维瘤/交界性成分,其特征是不典型但较小的子宫内膜样腺体排列成假小叶状,通常伴有明显的鳞状桑葚样化生,并被致密纤维化卵巢基质隔开。存在这两种背景病变之一对于分类高级别 ENOC 病例非常有帮助。
ENOC 的 IHC 通常简单,但有一些例外。在大多数情况下,肿瘤细胞对 CK7、ER、PR(大多数细胞中表达中度至强)和 PAX8 呈阳性。p16 IHC 通常呈斑片状染色。p53 模式通常为野生型。ENOC 通常对 WT1 呈阴性,但在某些情况下(例如具有性索特征的 ENOC)可能呈弥漫性阳性,总体比例难以估计,因为报告包含病例系列。多达 10% 的病例可能 MMR 蛋白表达缺失(通常是 MLH1 和 PMS2,由 MLH1 启动子体细胞高甲基化导致);然而,也观察到了 MSH2 和 MSH6 的缺失,这高度提示为 LS(通常是由于 MSH2 的胚系突变)。具有显著鳞状桑葚体的 ENOC 可以显示出不寻常的免疫表型,其特征是核 β-catenin、CDX-2 和 SATB2 阳性(主要在桑葚体中,但也在一部分肿瘤细胞中);有趣的是,其中一部分病例的 PAX8 检测结果也可能完全为阴性,代表了一个诊断陷阱。
ENOC 的形态亚型并不常见,但在诊断上容易产生误导。“浆黏液性”亚型在低倍镜下可类似 SBT 或 LGSC,因为肿瘤细胞排列在囊肿内的宽基乳头状芽内。然而,浆黏液性 ENOC 由多种细胞类型组成,包括子宫内膜样、非胃肠道黏液性、输卵管/纤毛、鳞状桑葚样和嗜酸性,并且几乎总是在子宫内膜异位症的背景下出现。有趣的是,转移性浆黏液性 ENOC 与在 LGSC 中观察到的“种植”类型非常相似,只是细胞类型多种多样。具有性索样特征的 ENOC(“Sertoliform ENOC”)由立方形至柱状腺细胞组成,这些细胞排列成小梁,腺体形成稀少(有时被黄素化的卵巢基质细胞包围),让人联想到成人颗粒细胞或Sertoli-Leydig肿瘤。可以发生明显的非胃肠道黏液分化,到非常类似于黏液性交接性肿瘤的程度。然而,与卵巢黏液性肿瘤不同,肿瘤细胞缺乏杯状细胞群,与子宫内膜异位症有关,通常对 PAX8 和 ER 呈阳性,但对 CDX-2 呈阴性。在 ENOC 中观察到了纤毛、索状和透明变、角化鳞状、嗜酸性和糖原化亚型。最后,描述了极少数子宫内膜样癌合并生殖细胞肿瘤病例,可能代表具有分化为生殖细胞成分的 ENOC。混合性生殖细胞成分通常表现为卵黄囊瘤,往往缺乏畸胎瘤成分。含有生殖细胞成分的 ENOC 在临床上具有侵袭性,对基于生殖细胞的化疗方案反应不佳。
同时患有子宫内膜子宫内膜样癌的患者在诊断上可能存在问题,因为诊断要么是同时性多原发癌,预期临床病程缓慢,要么是子宫内膜子宫内膜样癌发生卵巢转移,患者预后非常差。形态学、免疫表型甚至分子遗传学检测可能会混淆决策,因为先前诊断为“同时性”多原发癌的病例可能与克隆有关。尽管如此,仍有将患者风险分层为预期临床病程缓慢组的指南:(1) 两个肿瘤均为低级别;(2) 子宫内膜原发灶局限于子宫肌膜内 50%;(3) 未发现淋巴血管侵犯 (LVI)。其他有用的特征包括卵巢表面无受累/多灶性以及卵巢原发灶中存在子宫内膜异位症。最后,ENOC 的分级使用子宫内膜子宫内膜样癌 FIGO 标准。
ENOC 的鉴别诊断范围很广,包括 EOC 的其他主要上皮亚型、子宫内膜样交界性肿瘤、来自不同妇科原发部位的转移以及来自非妇科原发部位的转移。大多数卵巢子宫内膜样癌患者诊断为低分期疾病,预后良好。高级别(FIGO 3 级)ENOC 很难与 HGSC 区分,因为形态学、免疫表型和有时分子遗传特征重叠。鳞状分化和背景子宫内膜异位症在 ENOC 中比在 HGSC 中更常见。肿瘤等级的异质性/存在低级别卵巢成分倾向于基本上子宫内膜样变,而 HGSC(STIC)中的前体病变更局灶性,位于输卵管。强 WT1 和异常 p53 IHC 在 HGSC 中更为常见,而 10-14% 的 ENOC 为 WT1 阳性,约 10% 可显示 TP53 突变,导致 p53 表达异常。如果存在清晰的核染色,β-catenin IHC 可能有帮助,因为至少在 p53 异常子宫内膜癌中,核 β-catenin 免疫染色提示非浆液性组织型,具有高特异性但低灵敏度。类似地,通过 IHC 检测 dMMR 状态支持子宫内膜样癌,但必须谨慎使用,因为这可见于一小部分浆液性癌。
卵巢透明细胞癌 (CCC)
CCC EOC 的比例约为 10% 至 25%。它在亚洲患者(日本15–25 %)中的发病率高于北美患者(10 %),造成这种差异的原因尚不清楚。与 ENOC 一样,CCC 与子宫内膜异位症存在明显的关联。一小部分 CCC 病例发生在透明细胞囊腺纤维瘤或透明细胞交界性肿瘤的背景下。CCC 患者比 HGSC 患者平均年轻约 10 岁(55 岁 vs. 64 岁)。鉴于与盆腔子宫内膜异位症的相关性,卵巢 CCC 的体征和症状可能与 ENOC 相似。与 HGSC 相比,CCC 患者的疾病分期较低(I 期和 II 期)。与一般人群相比,存在子宫内膜异位症时患 CCC 的相对风险增加 2 到 3 倍。同样,与子宫内膜异位症相关的基因异常也见于 CCC。这些包括 SWI/SNF 染色质重塑复合物突变(约 50 % 的病例为 ARID1A;5–18 % 的病例为 SMARCA4)、PI3K/AKT/mTOR 通路突变(50 % 的病例为 PIK3CA 突变,常与 ARID1A 缺失同时出现;10–13 % 的病例为 PTEN;8–26 % 的病例为 AKT2)、MAPK 系统突变(20 % 的病例为 KRAS)和 TP53 突变(8–22 % 的病例)。LS 患者罹患 CCC 的风险增加,但具有胚系 BRCA1/2 突变的患者风险则不是如此。
CCC 可能表现出显著的形态学差异,表现出实性、管状囊性和乳头状结构。然而,在任何一个病例中,单一模式可能占主导地位(图 3)。可能存在砂砾样钙化,但与浆液性亚型患者相比,这种情况较少见。CCC 中的肿瘤细胞较大,呈立方形至多边形。许多 CCC 病例表现出混合细胞,细胞质为光学透明至嗜酸性颗粒状。部分细胞具有胞浆内嗜酸性小球(“透明体”)或偏心核,呈现出印戒状外观。CCC 细胞的细胞核大而圆,具有明显的嗜酸性大核仁。CCC 的一个有用的细胞学特征是存在散在的细胞,这些细胞具有明显深染的细胞核,通常在低倍镜下可见,以及夸张的大头鞋钉状排列(“大头鞋钉状核”或“大头鞋钉状细胞”)。
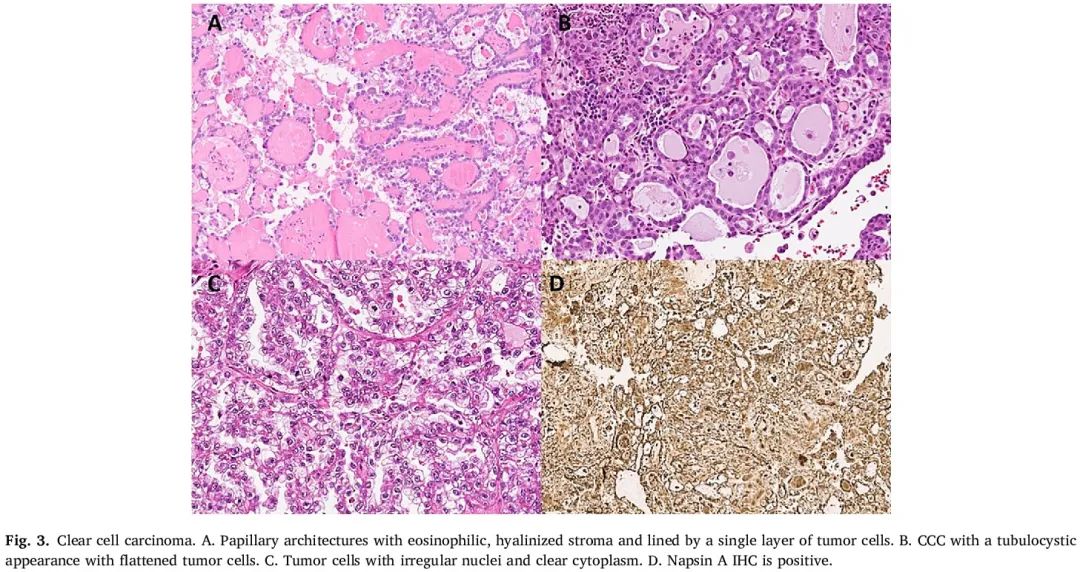
图3
免疫表型上,CCC 对 CK 7 和 PAX8 始终呈阳性,对 WT1 呈阴性。ER 和 PR 通常为阴性或弱且斑片状。在大多数 CCC 病例中可以看到 Napsin A(细胞质)、肝细胞核因子 1β(HNF1β;核)和 α-甲基酰基辅酶 A 消旋酶(消旋酶、AMACR、p504S;细胞质)表达,当观察到所有三种标记物的表达时,这被认为对 CCC 比其他类型更具有特异性。p53 IHC 可以是异常或野生型,p16 在诊断方面没有帮助。与 ENOC 一样,一部分病例 IHC 显示 ARID1A 缺失;然而,这一发现对 CCC 既不灵敏也不特异。
卵巢 CCC 的鉴别诊断包括 HGSC 和 ENOC(特别是具有透明细胞质的病例)、卵黄囊瘤、无性细胞瘤、转移性透明细胞肾细胞癌和卵巢透明细胞交界性肿瘤。一些具有腺体结构的 HGSC 病例可能类似 CCC 的管状囊性模式。然而,在具有乳头状生长的 CCC 病例中,纤维血管区域表现出特征性的嗜酸性透明变性,而 HGSC 病例中没有这种特征。此外,CCC 中的大头鞋钉状生长比 HGSC 更明显。与 ENOC 一样,子宫内膜异位症的存在可能倾向于 CCC 的诊断,但它不是特异性的,必须考虑 HGSC 恰好出现在子宫内膜异位症所涉及的区域。WT1 是区分卵巢 HGSC 与 CCC 的一个有用的 IHC 标记物,因为大多数 CCC 病例的核 WT1 表达为阴性。Napsin A 在 HGSC 中通常为阴性,在 CCC 中为阳性,但是,染色结果可能极难解释,因为许多 CCC 病例不显示弥漫性 Napsin 阳性。
CCC 的治疗包括手术,并根据诊断分期进行辅助化疗和/或放疗。CCC 根据定义为高级别;因此,对低分期疾病患者的辅助治疗存在争议。当诊断为低分期时,卵巢 CCC 预后良好,而 III 期或 IV 期疾病患者的预后不佳。
卵巢黏液性癌 (MOC)
在过去的三十年中,黏液性卵巢癌 (MOC) 的文献和集体经验已被重新评估,因为早期报告可能因包括转移性黏液性癌而受到影响。如果分类得当,MOC 很罕见,约占所有卵巢癌的 3%。由于大多数病例发生在 40-50 岁的患者中,并且仅限于卵巢,因此预后良好。不幸的是,患有卵巢外疾病的真正 MOC 患者预后不佳(据报道 5 年生存率低于 20%)。患者可能出现单侧实性囊性肿块,完全取代卵巢;因此,有症状的患者经常报告盆腔疼痛和压迫感。一些肿瘤是在对其他疾病进行检查时偶然发现的。血清 CA 19-9 可能会升高,尽管它不是特异性的。如上所述,PMP 患者通常有卵巢外原发性肿瘤。
大多数卵巢黏液性肿瘤是良性的(黏液性囊腺瘤或囊腺纤维瘤),其中许多肿瘤有 KRAS 突变。在 MOC 中看到黏液性囊腺瘤和交界性肿瘤的背景区域并不罕见。这也许可以解释 MOC 的发病机制:KRAS 突变的发生可能代表肿瘤发生的第一步,而其他突变和异常的持续积累,如拷贝数增加和 TP53 突变,则可能导致进展为癌症。MOC 与 BRCA1/2 综合征或 Peutz-Jeghers 综合征 (PJS) 无关。MOC 通常很大(约 20 cm),医学文献中有关于一些 MOC 达到惊人大小的报道。仅凭肉眼检查无法将 MOC 与黏液性边界性肿瘤 (MBT) 可靠地区分开来。诊断时应注意双侧卵巢黏液性肿瘤、肉眼表面受累或临床/术中卵巢外肿瘤沉积发现,这些高度怀疑卵巢转移性受累。
诊断 MOC 需要破坏性间质浸润或融合性生长(最大连续维度)≥ 5 mm。多灶性疾病中单个病灶< 5 mm 代表微浸润,不符合“黏液癌”。在这些情况下,在手术病理报告中提及多灶性、病灶数量和大小范围是明智的。侵袭性疾病有两种形式:扩张性/融合性和浸润性。扩张性/融合性模式更常见,其特征是密集的腺体拥挤或迷宫/乳头状结构,中间基质很少或缺失。扩张性/融合性模式的低倍外观在某种程度上让人联想到在某些 ENOC 中观察到的上皮融合类型,包括具有“绒毛管状”结构的 ENOC。破坏性间质浸润的特征是卵巢间质中出现浸润性腺体和/或单个细胞。
MOC 的组织病理学通常显示背景囊腺瘤和 MBT 区域。一般来说,肿瘤细胞具有胃肠道/胰胆管样外观;有些病例有更多肠型细胞和明显的杯状细胞,而另一些病例有类似胃黏液的凹状形态。在后一种病例中,这些在过去可能被指定为“宫颈型”黏液性卵巢肿瘤。囊状空间内衬细胞中可见一系列细胞异型性,从无明显深染和大量顶端粘蛋白的位于基底的柱状细胞核到具有明显核分层、核仁明显且顶端粘蛋白和核极性消失的深染、圆细胞核的细胞(“上皮内癌”)。有丝分裂像通常在细胞异型性较高的区域更容易遇到。卵巢基质内可能存在小的粘蛋白池,尤其是在囊肿破裂的情况下,但剖析粘蛋白(“卵巢假黏液瘤”)应提醒病理专家注意卵巢转移或 PMP 继发性卵巢受累的可能性。偶尔的 MOC 病例显示“附壁结节”。这些是独特、细胞性、边界清晰的实性结节,由上皮样和/或梭形细胞组成,与 MOC 的背景结构截然不同。有时肉眼可见附壁结节,但大多数只能在显微镜下发现。附壁结节有三种组织学“类型”:肉瘤样、肉瘤和间变性癌。最近一项关于附壁结节的重要研究揭示了其发病机制和临床意义,表明附壁结节(包括肉瘤样结节)是与潜在黏液性卵巢肿瘤克隆相关的肿瘤,或许代表一系列可能与不良预后相关的疾病。
在 MOC 中观察到的异质性程度支持对肿瘤进行取样的重要性。具体数量因机构而异,但通常为 1-2 个组织块每cm肿瘤,特别是在肿瘤明显不同或实性的部分。
MOC 必须与转移性卵巢癌区分开来;在某些情况下,需要进行辅助检测。免疫表型上,大多数 MOC 对 CK7 和 CK20 呈阳性,其中 CK7 的表达比 CK20 更强且更弥漫性。CDX-2 表达通常为阳性,但染色程度各不相同。MOC 几乎总是对 ER、PR 和 WT1 呈阴性,尽管一些研究表明 ER 呈斑片状阳性。先前的研究显示,原发性 MOC 中 PAX8 表达的范围很广,从 0 到 70%,特异性高但灵敏度低。SATB2(特殊富含 AT 序列结合蛋白 2)IHC 因其高度特异性,越来越多地被用于帮助区分原发性卵巢黏液性肿瘤与结肠和阑尾转移瘤。IHC 中 p16 的表达几乎从不呈弥漫性或块状。不幸的是,MOC 的经典免疫表型有很多例外。在畸胎瘤背景下出现的 MOC 可以显示出与转移瘤相同的 IHC 特征,包括阑尾和结直肠原发(图 4)。具体而言,具有畸胎瘤背景的 MOC 可以显示出与结直肠腺癌相同的免疫表型(SATB2 和 CK 20 弥漫阳性,CK 7 弱/阴性)。SATB2 和 CDX-2 表达可见于非黏液性卵巢肿瘤,包括子宫内膜样增生。在卵巢黏液性肿瘤中,PAX8 IHC 阳性的情况并不常见,如果出现阳性,病理专家可能会确信黏液性肿瘤是卵巢原发;然而,PAX8 表达既不灵敏也不特异,因为胰腺腺癌和黏液性子宫内膜样肿瘤都可能呈 PAX8 阳性。一般来说,虽然 IHC 可能有帮助,但形态学和临床病史在评估卵巢黏液性肿瘤是原发性卵巢肿瘤还是转移瘤方面仍然很重要。
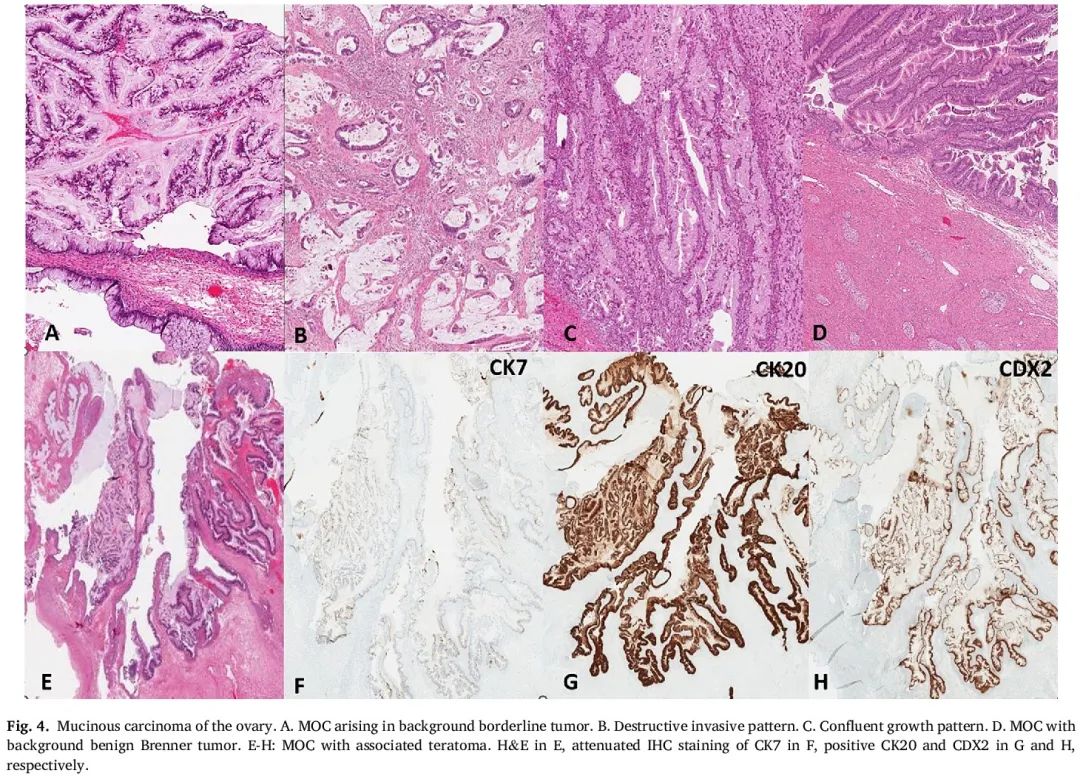
图4
最重要的鉴别诊断实体是癌症转移至卵巢,包括胃肠道、胰胆管、食道、阑尾或宫颈原发性肿瘤转移。其他重要考虑因素包括 MOC 与 MBT、具有黏液分化的 ENOC 以及与性索间质肿瘤相关的异源黏液成分的鉴别。
卵巢癌肉瘤 (OCS)
OCS 是一种双相恶性肿瘤,包含癌性和肉瘤性成分。这是一种罕见的卵巢癌,约占所有病例的 2%。它以前被称为“恶性混合性苗勒氏管肿瘤”或“恶性混合性中胚层肿瘤”,现在基本上被归类为癌,其中化生成分表现为非特异性梭形细胞恶性肿瘤(“同源”分化)或特定肉瘤成分,如横纹肌肉瘤、骨肉瘤和/或软骨肉瘤(“异源”分化)。患者几乎总是绝经后,并出现各种体征和症状。血清 CA-125 经常升高,患者通常诊断为 FIGO III 期疾病。
由于 OCS 的异质性,人们开始关注肿瘤中任何特定的组织学特征是否与预后差异有关。对实性区域进行取样尤其重要,因为这些区域可能为肉瘤成分。癌性成分通常为 HGSC,其次是高级别子宫内膜样癌。肉瘤成分通常表现为同源性和异源性成分的任意混合。异源性成分几乎总是软骨肉瘤和横纹肌肉瘤,少数情况下为脂肪肉瘤和骨肉瘤,并且可以在单个病例中共存。在大多数患者中,卵巢外/转移性疾病表现为癌性成分,通常是 HGSC。有些病例的癌性成分显然是高级别的,但形态学模棱两可。这或许是癌肉瘤可能性的软线索,强调了肿瘤取样相对于其他方法(例如 IHC)在解决诊断难题方面的重要性。大多数研究表明,癌性和肉瘤性成分的类型不会显著影响患者的预后,尽管一项研究表明,在卵巢外疾病患者中,与仅有癌性成分的患者相比,肉瘤性成分的存在是一个不良预后因素。
与子宫内膜癌肉瘤一样,大多数 OCS 具有 TP53 突变,这一特征在诊断上很有用。观察到的其他体细胞遗传异常包括 PIK3CA、PTEN、KRAS 和“上皮-间充质转化”突变。在具有胚系 BRCA1/2 突变的患者中观察到癌肉瘤,分子检测发现了致病性胚系突变,通常是 BRCA1。出于这些原因,大多数机构为 OCS 患者提供基因检测。在 OCS 中观察到 STIC 病变和背景子宫内膜异位症。
从子宫内膜原发性肿瘤推断了 OCS 的免疫组化数据。在 OCS 中,IHC 最常见的用途是识别或确认横纹肌肉瘤成分。因此,有用的 IHC 包括结蛋白、肌生成素和 MyoD1(图 5)。可以观察到癌性和肉瘤性成分之间广谱细胞角蛋白(例如 AE1/AE3)的差异化表达,但通常没有必要。此外,癌肉瘤中的肉瘤成分也可能对角蛋白呈阳性,进一步限制了其诊断效力。PAX8 通常在癌性成分中表达(在一项研究中高达 73% 的病例),而在肉瘤性成分中经常呈阴性。大部分关于妇科癌肉瘤中 ER 表达的文献集中在子宫内膜原发性肿瘤,如果存在,通常存在于癌性成分。dMMR 或 POLE 突变的 OCS 比例未知。
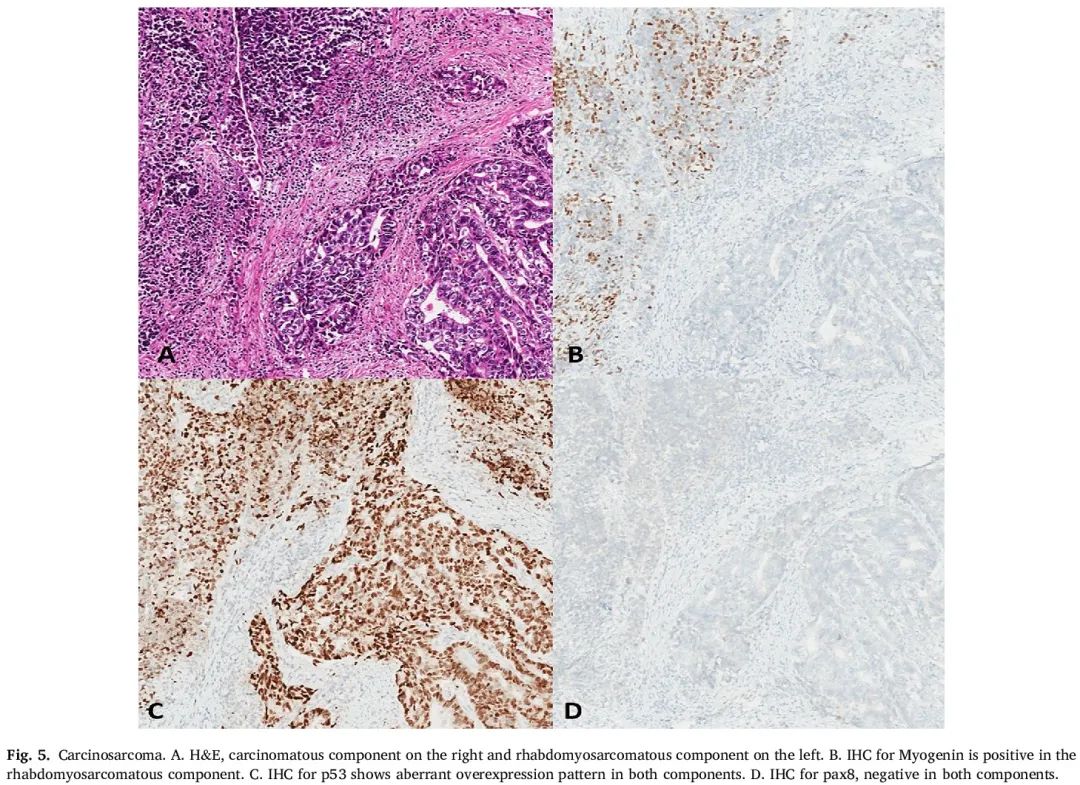
图5
由于癌性和梭形/肉瘤性成分形成对比,大多数 OCS 在诊断上很简单。然而,有些病例的诊断具有挑战性。这些病例通常为 (1) 高级别上皮样至梭形细胞实性增生,没有明确的异源分化;(2) 肉瘤成分(同源或异源)占主导地位的病例。不幸的是,IHC 通常无法帮助解决这一困境,强烈建议进行广泛取样。
治疗依赖于最佳肿瘤细胞减灭术,通常随后进行辅助化疗,尽管癌肉瘤患者对化疗的反应通常不如 HGSC 患者强烈。最佳肿瘤细胞减灭术和诊断时的分期是最重要的预后因素。OCS 患者的 5 年生存率低于 HGSC 患者,平均总生存期为 24 至 43 个月。
OCS 的鉴别诊断取决于病例中存在哪些成分。如果两种成分均存在,则鉴别诊断包括来自不同原发部位(例如肾上腺、膀胱、肾脏等)的转移性癌肉瘤和双相间皮瘤。当肉瘤成分不明显时,鉴别诊断包括 HGSC、高级别 ENOC 和转移,尤其是当癌性成分形态不明确时。相反,当肿瘤完全呈“肉瘤样”时,鉴别诊断包括来自卵巢外原发部位的转移性肉瘤(例如平滑肌肉瘤)、胃肠道间质瘤 (GIST)、孤立性纤维瘤 (SFT)、具有异源成分的恶性Sertoli-Leydig细胞瘤、肉瘤样间皮瘤和原发性卵巢间叶肿瘤(例如高级别子宫内膜间质肉瘤、横纹肌肉瘤、恶性外周神经鞘瘤等)。关于 OCS 与转移性或原发性卵巢肉瘤发生率的正式研究并不完善,但 OCS 可能比原发性或转移性肉瘤更常见。
未分化/去分化癌 (UC/DC)
妇科未分化癌 (UC) 是指缺乏特定分化成分的高级别上皮恶性肿瘤。去分化癌 (DC) 代表具有分化成分的 UC 病例。UC/DC 不是具有不明确分化的肿瘤的诊断废品;随着 UC/DC 经验的积累,病理专家识别了几种保守的形态学、免疫表型和分子特征。UC/DC 在子宫内膜中也比在卵巢中更常见。最早介绍卵巢 UC 的论文之一分析了 35 例缺乏分化的实性生长的卵巢癌病例。作者观察到,大约 74% 的病例与分化较好的成分有关,包括乳头状浆液性癌。重要的是,未分化成分的存在与高度侵袭性的临床病程相关,因为 91% 的患者在 32 个月内死于疾病。在本文发表后的几年里,形态学、免疫表型和分子数据(尤其是子宫内膜 UC/DC)稳步积累,并且建立了诊断标准。后来,Silva 等人观察到子宫内膜 UC/DC 的形态特征与卵巢中出现的形态特征相同,并且许多病例与某种形式的上皮“分化”有关,例如子宫内膜样癌和角化。作者还指出,UC/DC 中的未分化成分在形态上不同于在 FIGO 3 级子宫内膜样癌中观察到的实性生长类型。Tafe LJ 等人呈现了更多的子宫内膜和卵巢 UC/DC 病例,观察到子宫内膜和卵巢原发性肿瘤之间共同的形态学和免疫表型特征,在一部分病例中识别了 dMMR 状态(通常是通过 MLH1/PMS2 表达缺失),并证实了它们的高度侵袭性。子宫内膜和卵巢 UC/DC 之间的相似性使研究人员能够将子宫内膜 UC/DC 研究的结论推广到卵巢原发性肿瘤。
UC/DC 是 SNI/SWF 缺陷型恶性肿瘤家族的成员,因为子宫内膜病例中有相当一部分显示 SMARCA4(BRG1 蛋白)缺失或有时 SMARCB1(INI1 蛋白)缺失。卵巢 UC/DC 很少见,占所有卵巢恶性肿瘤的 <0.5%,患者的年龄范围很广。大多数患者在诊断时处于高分期(III/IV 期)。UC/DC 的宏观特征尚不明确,但大体上形成实性、坏死的卵巢肿块,并累及表面。
识别关键的形态学发现对于正确分类 UC/DC 至关重要,病例的特征是黏附性差的单调圆形细胞群,核质比高,呈片状生长。细胞可能具有“横纹肌样”细胞学(偏心的细胞核,嗜酸性胞浆增加)以及局灶性梭形细胞分化;还观察到黏液样基质和突然角化。结构上,未分化细胞不应形成上皮结构,例如小管、腺体、乳头或巢。UC/DC 具有高度浸润性,但卵巢基质浸润可能不会引起促纤维增生性基质反应。许多病例还包含显著的 TIL。卵巢 DC 病例包括易于识别的分化成分,与未分化细胞截然不同。分化成分通常表现为子宫内膜样癌,可能为低级别;它们对确立诊断极有帮助。
在大多数 UC/DC 病例中,未分化细胞仅显示局灶性/斑片状广谱 CK 和/或 EMA 阳性。尚未观察到高分子量 CK(例如 CK5/6)的表达。IHC 检测 PAX8 表达的结果存在差异,可能为阳性或阴性。几乎从未观察到激素受体表达,WT1 IHC 通常为阴性。p53 IHC 的模式为野生型,E-钙粘蛋白通常为阴性,后者可能部分解释了肿瘤细胞的黏附性差。突触素和嗜铬粒蛋白可能表达,通常是局灶性和斑片状的。如上所述,部分 UC/DC 病例显示 SWI/SNF 蛋白表达缺失,包括 BRG1(由 SMARCA4 编码)、INI1(由 SMARCB1 编码)、BAF250A/ARID1A(由 ARID1A 编码)和 BAF250B/ARID1B(由 ARID1B 编码)。然而,在评估这些蛋白质时必须谨慎,因为 SCCHT 对 BRG1 和 BRM(由 SMARCA2 编码)几乎总是呈阴性。在多达 57-69% 的病例中,MMR 蛋白表达(通过 IHC 检测)可能缺失,通常是 MLH1/PMS2,由 MLH1 启动子高甲基化导致(图 6)。最后,子宫内膜 UC/DC 的 claudin-4 IHC 检测结果通常呈阴性。
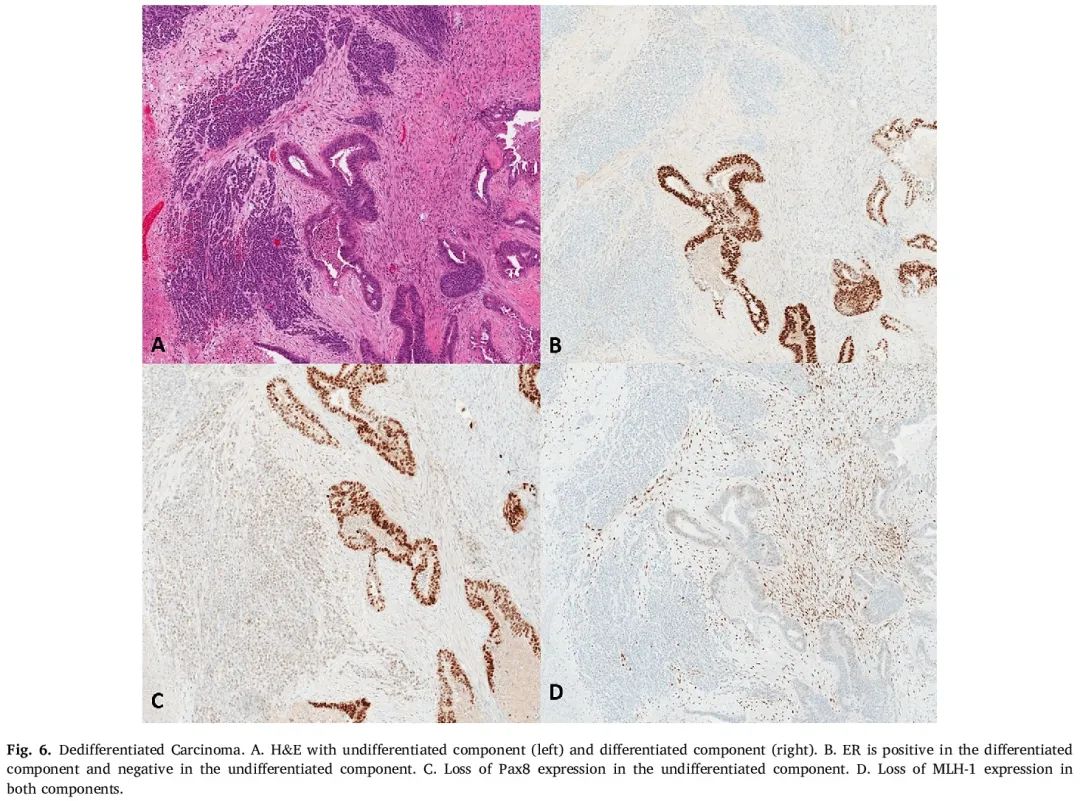
图6
UC/DC 的组织学、免疫表型和分子特征可概括如下:黏附性差的圆细胞(有时具有横纹肌样或梭形形态)形成片状,有或没有分化癌性成分。IHC 检测显示,未分化细胞在部分病例中显示 SWI/SNF 和 MMR 蛋白缺失,显示野生型 p53 模式,角蛋白和/或 EMA 呈阴性或局灶性表达,WT1 通常呈阴性。仔细评估这些特征有助于病理专家区分该实体和其他相似实体。UC/DC 的鉴别诊断包括 HGSC 和高级别 ENOC 和 SCCHT 的实性增生、肺小细胞癌和高级别神经内分泌癌。此外,由于角蛋白和其他“谱系特异性标记物”的局灶性和不一致表达,淋巴瘤与小圆蓝细胞肿瘤 (SRBCT) 中的其他实体相鉴别很重要。
混合性癌
卵巢混合性癌已重新被纳入第 5 版 WHO 分类,作为一种肿瘤亚型。它被定义为具有两种或两种以上组织学类型的卵巢癌。真正的混合性癌非常罕见,占卵巢癌的不到 1%。确诊需要至少两种可识别的组织学类型和形态特征的确认性 IHC。最常见的组合是子宫内膜样癌和 CCC(图 7)。
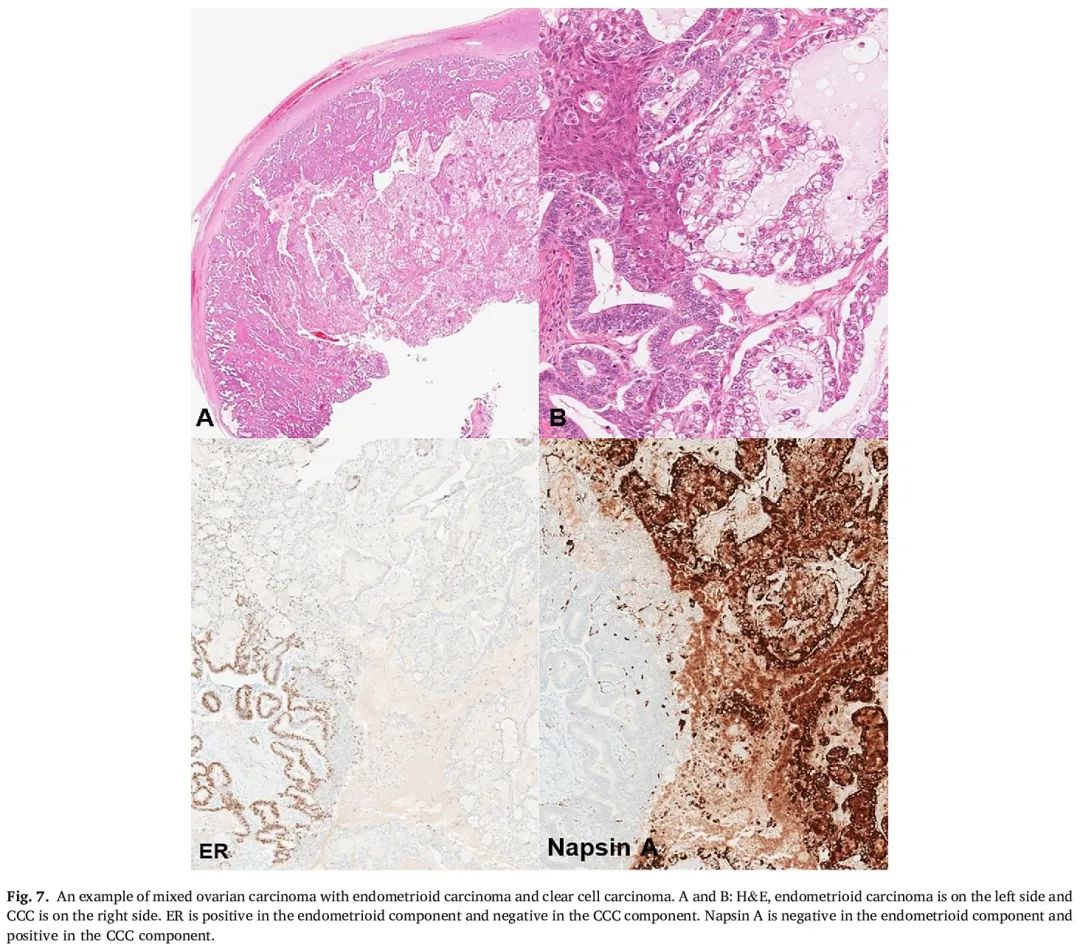
图7
卵巢高钙血症型小细胞癌 (SCCOHT)
卵巢高钙血症型小细胞癌 (SCCOHT) 罕见且具有侵袭性,大多数研究仅限于病例报告和小群体。SCCOHT 的细胞来源在很大程度上是未知的。尽管 SCCOHT 在名称中保留了“癌”,但它被列在其他卵巢肿瘤下。肿瘤抑制因子 SMARCA4 的胚系和体细胞突变是 SCCOHT 的标志。在最近的一项全面基因组分析中,SCCOHT 表现出显著的肿瘤间同质性,并显示出基因组稳定性、低突变负荷和很少的体细胞拷贝数变异。
SCCOHT 往往在成年期早期出现,诊断时的中位年龄通常在 20-30 岁之间。60% 的患者表现为副肿瘤性高钙血症。报告显示,I 期患者的五年总生存率为 33-55%,晚期患者的五年总生存率低至 10%。多变量分析表明,诊断时的肿瘤分期是最重要的预后因素。此外,治疗方式是影响生存率的第二大重要因素,与单纯全身化疗相比,高剂量化疗联合自体干细胞挽救可将生存率提高到 70% 以上。
SCCOHT 的特征性形态学外观是弥漫性片状的单调、黏附性差、小的深染细胞,细胞质稀少,有丝分裂活跃(图 8)。偶尔,没有明确的上皮成分的肿瘤细胞形成滤泡状结构。坏死通常是地图样的。大细胞亚型以大横纹肌样细胞为主,具有丰富的嗜酸性细胞质和囊泡核,被黏液样基质包裹。由于该大组中各种肿瘤的鉴别诊断范围广泛,因此辅助免疫组化是必要的。肿瘤细胞通常显示 SMARCA4/BRG1 缺失,WT-1 和 EMA 呈不同程度的阳性,后者在大细胞亚型中更常表达。其他标记物通常为阴性或显示非特异性染色。仅 0.4% 的 SCCOHT 肿瘤免疫组化显示 SMARCA4 的表达保留。在正确的形态学背景下,表现出该突变和/或 SMARCA4 (BRG1) 和 SMARCA2 (BRM) 蛋白产物免疫组化染色缺失可能对诊断这种高度侵袭性肿瘤至关重要,因为这两种标记物的表达缺失是 SCCOHT 的相对特异性标记。建议所有被诊断为 SCCOHT 的患者都应接受胚系 SMARCA4 突变检测。
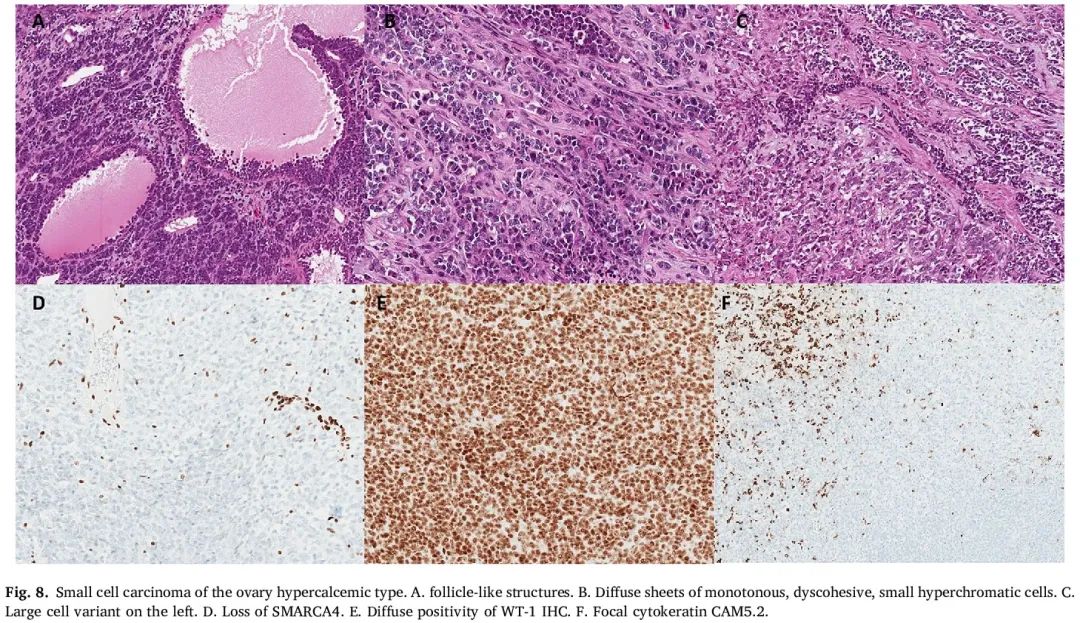
图8
总 结
卵巢癌是一组多样化的肿瘤,包括多种组织学亚型。这些肿瘤的治疗主要依赖于肿瘤分级和分期等因素。然而,准确的细分至关重要,因为每种亚型都代表着一种独特的生物实体,具有独特的流行病学和遗传风险因素、前体病变、分子生物学、治疗反应和预后。现在,大多数卵巢癌都可以使用组织形态学和辅助免疫组化进行适当的细分。强烈建议使用可重复性更高的 IHC 对卵巢癌进行亚型分类。分子技术的进步进一步增强了在某些情况下亚型细分的能力,从而能够更准确地表征大多数卵巢癌。此外,随着新疗法的不断开发,确定哪些卵巢癌亚型对特定治疗方式有反应势在必行。
参考文献:
Andrew Sciallis, Gloria Zhang, Epithelial tumors of the ovary: A review focusing on carcinoma and recent advances, Human Pathology Reports, Volume 37, 2024, 300749, ISSN 2772-736X, https://doi.org/10.1016/j.hpr.2024.300749.

作者:苏州绘真医学
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#卵巢癌# #分子检测# #亚型分类#
59