【论着】| KDM4A通过引入BMP9促进乳腺癌细胞MDA-MB-231的迁移和死亡
2024-04-01 中国癌症杂志 中国癌症杂志
本研究探索表观遗传修饰的组蛋白KDM4A在乳腺癌中的表达及作用,探究KDM4A与BMP9之间的关系及其可能的调节机制,并明确其对乳腺癌发生、发展的影响。
[摘要] 背景与目的:外源性骨形态发生蛋白9(bone morphogenetic protein 9,BMP9)能抑制人乳腺癌的恶性进展,但其在乳腺癌中常异常低表达。本研究拟探索表观遗传修饰的组蛋白赖氨酸特异性去甲基化酶4A(lysine specific demethylase 4A,KDM4A)在乳腺癌中的表达及作用,探究KDM4A与BMP9之间的关系及其可能的调节机制。方法:通过生物信息学方法分析KDM4A在乳腺癌中的表达及其与BMP9之间的关系,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)和蛋白质印迹法(Western blot)进行验证;采用染色质免疫沉淀(chromatin immunoprecipitation,ChIP)验证KDM4A对BMP9的调控作用,采用RNA稳定性实验及CHX蛋白稳定性实验验证KDM4A对BMP9表达的影响。采用RNA干扰技术及敲低BMP9的腺病毒构建转染KDM4A小干扰RNA(siKDM4A)或感染siBMP9腺病毒(Ad-siBMP9)的外源性重组MDA-MB-231细胞,采用划痕愈合实验、transwell实验分别检测细胞迁移及侵袭能力。结果:生物信息学分析结果表明,KDM4A在乳腺癌中的表达明显高于正常组织,KDM4A与BMP9在乳腺癌中的表达呈负相关关系。RTFQ-PCR及Western blot结果显示,KDM4A在不同乳腺癌细胞系中均高表达,敲低KDM4A可显著上调BMP9。ChIP实验证实,KDM4A可显著富集于BMP9基因启动子区域,降低其组蛋白赖氨酸36号位而不是4号位甲基化水平,从而沉默BMP9表达。RNA稳定性实验及CHX蛋白稳定性实验证实,KDM4A对BMP9的mRNA表达无明显影响,但可影响其蛋白降解。敲低KDM4A后,乳腺癌细胞MDA-MB-231的迁移及侵袭能力均受到明显抑制,而这种作用可被敲低BMP9所部分逆转。结论:KDM4A在乳腺癌组织及乳腺癌细胞MDA-MB-231中高表达,并可通过下调BMP9基因启动子区域组蛋白甲基化水平沉默其表达,以及在蛋白水平而不是mRNA水平影响BMP9稳定性,促进乳腺癌的迁移和侵袭。
[关键词] 乳腺癌;赖氨酸特异性去甲基化酶4A;组蛋白去甲基化;骨形态发生蛋白9
[Abstract] Background and purpose: Exogenous bone morphogenetic protein 9 (BMP9) inhibits the malignant progression of human breast cancer, but its expression is often abnormally low in breast cancer. In this study, we intended to explore the expression and role of epigenetically-modified histone lysine-specific demethylase 4A (KDM4A) in breast cancer, and to investigate the relationship between KDM4A and BMP9 and its possible regulatory mechanism. Methods: The expression of KDM4A in breast cancer and its relationship with BMP9 were analyzed by bioinformatics and verified by real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) and Western blot. Chromatin immunoprecipitation (ChIP) verified the regulatory role of KDM4A on BMP9, and RNA stability experiments and CHX protein stability experiments verified the effect of KDM4A in BMP9 expression. Exogenous recombinant MDA-MB-231 cells transfected with KDM4A small interfering RNA (siKDM4A) or infected with siBMP9 adenovirus (Ad-siBMP9) were constructed using RNA interference technology and adenoviruses knocking down BMP9, and the migratory and invasive abilities of the cells were detected by scratch healing assay and transwell assay, respectively. Results: Bioinformatics analysis showed that the expression of KDM4A was significantly higher in breast cancer than in normal tissues, and there was a negative correlation between the expression of KDM4A and that of BMP9 in breast cancer; RTFQ-PCR and Western blot showed that KDM4A was highly expressed in different breast cancer cell lines, and the knockdown of KDM4A significantly up-regulated BMP9. ChIP experiment confirmed that KDM4A could be significantly enriched in the promoter region of BMP9 gene, reducing its histone lysine 36 position instead of position 4 methyl status, thus silencing the expression of BMP9. RNA stability assay and CHX protein stability assay confirmed that KDM4A had no significant effect on the mRNA of BMP9, but could affect its protein degradation. After knocking down KDM4A, the migration and invasion abilities of breast cancer cells MDA-MB-231 were significantly inhibited, and this effect could be partially reversed by knocking down BMP9. Conclusion: KDM4A is highly expressed in breast cancer and breast cancer cell MDA-MB-231, and can silence its expression by down-regulating the level of histone methylation in the promoter region of the BMP9 gene, as well as affecting the stability of BMP9 at the protein level rather than at the level of mRNA, and promoting the migration and invasion of breast cancer.
[Key words] Breast cancer; Lysine-specific demethylase 4A; Histone demethylation; Bone morphogenetic protein 9
乳腺癌是一种严重威胁女性健康的常见恶性肿瘤,其发生、发展涉及遗传背景、激素紊乱和环境影响等多种因素,发病原因复杂[1-3]。因此,寻找新的有效治疗靶点对改善乳腺患者的生存至关重要。
组蛋白甲基化修饰是一种重要的表观遗传修饰,不同组蛋白不同位点的甲基化修饰可导致其所在DNA区域的转录活性改变,从而激活或抑制其基因表达。赖氨酸特异性去甲基化酶4A(lysine specific demethylase 4A,KDM4A)
在多种癌症中呈高表达,其在人乳腺癌组织中的表达显著高于癌旁组织,且癌变程度越深,其表达越高[4-5],提示KDM4A可作为潜在的乳腺癌治疗新靶标。有研究[6-7]显示,KDM4A可特异性识别组蛋白H3赖氨酸4号位三甲基化(H3K4me3)或组蛋白H3赖氨酸36号位三甲基化/二甲基化(H3K36me3/2),去除甲基基团引起甲基化水平下降,从而导致基因转录受到 抑制。
骨形态发生蛋白9(bone morphogenetic protein 9,BMP9)是一种属于骨形态发生蛋白家族的信号分子,参与调控血管生成[8]、骨骼发育[9]、肝脏功能[10]和肿瘤生长[11-12]等生物学过程。研究[11,13-17]发现,BMP9在乳腺癌中常呈低表达甚至表达缺失,而外源性BMP9能抑制人乳腺癌细胞在体外的恶性生物学行为,调节乳腺癌细胞代谢,抑制乳腺癌的骨转移等。因此,本研究探索表观遗传修饰的组蛋白KDM4A在乳腺癌中的表达及作用,探究KDM4A与BMP9之间的关系及其可能的调节机制,并明确其对乳腺癌发生、发展的影响。
1 材料和方法
1.1 细胞系及主要试剂
实验所用乳腺癌细胞系由重庆医科大学检验医学院实验室保存。DMEM高糖培养基购自重庆赛米克生物科技有限公司,胎牛血清购自美国CLARK Bioscience公司,KDM4A小干扰RNA及GP-transfect-Mate转染试剂购自上海吉玛制药技术有限公司,RNA快速提取试剂盒购自上海奕杉生物科技有限公司,反转录试剂购自日本Takara公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)引物均由生工生物工程(上海)股份有限公司设计合成,染色质免疫沉淀(chromatin immunoprecipitation,ChIP)检测试剂盒、蛋白质印迹法(Western blot)相关试剂购自上海碧云天生物技术股份有限公司,兔抗人E-cadherin、vimentin、KDM4A、H3K36me3、H3K4me3、H3K36me抗体和鼠抗人β-actin抗体购自美国Proteintech公司,兔抗人BMP9抗体购自英国Abcam公司,放线菌素D及放线菌酮购自美国Selleck公司。
1.2 方法
1.2.1 细胞培养
细胞用含5%胎牛血清、1%青霉素-链霉素的DMEM高糖培养基于37 ℃、CO2体积分数为5%的培养箱中静置培养,待生长密度达90%时进行细胞传代。
1.2.2 细胞转染
细胞接种于培养皿,待生长密度达60%~80%时,依据GP-transfect-Mate转染试剂使用说明书进行转染,24 h后检测mRNA的表达情况,48 h后检测蛋白质表达情况。
1.2.3 RNA提取和RTFQ-PCR检测
使用RNA快速提取试剂盒进行细胞总RNA提取,再使用反转录试剂盒将RNA逆转录为cDNA用于RTFQ-PCR检测,实验所用引物序列见表1。
1.2.4 Western blot
收集并裂解细胞获取总蛋白并定量,以30 μg蛋白上样量进行Western blot实验。蛋白样品在10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)中分离后转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉37 ℃封闭2 h后加入相应一抗4 ℃静置过夜,第2天以HRP标记的山羊抗兔/鼠免疫球蛋白G(immunoglobulin G,IgG)抗体37 ℃温育1 h,洗膜后用显影仪显影。每组实验重复3次。
1.2.5 Transwell实验
细胞处理24 h后,消化细胞并计数,以双无培养基制备细胞混悬液,对于transwell侵袭实验,提前1 h在小室中加入35 μL基质胶稀释液(基质胶∶双无培养基=1∶9),transwell迁移实验则不需要。随后将细胞悬液加入小室上室,完全培养基加入小室下室,37 ℃温育24 h后固定并用结晶紫染色,于倒置显微镜下拍照。每组实验重复3次。
1.2.6 划痕愈合实验
细胞处理24 h后铺于6孔板内,待细胞长满,使用10 μL移液器吸嘴在6孔板中间划线,采用磷酸盐缓冲生理盐水(phosphate-buffered saline,PBS)清洗去除漂浮的细胞后加入双无培养基,此时于镜下拍照计作0 h,待24、48 h时在相同位置各拍1次照。使用CorelDRAW软件分析各个时间点划痕宽度,计算平均划痕愈合率,计算公式为:平均划痕愈合率=(0 h划痕宽度-24 h划痕宽度/48 h划痕宽度)/0 h划痕宽度×100%。每组实验重复3次。
1.2.7 ChIP
依据ChIP试剂盒进行实验。使用1%甲醛溶液室温固定对数生长期的细胞(约1×106个)10 min,使DNA和蛋白质交联,然后进行超声处理将DNA裂解,4 ℃温育过夜进行免疫沉淀。后续获得沉淀的染色质DNA后通过ChIP-PCR琼脂糖凝胶电泳进行分析。用于ChIP-PCR的正向引物序列为5’-AGTCAGGTCCATAGTCCTTCAT-3’,反向引物序列为5’-TGGATTGTCCTCCACTTGTGC-3’。每组实验重复3次。
1.2.8 RNA稳定性实验
细胞接种于培养皿中,以siKDM4A小干扰RNA转染细胞,并设置对照组。24 h后换液并加入放线菌素D,使终浓度为5 μg/mL,分别处理细胞0、30、60、90和120 min后,提取各时间点的RNA并进行定量检测。每组实验重复3次。
1.2.9 CHX蛋白稳定性实验
细胞接种于培养皿中,以siKDM4A小干扰RNA转染细胞,并设置对照组。48 h后换液并加入放线菌酮,使终浓度为100 μg/mL,分别处理细胞0、30、60、90和120 min后,提取各时间点的蛋白质并对蛋白水平进行检测。每组实验重复3次。

1.3 统计学处理
使用GraphPad Prism8.0软件对数据进行统计学分析。对实验数据进行正态性检验,符合正态分布的数据以x±s表示,各组内两两比较采用Student t检验,两组及两组以上组间数据比较采用单因素方差分析,P<0.05为差异有统计学意 义。
2 结 果
2.1 KDM4A在乳腺癌中异常高表达
通过检索GEPIA数据库(http://gepia.cancer-pku.cn/)分析KDM4A在乳腺癌中的表达。结果显示,KDM4A在乳腺癌组织中的表达高于正常组织(图1A~1B),但KDM4A在乳腺癌各期表达差异无统计学意义(图1C),提示KDM4A参与了乳腺癌整个发生、发展过程。RTFQ-PCR及Western blot结果均显示,KDM4A在不同乳腺癌细胞系中的表达均显著高于乳腺正常永生化上皮细胞MCF-10A(图1D~1E)。
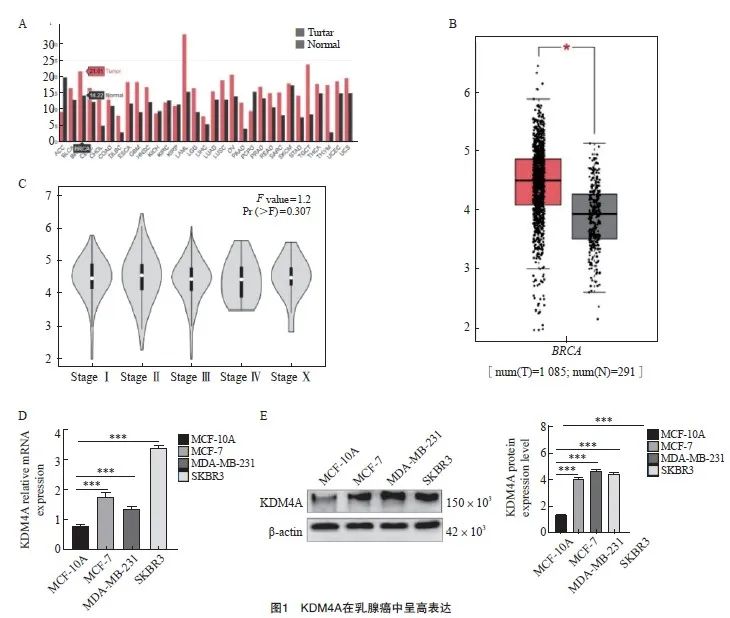
Fig. 1 KDM4A highly expressed in breast cancer
A, B: High expression of KDM4A in breast cancer; C: Expression of KDM4A in different stages of breast cancer; D: The expression of KDM4A in breast cancer cells were detected by RTFQ-PCR; E: The expression of KDM4A in breast cancer cells was detected by Western blot. *: P<0.05, tumor vs normal; ***: P<0.001, compared with MCF-10A.
2.2 KDM4A与BMP9表达存在相关性
检索GEPIA数据库分析发现,KDM4A与BMP9在不同癌症中呈负相关关系,其在乳腺癌中也呈负相关关系(图2A~2C)。RTFQ-PCR及Western blot结果显示,在MDA-MB-231细胞中敲低KDM4A后,BMP9的mRNA表达及蛋白质水平均显著上调(图2D~2E)。以上结果提示KDM4A与BMP9呈负相关关系。
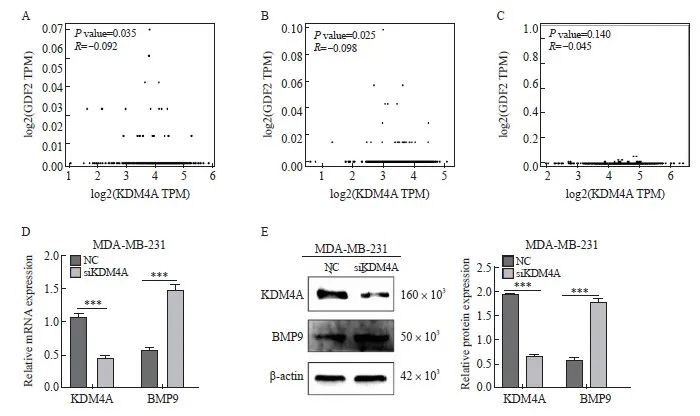
图2 KDM4A与BMP9表达呈负相关
Fig. 2 The expression of KDM4A is negatively correlated with BMP9
A-C: The expression of KDM4A and BMP9 in HNSC, KIRC and BRCA; D: Knocking down KDM4A significantly increased the mRNA expression of BMP9 in MDA-MB-231; E: Knocking down KDM4A significantly increased the protein expression of BMP9 in MDA-MB-231. ***: P<0.001, compared with NC group. NC: Normal control.
2.3 KDM4A可发挥去甲基化作用沉默BMP9表达
Western blot检测MDA-MB-231细胞中组蛋白甲基化水平,发现敲低KDM4A后,H3K36me3、H3K4me3水平均升高,H3K36me水平降低(图3A),说明KDM4A可以发挥去甲基化酶作用,降低组蛋白基因甲基化水平。以IgG抗体沉淀为阴性对照、Input为阳性对照,H3K36me3、H3K4me3抗体沉淀为实验组进行ChIP实验,结果显示,在乳腺癌细胞MDA-MB-231中敲低KDM4A后,H3K36me3在BMP9基因启动子区域显著富集,而H3K4me3则没有显著变化(图3B)。这说明KDM4A可以通过发挥其去甲基化作用下调BMP9基因启动子区的H3K36me3而不是H3K4me3组蛋白甲基化水平,从而沉默BMP9表达。
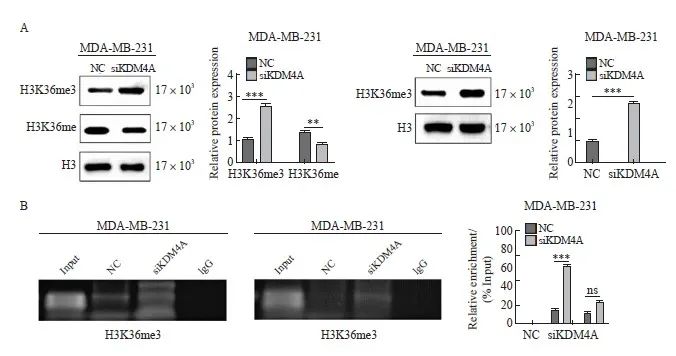
图3 KDM4A下调组蛋白甲基化水平
Fig. 3 KDM4A downregulatd histone methylation status
A: Knocking down KDM4A upregulates H3K36 and H3K4 methylation levels; B: ChIP detection of H3K36me3 and H3K4me3 enrichment in the BMP9 promoter region in MDA-MB-231 cells. ***: P<0.001, compared with NC group. NC: Normal control; ns: No significance.
2.4 KDM4A可抑制BMP9基因的转录但不影响其mRNA的稳定性
鉴于敲低KDM4A可以上调BMP9的mRNA水平,本研究拟进一步探究KDM4A是否能发挥去甲基化酶以外的作用影响BMP9的表达。首先对KDM4A是否影响BMP9的mRNA稳定性进行探究,在分别使用放线菌素D处理MDA-MB-231细胞后检测BMP9的mRNA表达水平,结果显示,敲低KDM4A与否对BMP9的mRNA稳定性无明显影响(图4A)。
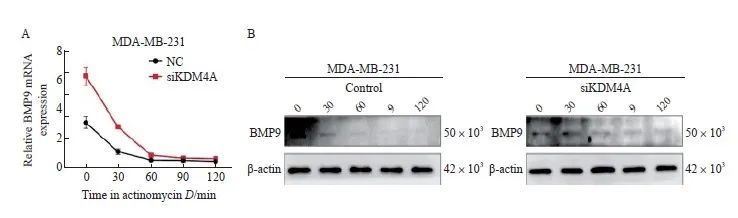
图4 KDM4A对BMP9 mRNA及蛋白水平的影响
Fig. 4 The effect of KDM4A on BMP9 mRNA and protein levels
A: The effect of KDM4A on BMP9 mRNA level; B: The effect of KDM4A on BMP9 protein level.
2.6 敲低KDM4A抑制乳腺癌细胞迁移及侵袭能力
划痕愈合及transwell实验结果显示,敲低KDM4A相较于对照组可以显著降低MDA-MB-231细胞的划痕愈合率、减少穿膜细胞数,且这种作用可被敲低BMP9部分逆转(图5A~5B)。上述结果提示,KDM4A可以促进乳腺癌细胞迁移及侵袭,且这种作用可因BMP9的敲低而被部分逆转,说明KDM4A可通过下调BMP9促进乳腺癌的进展。
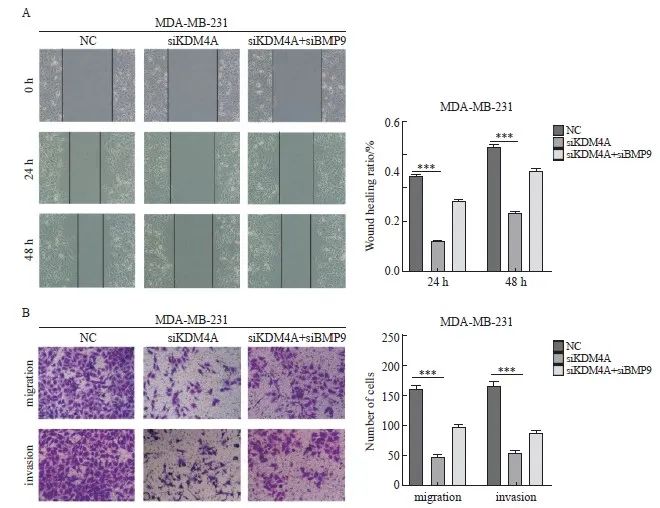
图5 沉默KDM4A抑制乳腺癌细胞的迁移和侵袭
Fig.5 Silencing of KDM4A inhibited the migration and invasion of breast cancer cells
A: The migration ability of MDA-MB-231 was detected by wound healing test; B: The migration and invasion ability of MDA-MB-231 was detected by transwell assay. ***: P<0.001, compared with NC group. NC: Normal control.
3 讨 论
在乳腺癌中,多种基因的表达与功能异常可促进乳腺癌的恶性生物学行为,而分子生物学技术的进步使得有助于识别乳腺癌诊断和治疗的更具体的生物标志物成为可能,从而改善个体化治疗[18]。因此,寻找高特异性的生物标志物帮助医师诊断及制订治疗计划对提高治疗成功率至关重要。
染色质的三维结构由核小体定位、组蛋白组成和组蛋白修饰等过程调节[19],带正电荷的组蛋白修饰直接影响复制、基因转录和DNA损伤修复等过程。KDM4A是一种组蛋白去甲基化酶,在多种癌症中呈高表达。有研究[20-21]显示,KDM4A可以去除甲基化组蛋白H3上激活转录的H3K4/36me3标记,直接引起癌症相关基因转录沉默或激活。例如,斑蝥素通过KDM4A依赖性组蛋白H3K36的去甲基化诱导DNA损伤,增强肝癌化疗敏感性[20];在非小细胞肺癌中KDM4A促进DLX5启动子H3K4me3的去甲基化引起DLX5转录激活,导致癌基因Myc的表达,从而促进癌症的发生、转移和生长等[21]。此外,KDM4A还能作用于转录抑制性标记H3K9me3,在骨肉瘤中通过控制SLC7A11启动子区域的H3K9me3去甲基化,调控SLC7A11的转录和癌细胞铁死亡[22];在宫颈癌中,KDM4A通过H3K9me3激活转铁蛋白受体1(transferrin receptor protein 1,TFR1)和二价金属转运蛋白1(divalent metal transporter 1,DMT1)启动子中的HRE序列,从而诱导宫颈癌细胞铁死亡[23]。除了以去甲基化组蛋白为底物,KDM4A还能以非组蛋白为底物,通过直接下调肿瘤抑制因子miR-491-5p促进宫颈癌细胞生长并抑制细胞凋亡[24]。KDM4A与肿瘤的发生、发展密切相关,而其在乳腺癌中的作用尚不明确。本研究首先发现了KDM4A与BMP9之间呈负相关关系,并明确了KDM4A在乳腺癌中对BMP9进行转录调节的作用,并且这种作用既可以依赖也可以独立于其酶活性,但其影响BMP9蛋白稳定性的具体机制还需进一步探索。
BMP9是骨形态发生蛋白家族的一员,在胚胎发育、组织再生和成年生理学过程中发挥重要作用。BMP9在乳腺癌中发挥着至关重要的作用,BMP9可通过cMyc/SNHG3/mTOR信号轴促进乳腺癌细胞自噬,抑制乳腺癌细胞迁移和侵袭[12];通过激活BMP/Smad信号转导通路, BMP9可以下调结缔组织生长因子(connective tissue growth factor,CTGF)抑制乳腺癌细胞骨转移[15];PI3K/AKT、ERK1/2、ALK1等信号转导通路也是BMP9靶向抑制乳腺癌的重要途径[16,25-26]。BMP9能够通过协调癌细胞与周围微环境之间的通讯来促进疾病的进展和转移。通过降低脂肪前细胞/脂肪细胞中瘦素的表达,下调磷酸化STAT3、ERK1/2和AKT,抑制瘦素信号转导通路来降低乳腺癌在脂肪微环境中的增殖和迁移[14];BMP9通过RANK/RANKL和SDF-1(CXCL12)/CXCR4-PI3K信号轴调节骨髓间充质干细胞与乳腺癌细胞之间的串扰,促进骨髓间充质干细胞的成骨分化和增殖[13]。外源性BMP9能显著抑制乳腺癌的发生、发展,但其在乳腺癌中的表达却极低甚至缺失,作为一种多功能的细胞因子,BMP9具有潜在的治疗应用前景,靶向BMP9在乳腺癌的诊断和治疗中可能是一个重要手段。
本研究结果表明,KDM4A可以通过去除BMP9基因启动子区域组蛋白H3上的甲基基团、降低BMP9蛋白的稳定性来下调BMP9的表达,促进乳腺癌细胞的迁移和侵袭能力。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:
陈远香:设计及操作全部实验,撰写文章。
余 涛:生物信息学分析。
杨诗雨:数据分析。
曾 涛:数据分析。
魏 兰:设计实验。
张 彦:设计实验,修改文章。
[参考文献]
[1] HOUGHTON S C, HANKINSON S E. Cancer progress and priorities: breast cancer[J]. Cancer Epidemiol Biomarkers Prev, 2021, 30(5): 822-844.
[2] B A R ZAMAN K , K A R A M I J , ZA R E I Z, e t a l . B r e a st cancer: biology, biomarkers, and treatments[J]. Int Immunopharmacol, 2020, 84: 106535.
[3] LANDSKRON G, DE LA FUENTE M, THUWAJIT P, et al. Chronic inflammation and cytokines in the tumor microenvironment[J]. J Immunol Res, 2014, 2014: 149185.
[4] KONG R N, GAO J, JI L M, et al. Iguratimod ameliorates rheumatoid arthritis progression through regulating miR-146a mediated IRAK1 expression and TRAF6/JNK1 pathway: an in vivo and in vitro study[J]. Clin Exp Rheumatol, 2021, 39(2): 289-303.
[5] 谭秋芬, 胡惠军. FEN1、GTF2IP23、KDM4A在乳腺癌组织中的表达研究[J]. 国际检验医学杂志, 2023, 44(3): 311-315.
TAN Q F, HU H J. Expression and correlation of FEN1, GTF2IP23, and KDM4A in breast cancer tissues[J]. Int J Lab Med, 2023, 44(3): 311-315.
[6] LEE J, THOMPSON J R, BOTUYAN M V, et al. Distinct binding modes specify the recognition of methylated histones H3K4 and H4K20 by JMJD2A-tudor[J]. Nat Struct Mol Biol, 2008, 15(1): 109-111.
[7] CHEN Y C, LIU X R, LI Y K, et al. Lung cancer therapy targeting histone methylation: opportunities and challenges[J]. Comput Struct Biotechnol J, 2018, 16: 211-223.
[8] WANG G L, WEN B Q, DENG Z C, et al. Endothelial progenitor cells stimulate neonatal lung angiogenesis through FOXF1-mediated activation of BMP9/ACVRL1 signaling[J]. Nat Commun, 2022, 13(1): 2080.
[9] XU J Z, ZHOU Y M, ZHANG L L, et al. BMP9 reduces agerelated bone loss in mice by inhibiting osteoblast senescence through Smad1-Stat1-P21 axis[J]. Cell Death Discov, 2022, 8(1): 254.
[10] HAN Y L, PAN Q Z, GUO Z X, et al. BMP9-induced vascular normalisation improves the efficacy of immunotherapy against hepatitis B virus-associated hepatocellular carcinoma[J]. Clin Transl Med, 2023, 13(5): e1247.
[11] CHEN H, NIO K, TANG H, et al. BMP9-ID1 signaling activates HIF-1α and VEGFA expression to promote tumor angiogenesis in hepatocellular carcinoma[J]. Int J Mol Sci, 2022, 23(3): 1475.
[12] YU H M, CHEN Y X, LANG L, et al. BMP9 promotes autophagy and inhibits migration and invasion in breast cancer cells through the c-Myc/SNHG3/mTOR signaling axis[J]. Tissue Cell, 2023, 82: 102073.
[13] WANG W, WENG Y G, REN W, et al. Biological roles of human bone morphogenetic protein 9 in the bone microenvironment of human breast cancer MDA-MB-231 cells[J]. Am J Transl Res, 2015, 7(9): 1660-1674.
[14] WANG T, ZHANG Z H, WANG K, et al. Inhibitory effects of BMP9 on breast cancer cells by regulating their interaction with pre-adipocytes/adipocytes[J]. Oncotarget, 2017, 8(22): 35890-35901.
[15] REN W, SUN X X, WANG K, et al. BMP9 inhibits the bone metastasis of breast cancer cells by downregulating CCN2 (connective tissue growth factor, CTGF) expression[J]. Mol Biol Rep, 2014, 41(3): 1373-1383.
[16] LI S, DAI H Y, HE Y, et al. BMP9 inhibits the growth of breast cancer cells by downregulation of the PI3K/Akt signaling pathway[J]. Oncol Rep, 2018, 40(3): 1743-1751.
[17] OUARNÉ M, BOUVARD C, BONEVA G, et al. BMP9, but not BMP10, acts as a quiescence factor on tumor growth, vessel normalization and metastasis in a mouse model of breast cancer[J]. J Exp Clin Cancer Res, 2018, 37(1): 209.
[18] NEVES REBELLO ALVES L, DUMMER MEIRA D, POPPE MERIGUETI L, et al. Biomarkers in breast cancer: An old story with a new end[J]. Genes, 2023, 14(7): 1364.
[19] RANDO O J, CHANG H Y. Genome-wide views of chromatin structure[J]. Annu Rev Biochem, 2009, 78: 245-271.
[20] WEI C, DENG X G, GAO S D, et al. Cantharidin inhibits proliferation of liver cancer by inducing DNA damage via KDM4A-dependent histone H3K36 demethylation[J]. Evid Based Complement Alternat Med, 2022, 2022: 2197071.
[21] SUN S S, YANG F J, ZHU Y C, et al. RETRACTED: KDM4A promotes the growth of non-small cell lung cancer by mediating the expression of Myc via DLX5 through the Wnt/β-catenin signaling pathway[J]. Life Sci, 2020, 262: 118508.
[22] CHEN M, JIANG Y H, SUN Y B. KDM4A-mediated histone demethylation of SLC7A11 inhibits cell ferroptosis in osteosarcoma[J]. Biochem Biophys Res Commun, 2021, 550: 77-83.
[23] XIONG J, NIE M F, FU C, et al. Hypoxia enhances HIF1α transcription activity by upregulating KDM4A and mediating H3K9me3, thus inducing ferroptosis resistance in cervical cancer cells[J]. Stem Cells Int, 2022, 2022: 1608806.
[24] LI Y, WANG Y N, XIE Z, et al. JMJD2A facilitates growth and inhibits apoptosis of cervical cancer cells by downregulating tumor suppressor miR-491-5p[J]. Mol Med Rep, 2019, 19(4): 2489-2496.
[25] LIN X, QIU W X, XIAO Y Y, et al. MiR-199b-5p suppresses tumor angiogenesis mediated by vascular endothelial cells in breast cancer by targeting ALK1[J]. Front Genet, 2019, 10: 1397.
[26] REN W, LIU Y H, WAN S H, et al. BMP9 inhibits proliferation and metastasis of HER2-positive SK-BR-3 breast cancer cells through ERK1/2 and PI3K/AKT pathways[J]. PLoS One, 2014, 9(5): e96816.
作者:中国癌症杂志
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#乳腺癌# #组蛋白去甲基化# #赖氨酸特异性去甲基化酶4A;# #骨形态发生蛋白9#
18