病例分享 | 疑难病例:胚胎发育不良性神经上皮肿瘤(DNET)1例
2024-07-15 上海阿克曼病理 上海阿克曼病理
15岁男性发作性右侧肢体抽搐,检查发现左侧额顶叶多发占位,病理诊断倾向胚胎发育不良性神经上皮肿瘤,介绍其临床、影像、病理特征及鉴别诊断。
病史介绍
男,15岁,发作性右侧肢体抽搐1年,当地医院头颅MRI示左侧额顶叶多发占位病变,急诊入住我院。既往体健。查体无明显的神经系统阳性体征。
辅助检查
CT显示:
左侧额顶叶、左侧侧脑室旁及丘脑多发不规则的低密度影伴左侧额顶叶内钙化灶;
MRI显示:
左侧额顶叶、左侧侧脑室旁及丘脑多发异常信号,考虑低级别胶质瘤?请结合临床。双侧上颌窦炎性病变。
大体所见
左额顶叶肿物:
送检碎组织一堆,总体积8*2*0.3cm,灰红、灰黄、质软,全取。
镜下形态
镜下见特征性的多结节状的胶质神经元成份:即形态一致的少突胶质细胞样细胞呈弥漫性或条索状分布,形成微囊样结构,囊腔内可见嗜碱性的疏松黏液样基质,其内可见呈“浮蛙样”的神经元;还可见少突胶质细胞样细胞结节样增生,核圆形深染,可见核周空晕,形态上类似少突胶质细胞瘤;间质见“鸡爪样”分支血管,未见核分裂及坏死;
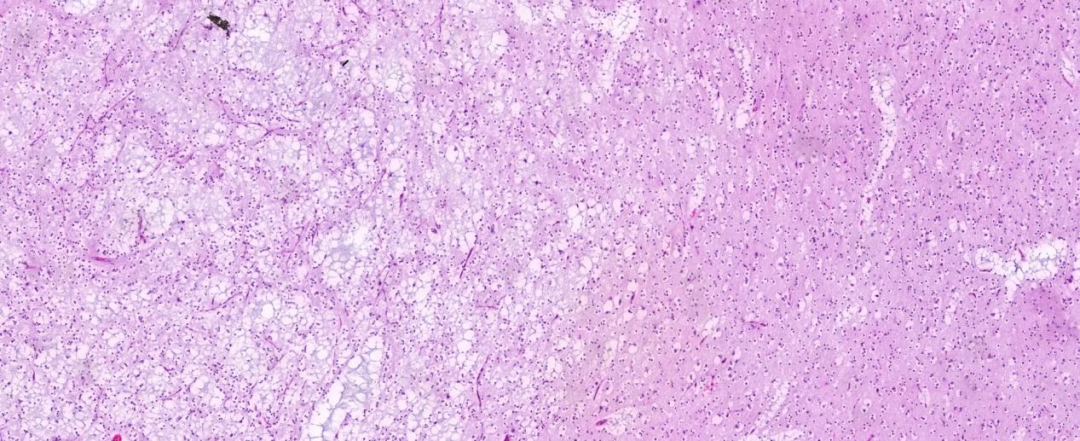
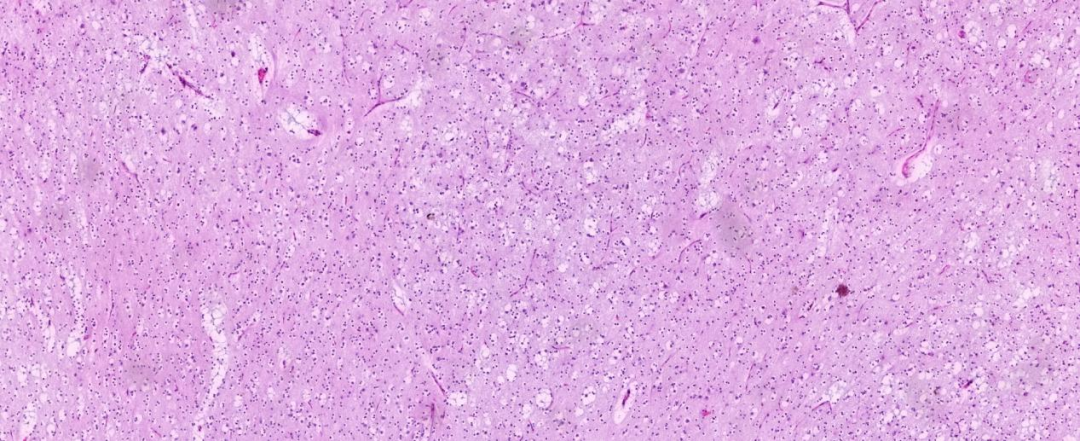
低倍镜下可见胞浆透亮的肿瘤细胞,周边见“鸡爪样”血管,形似少突胶质细胞瘤样细胞形态;肿瘤细胞条索状或束状排列;
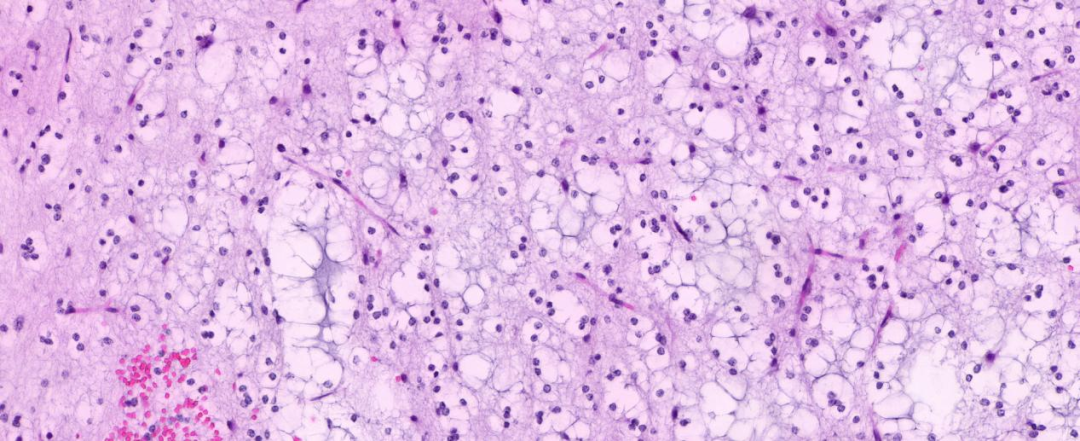
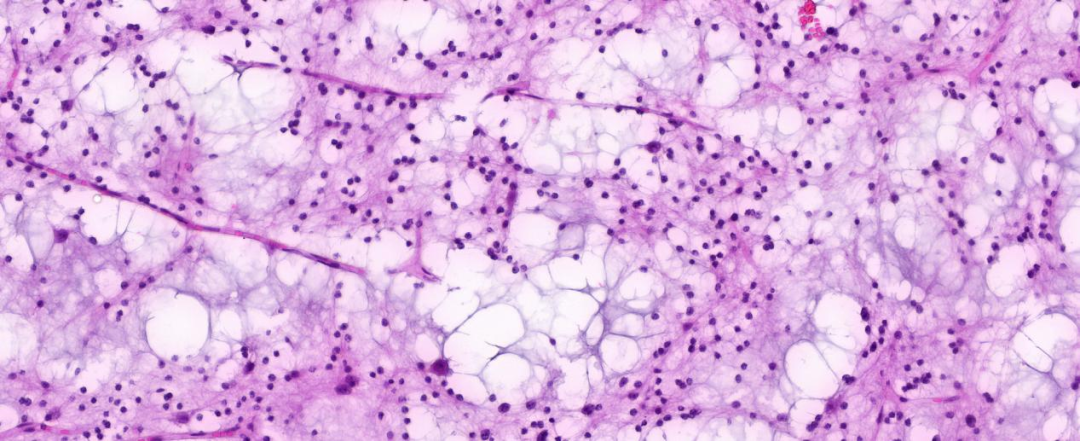
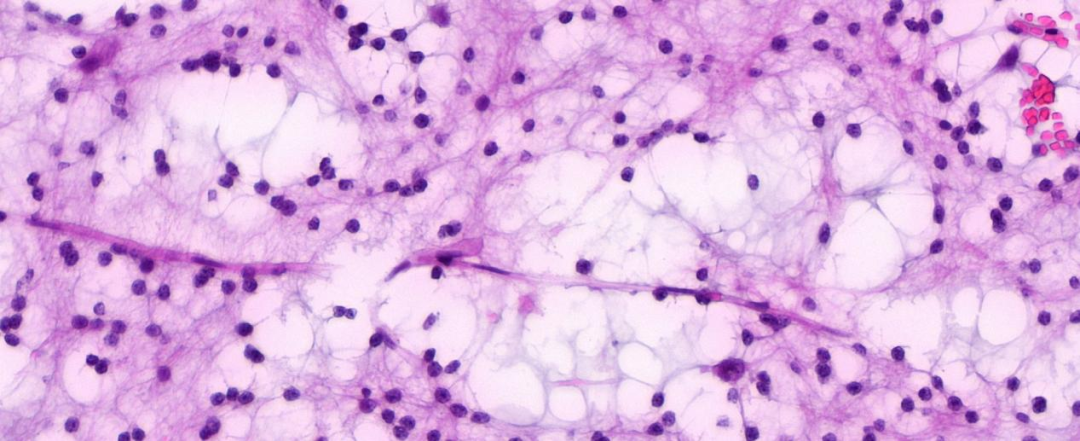
高倍镜下可见黏液形成,黏液湖里或边缘可见单个核大的神经元细胞;未见明确核分裂及坏死。
免疫组化结果
CK(-)、Vim(+)、GFAP(小胶质细胞-,周围胶质细胞+)、Oligo-2(小胶质细胞+)、S-100(+)、CD34(血管+)、 NeuN(漂浮的神经元+)、IDH1(-)、ATRX(+)、LCA(-)、Ki-67(+<3%)。
分子检测
FISH检测:
1p36和19q13均未缺失;
DNA sanger测序:
IDH1-R132、IDH2-R140、 IDH2-R172均未见突变;
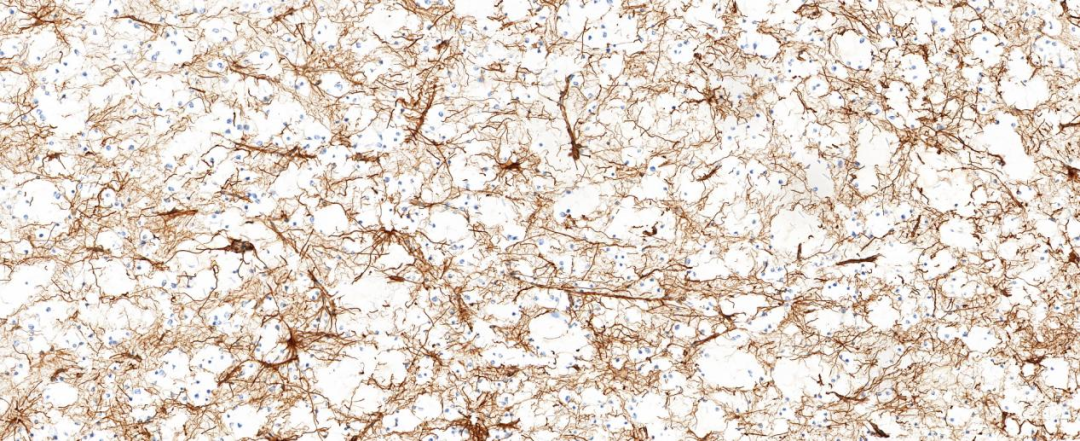
图1示GFAP:小的少突胶质细胞样细胞和神经元阴性,反应性胶质细胞阳性;
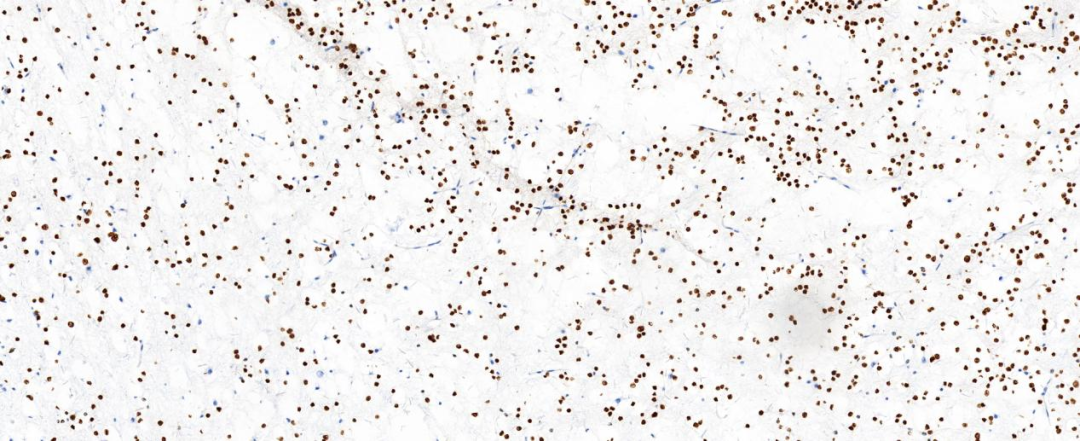
图2示:Oligo-2肿瘤细胞阳性表达

图3示:S-100肿瘤细胞阳性表达

图4示:Ki-67增殖指数较低(+<3%)
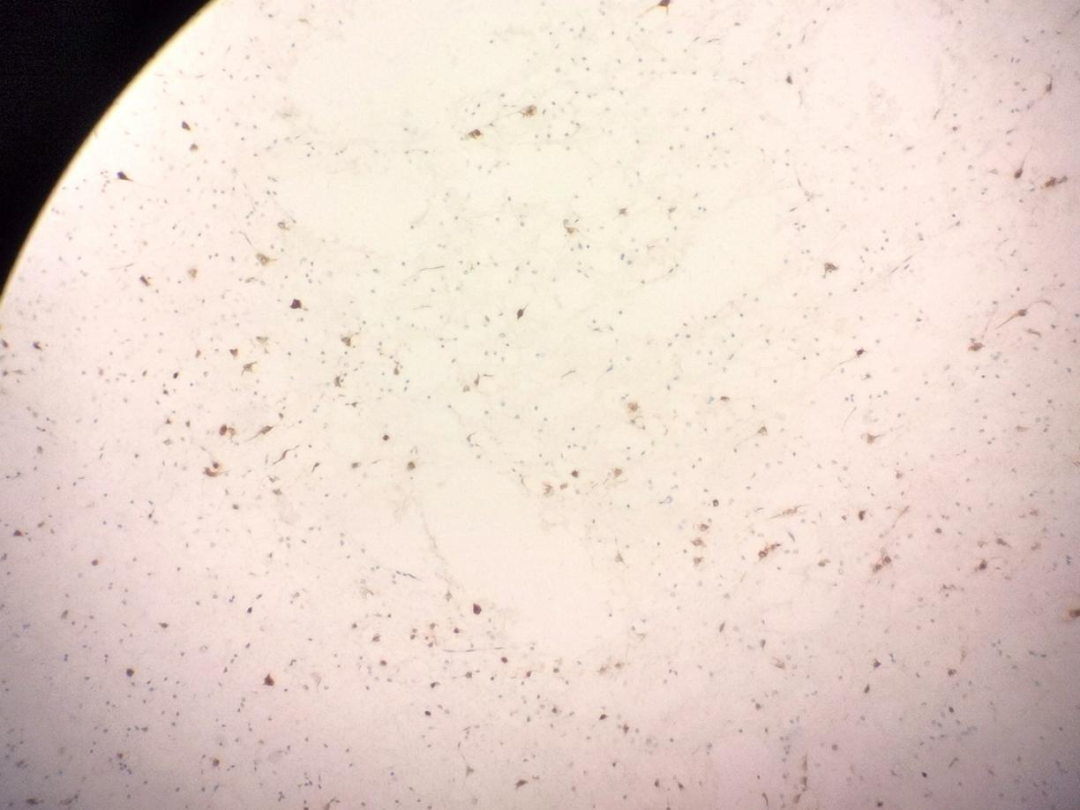
图5示:NeuN阳性示漂浮的神经元
病理诊断:
省医学会/医师协会疑难病理会诊中心结果:
(左额顶叶肿物)低级别胶质细胞瘤,倾向胚胎发育不良性神经上皮肿瘤。
讨 论
定义:
发生在儿童和年轻人大脑皮层的胶质神经元肿瘤,其特征是可伴有胶质结节的病理性胶质神经元成份,该病与FGFR1激活突变有关(CNS WHO 1级)。
ICD-O编码:9413/0
临床特征
DNET临床上较为罕见,患者大多是儿童和年轻人,男性居多,约90%患者的年龄<20岁;临床上长期有难治性癫痫发作史或其他相应累及部位的症状,药物控制可能不理想,多20岁之前癫痫发病,病程较长。癫痫发作的控制高度依赖于肿瘤的完全切除,肿瘤卫星病变的存在也会对癫痫发作的结果产生负面影响。肿瘤发病位置位于幕上大脑半球皮质任何部位,颞叶居多(占67.3%),其他部位如额叶(占约16.3%)、海马、深部核团、脑干、小脑等也有相应的该病报道。该病还可以多灶发生。
影像学特征
MRI检查示病灶主要局限于皮质或皮质下,T1WI呈低信号,T2WI呈高信号,边界清晰,呈囊状或脑回样,肿瘤周围无水肿及占位效应,增强扫描多数病例无明显强化,极少数有环状强化。少部分有钙化。有的病例表现为瘤内分隔和三角征。
病理特征
1.大体特点
肿瘤切面多呈多结节状,直径大小不一,几毫米到几厘米,部分可见囊性变、钙化及出血,比例不同。
2.镜下表现:
DNET特征性的是特定的胶质神经元成份(specific glioneuronal element,SGE)即由小的少突胶质细胞样细胞(OLC)排列的轴突束,散在的神经元似乎漂浮在黏液样基质中(浮蛙神经元)。部分可多结节皮质内生长模式,肿瘤细胞绸带样,形成微囊样结构,间质粘液样变性。OLC的形态较为一致,胞体小,核圆形或椭圆形,核周有空晕,胞质较少,呈“鱼眼征”。局灶可见砂粒体样钙化。可分为3个组织学亚型:(1)简单型DNET:结节区域由经典的“胶质神经元成份”组成;(2)复杂型DNET:除了经典的“胶质神经元成份”外,还可以见其他特征,包括皮质发育不良;(3)非特异型DNET:目前该型有争议,缺乏DNET经典的组织学特征,且与其他胶质瘤或胶质神经元肿瘤重叠,诊断基于临床、影像学特征及生物学行为等。在DNET复发的病例中还可以“肾小球样”血管内皮增生,无肿瘤性坏死,嗜酸性颗粒小体偶尔出现,边缘可见局灶皮质发育不良表现。间变性转化很罕见。
3.免疫表型:
S-100(少突胶质细胞样细胞+),Oligo-2(+),GFAP(少突胶质细胞样细胞-或罕见+,周围胶质细胞+),漂浮的神经元MAP2、SyN和NeuN通常(+),P53野生型表达,肿瘤细胞ATRX(+),IDH1(-),Ki-67增殖指数较低(约1%)。
4.分子遗传学:
在约40%-80%的DNET病例中发生FGFR1基因改变,机制主要包括单个核苷酸变异、TKD重复与融合;在约50%DNET病例也可以检测到BRAF V600E的突变。在少数病例中检测到PDGFRA和NF1基因突变。FGFR基因的改变可导致FGFR1磷酸化,从而上调MAPK和PI3K信号通路。FGFR1的活性与抑制少突胶质细胞前体分化相关。另文献报道在DNET病例中也发现了FGFR2::ZCCHC24融合。
无IDH或组蛋白H3的突变,无1p19q的双缺失及TP53突变,也有个别文献报道1p19q的杂合性缺失和TERT启动子突变。
5.治疗与预后
DNET属于良性肿瘤,外科手术切除效果好,预后良好,无需放疗和化疗,需密切随访,但也有恶性转化的罕见病例报道。
鉴别诊断
1.毛细胞星形细胞瘤(PA):是儿童最常见的胶质瘤,无性别差异,肿瘤多位于小脑和大脑中线部位(下丘脑、脑干、脊髓等)。影像学上典型的PA是囊肿样肿块伴增强的附壁结节。组织学上呈双相模式[在小脑中较为常见]:含Rosenthal纤维的致密区和伴有微囊的疏松区及嗜酸性颗粒小体;然而PA经常表现出广泛的组织学模式,也可以见到明显的血管内皮增生、核增大深染,罕见核分裂。但PA可以发生间变特征,若具有特定DNA甲基化谱的应归为HGAP。分子遗传学:编码参与MAPK信号通路蛋白基因突变,最常见是BRAF::KIAA1549基因融合。
2.少突胶质细胞瘤:主要位于成人大脑半球,起源于少突胶质细胞,是弥漫性浸润性胶质瘤,组织学上核圆、体积大小一致,细胞突起少、胞浆透亮(煎蛋样外观)和分枝状血管(鸡爪样血管)。间变特征有:细胞密度高,细胞异型性,核分裂像增多,血管明显增生、栅栏状坏死。分子遗传上有IDH1/2的突变伴1p和19q的双缺失;分为WHO 2级和3级,当CDKN2A/B的纯合性缺失时应为WHO 3级肿瘤。
3.节细胞胶质瘤(GG):一种分化良好、生长缓慢的胶质神经元肿瘤,由肿瘤性神经节和胶质细胞共同构成,其分子特征为引起MAPK通路激活的基因改变[CNS WHO 1级]。GG是最常见的癫痫相关肿瘤(占约40%);胶质成份发生间变时可诊断WHO 3级,目前没有统一的诊断标准,可能类似高级别星形细胞瘤;文献报道的WHO 3级分子改变:TERT突变、TP53突变、ATRX缺失。但是,WHO 1和3级均可以检测到 H3K27M突变,因此,H3K27M突变不是WHO 4级DMG特有的。此外,个别病例也可以检测到BRAF-KIAA1549基因融合。
4.粘液样胶质神经元肿瘤(MGRT):是新定义的一种低级别胶质神经元肿瘤,相对罕见,迄今文献报道不足100例。通常位于透明隔,偶见脑室,曾被称为:透明隔区的DNT样肿瘤或脑室内DNT样肿瘤;但无BRAF和FGFR1的基因改变,存在特征性的PDGFRA突变。组织学形态为少突胶质细胞样肿瘤细胞分布于黏液样/富含黏蛋白的间质中,有时可见“漂浮”的神经元、神经细胞“菊形团”和(或)围血管神经毡结构。个别病例可见毛细胞样特征、嗜酸性颗粒小体等。临床进程缓慢,相当于 CNS WHO 1级。
5.节细胞瘤:组织学上大的、明显的神经元细胞,双核、胞质气球样变或空泡化,常常不规则聚集,背景为粗糙的神经纤维,需除外其他的具有神经节细胞分化的神经上皮肿瘤;
6.菊形团形成的胶质神经元肿瘤(RGNT):为一种罕见的、生长缓慢的中枢神经系统肿瘤,第5版CNS WHO分类,属于WHO1级。好发年龄为12〜59岁(平均33岁),男:女=4:7。发生于中线结构,常位于第四脑室和/或中脑导水管,并可侵犯临近的脑干、小脑蚓部、四叠体、松果体或丘脑。组织学两种截然不同成份:一是均匀的神经细胞形成的菊形团或血管周围假菊形团;另一种为胶质性质、有毛样或少突样细胞;分子:FGFR1突变,经常同时发生PIK3CA和/或NF1突变;组织学可以与DNET区别分开。
7.脑室外神经细胞瘤(EVN):由少突胶质细胞样细胞(oligodendroglia-like cells,OLC)组成,易见神经节样细胞,未见无核纤维岛,无核分裂,坏死及血管内皮增生。免疫组化NeuN、NF和SyN弥漫阳性,少量GFAP阳性,Ki-67增殖指数极低。发病部位、免疫组化可以与DNET鉴别。
8.年轻人多形性低级别神经上皮肿瘤(PLNTY):可以呈少突样形态,核多形性,血管丰富、血管壁玻璃样变性及钙化常见,但CD34免疫组化肿瘤细胞呈弥漫性阳性(几乎总是),周围阳性分枝状神经元;
*本文(包括图片)均为作者投稿, 仅供行业交流学习用,不作为医疗诊断依据。
参考文献
1.《Diagnostic Pathology: Neuropathology》. 3rd. ISBN-13: 978-0323713306.ISBN-10:0323713300.
2.《Central Nervous System Tumours: WHO Classification of Tumours》第5版本。
3.Louis DN, Perry A, Wesseling P, et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol, 2021,23(8):1231-1251.
4.刘雪青,沈艳玲,杨文圣.胚胎发育不良性神经上皮肿瘤4例临床病理观察[J].诊断病理学杂志,2019,26(9):582-586.DOI:10.3969/j.issn.1007-8096.2019.09.008.
5.黄小梅,张帆,江晓春,许金亮,庞金金,卢林明.胚胎发育不良性神经上皮肿瘤1例报道并文献复习[J].皖南医学院学报,2022,41(5):506-509.DOI:10.3969/j.issn.1002-0217.2022.05.028.
6.李南云,周晓军,金行藻,孟奎,马恒辉,郑晓刚,姜少军,孙桂勤.胚胎发育不良性神经上皮瘤临床病理观察[J].中华病理学杂志,2005,34(9):561-565.DOI:10.3760/j.issn:0529-5807.2005.09.005.
7.陈莉,卢德宏,徐庆中,朴月善,张国君,遇涛,杨小平,杨虹.胚胎发育不良性神经上皮瘤11例临床病理学观察[J].中华神经科杂志,2006,39(8):525-528.DOI:10.3760/j.issn:1006-7876.2006.08.006.
8.梁乐,付静,李大胜,冷慧,刘永玲,姚晓香,歌日乐,李云林,马康平.神经节细胞胶质瘤19例临床病理分析[J].临床与实验病理学杂志,2018,34(3):273-278.DOI:10.13315/j.cnki.cjcep.2018.03.008.
9.Ould Ismail AA, Parra O, Hughes EG, Green DC, Loo E, Zanazzi G, Lin CC. Novel FGFR2::ZCCHC24 Fusion in Dysembryoplastic Neuroepithelial Tumor. J Neuropathol Exp Neurol. 2022 Nov 16;81(12):1029-1032. doi: 10.1093/jnen/nlac087. PMID: 36164838; PMCID: PMC9960002.
10.Phi JH, Kim SH. Dysembryoplastic Neuroepithelial Tumor: A Benign but Complex Tumor of the Cerebral Cortex. Brain Tumor Res Treat. 2022 Jul;10(3):144-150. doi: 10.14791/btrt.2022.0015. PMID: 35929111; PMCID: PMC9353162.
11.Surrey LF, Jain P, Zhang B, Straka J, Zhao X, Harding BN, Resnick AC, Storm PB, Buccoliero AM, Genitori L, Li MM, Waanders AJ, Santi M. Genomic Analysis of Dysembryoplastic Neuroepithelial Tumor Spectrum Reveals a Diversity of Molecular Alterations Dysregulating the MAPK and PI3K/mTOR Pathways. J Neuropathol Exp Neurol. 2019 Dec 1;78(12):1100-1111. doi: 10.1093/jnen/nlz101. PMID: 31617914.
12.张旭妃, 朱明旺, 杜铁桥, 等.胚胎发育不良性神经上皮肿瘤的MRI分型及影像表现[J].中华放射学杂志, 2019, 53(5): 341-344.
13.何晓顺,焦伟娟,郭凌川,等.6例胚胎发育不良性神经上皮肿瘤患者的临床病理学分析[J].中国癌症杂志, 2021, 31 (9): 822-827.
14.葛荣,方虹斐,常玉青,等.年轻人多形性低级别神经上皮肿瘤的临床病理学分析[J].中华病理学杂志, 2020, 49(11):5.DOI:10.3760/cma.j.cn112151-20200213-00086.
15.李津,李向荣,蒋牧良,等.脑室外中枢神经细胞瘤的CT及MRI表现与病理分析[J].临床放射学杂志, 2020(3):5.DOI:CNKI:SUN:LCFS.0.2020-03-008.
16.周婧,李南云,周晓军,等.脊髓部位脑室外神经细胞瘤的临床病理及文献复习[J].临床与实验病理学杂志, 2010(4):5.DOI:10.3969/j.issn.1001-7399.2010.04.015.
17.徐丽,刘朝霞,方静宜,王军梅,杜江,李桂林.脑室外神经细胞瘤12例临床病理分析[J].临床与实验病理学杂志,2015,(8):885-889.DOI:10.13315/j.cnki.cjcep.2015.08.011.
18.王雷明,卢德宏,朴月善.第5版WHO中枢神经系统肿瘤分类胶质神经元和神经元肿瘤解读[J].中华病理学杂志,2022,51(11):1085-1089.DOI:10.3760/cma.j.cn112151-20220620-00544.
作者:上海阿克曼病理
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#鉴别诊断# #癫痫# #胚胎发育不良性神经上皮肿瘤#
70