Cell: APOE4驱动星形胶质细胞和小胶质细胞脂代谢失调,可增加阿尔茨海默病风险
2022-08-18 brainnew神内神外 brainnew神内神外
作者在hiPSC模型,AD患者的脑组织和APOE-TR小鼠证明了APOE4基因在人类当中的独特作用。
近日,来自美国纽约西奈山伊坎医学院遗传学和基因组科学系的Alison M. Goate教授团队在Cell 杂志在线发表了题为“Cholesterol and matrisome pathways dysregulated in astrocytes and microglia”的研究,该研究揭示了人类特有的APOE4驱动的星形胶质细胞和小胶质细胞脂代谢失调,这可能有助于增加阿尔茨海默病的风险。

载脂蛋白Eε4(APOE4)是阿尔茨海默病(AD)的遗传风险因子,其对人脑细胞功能的影响尚不清楚。在这里,作者研究了APOE4对人群和同基因人类诱导多能干细胞(HiPSCs)、死后的脑组织和APOE靶向替换(APOE-TR)小鼠脑细胞类型的影响。
人群和等基因模型表明,APOE4局部单倍型,而不是单一的风险等位基因,是导致风险的因素。全转录组分析揭示了人类特有的APOE4驱动星形胶质细胞和小胶质细胞的脂代谢失调。星形胶质细胞中的溶酶体胆固醇螯合导致细胞内胆固醇升高,但APOE4仍可促进胆固醇的从头合成。
此外,基质组(一组核心的细胞外基质蛋白及修饰她们的蛋白质)失调与与神经元共培养的星形胶质细胞中上调的趋化性、神经胶质激活和脂质生物合成有关,这概括了人脑中星形胶质细胞基质组信号的改变。因此,APOE4启动神经胶质细胞和非细胞的自主失调,这可能导致AD风险增加。
作者分析了13个人群hiPSC系(6个APOE 44和7个APOE 33),确认APOE4是AD遗传风险评分(GRS)的主要贡献者(图1A-1B)。通过1000G单倍型频率,作者定义了常见(hap.01-23)和稀有(hap.other)单倍型,识别了8个常见单倍型和 11个稀有单倍型(图1C)。APOE4发生在7个独特的单倍型上,而APOE3发生在12个不同的单倍型上(图1C)。
通过RNA测序获得的52个转录本的主成分分析(PCA)和Spearman相关性显示,样本按细胞类型聚集,但不能按APOE基因型区分(图1F-1G),表明稳健的分化方法独立于APOE状态。
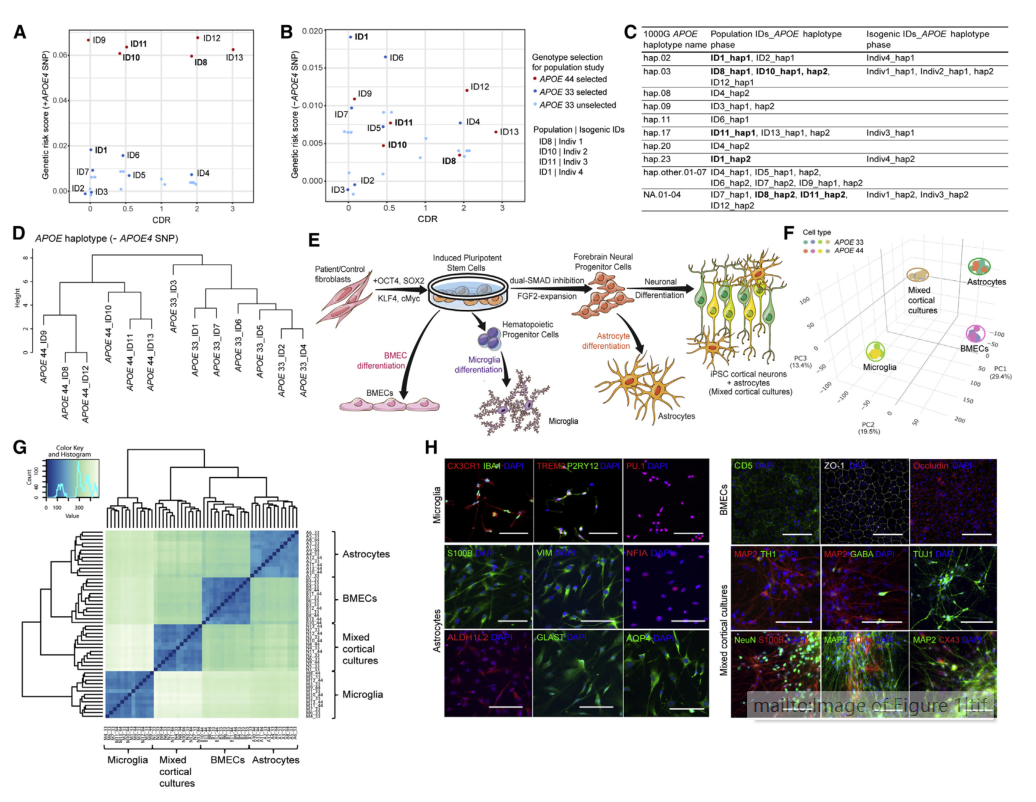
图1. 基于APOE基因型和单倍型的脑细胞模型
作者对每种细胞类型进行了差异表达基因(DEG)分析,发现小胶质细胞和星形胶质细胞是受固有APOE基因影响的主要细胞类型(图2A、2B)。小胶质细胞和星形胶质细胞中最显著的上调基因集是胆固醇生物合成和其他脂质途径(图2C和2D)。
在小胶质细胞中,下调基因集包括高密度脂蛋白(HDLI)介导的脂质运输、通用转录途径和溶酶体(图2C)。接下来,作者发现胆固醇生物合成预测APOE4小胶质细胞胆固醇/萜类合成增加和类固醇代谢上调(图2F)。APOE4星形胶质细胞显示胆固醇合成和代谢上调(图2G)。
因此,全转录分析显示,APOE4与较高的胆固醇合成和较低的分解代谢/外排相关,从而预测了APOE4小胶质细胞和星形胶质细胞内胆固醇水平的变化。
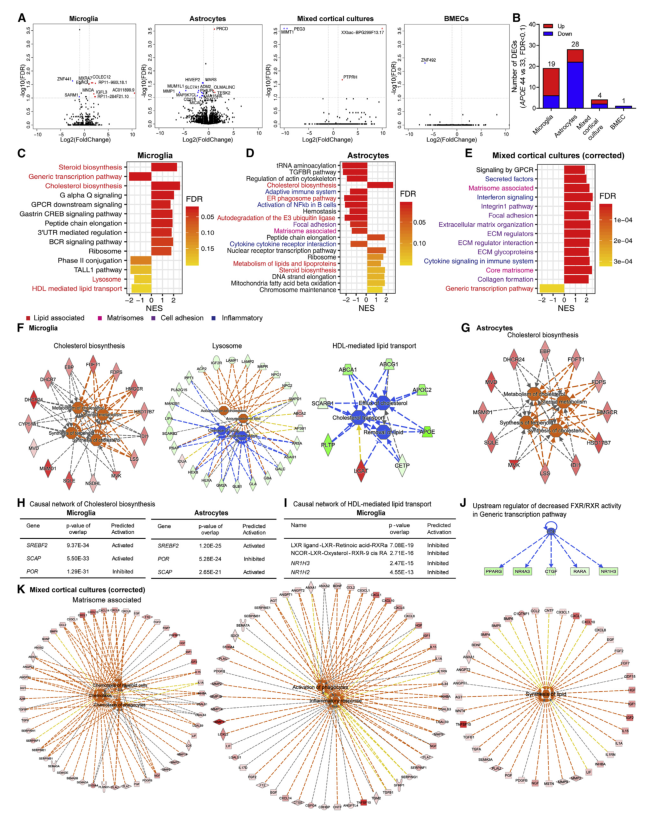
图2. 人群模型中APOE4丰富的脂质和基质组途径
进一步的研究显示,小胶质细胞仅按个体聚集,但不按性别或载脂蛋白E基因型聚集(图3C和3D)。作者在APOE4和APOE3的群体和同基因比较中发现了重要的模块特征基因(ME),代表了模块的表达谱(图3E-3G)。
与人群星形胶质细胞一致,在APOE4等基因星形胶质细胞中,脂代谢上调最为显著(图3F)。而在APOE4混合皮质培养物中,基质组上调,而脂代谢、转录和翻译下调(图3G)。在等位基因人群中观察到的DEG明显多于人群(图3H)。
WGCNA和fGSEA结合种群和等基因数据显示,四个个体中有三个共享的小胶质细胞和星形胶质细胞模块,每种细胞类型有不同的异常值 (图3E-3F)。此外,APOE KO的富集模块在同一个体内模仿APOE4(图3E-3G),表明APOE4是LOF。

图3.揭示个体差异的同源模型
AD与对照组的DEG分析揭示了在APOE4 hiPSC混合皮质培养物中发现的相同基质组富集(图4A)。基质组基因集的预测功能包括:上调的趋化性、炎症和脂质合成(图4B)。通过小胶质细胞、星形胶质细胞、神经元、内皮细胞和少突胶质细胞对全脑转录组进行去卷积,然后进行DEG分析(APOE4与APOE3),MSBB的颞上回、海马旁回和额下回以及ROSMAP AD脑的背外侧前额叶皮质中,基质组富含APOE4星形胶质细胞(图4C-4F)。
APOE4小胶质细胞在所有脑区的ECM、趋化因子和细胞因子信号通路中均呈阳性富集(图4G-4J)。在细胞类型去卷积后,APOE4 AD星形胶质细胞显示出相同的基质体相关模块:趋化性、炎症和脂质合成(图4K)。
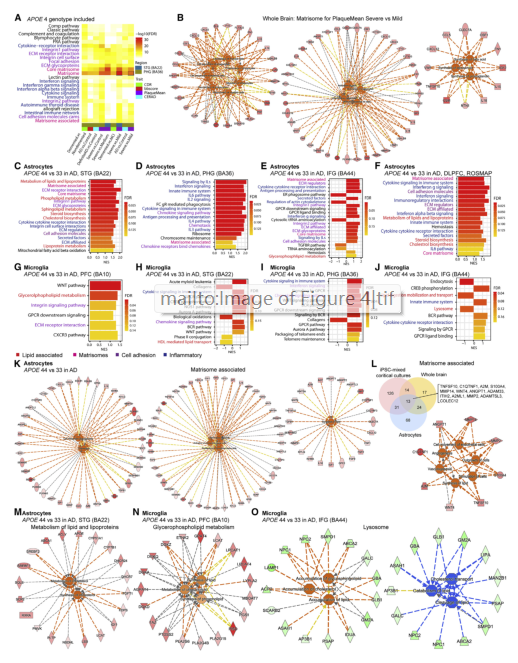
图4. APOE4 在去卷积的AD脑星形胶质细胞中丰富的基质组通路
随后,作者对APOE4、APOE3、Apoe KO和Apoe野生型(WT)的小鼠新生小胶质细胞和星形胶质细胞进行了转录组学分析,发现APOE基因座附近的调控机制或结构在物种之间存在差异。脂质代谢失调是人类特异性的。

图5 小鼠Apoe和人类APOE4 对小鼠星形胶质细胞和小胶质细胞的影响
转录组学分析提示揭示了APOE4星形胶质细胞和小胶质细胞中胆固醇代谢的解耦。进一步研究发现表明APOE4星形胶质细胞中的细胞内胆固醇升高。这是由于游离胆固醇ER中游离出来储积在溶酶体中,胞质内游离胆固醇减少,导致从头胆固醇合成上调。LXR激动剂可逆转解偶的脂质代谢,但对不同细胞类型反应不同。
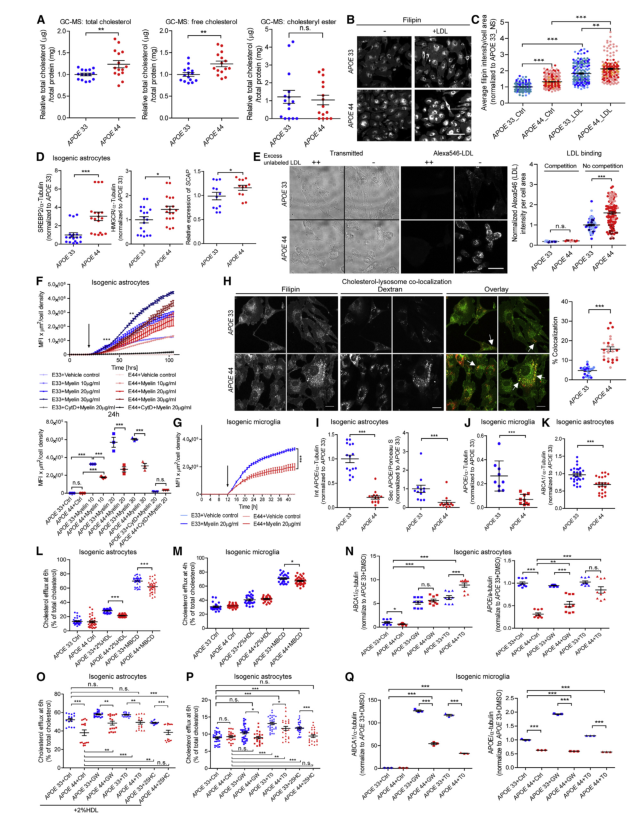
图6 胆固醇被溶酶体隔离导致胶质细胞中脂质代谢解耦
此外,转录组学中最显着和负富集的基因组之一是肌动蛋白细胞骨架的调节,作者通过研究发现APOE4星形胶质细胞的肌动蛋白细胞骨架失调与外部脂质暴露无关。混合皮质培养物的去卷积星形胶质细胞与纯星形胶质细胞高度相关(95%–97%),支持星形胶质细胞-神经元通讯驱动星形胶质细胞基质体信号的观点。基质体则加剧APOE4星形胶质细胞的脂质失调。
总结
总而言之,作者在hiPSC模型,AD患者的脑组织和APOE-TR小鼠证明了APOE4基因在人类当中的独特作用,揭示了APOE4共同驱动星形胶质细胞中的溶酶体胆固醇螯合,减少了胞质内游离的胆固醇,从而通过增加胆固醇生物合成和减少外排,导致脂质失调。
参考文献
TCW et al., Cholesterol and matrisome pathways dysregulated in astrocytes and microglia, Cell (2022), https://doi.org/10.1016/j.cell.2022.05.017
编译作者:Vickyw(brainnews创作团队)
校审:Simon(brainnews编辑部)
- END -
作者:brainnew神内神外
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#阿尔茨#
55
#Cell#
43
#阿尔茨海#
33
#CEL#
45
#星形胶质细胞#
50