Nat Chem:诱导铁死亡的抗肿瘤小分子发现及其靶标识别
2019-06-17 王雪飞&张健 分子设计
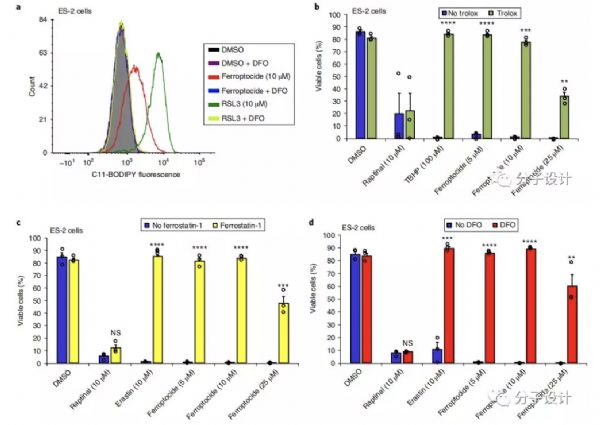
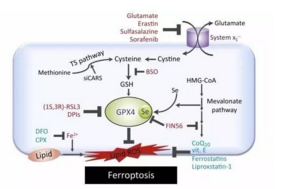
铁死亡(Ferroptosis)作为一种非凋亡的新型细胞死亡方式,主要细胞内产生了致死水平的脂质活性氧自由基(lipid Reactive Oxygen Species,lipid ROS)积累,而这一积累过程需要铁离子的参与,因而称为铁死亡。

作者:王雪飞&张健
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#小分子#
0
#Nat#
56
#靶标#
56
可能成为全新靶点,非常有价值。不过铁死亡是通用机制,诱导铁死亡可能会带来很多严重不良反应,总之,创新永远没有这么容易
104