Cell Death Dis:缺氧诱导lncRNA PDIA3P1竞争性抑制miR-124-3p促进神经胶质瘤-EMS转化
2020-03-17 MedSci原创 MedSci原创
在恶性原发性脑瘤中,神经胶质瘤的比例高达75%。尽管目前多种治疗手段均可改善神经胶质瘤患者的预后,但其治疗效果仍远低于其他肿瘤。
大量研究表明,lncRNA可作为转录及表观遗传网络中的新型调节因子,且已发现许多lncRNA在肿瘤中异常表达,并在肿瘤发生发展过程中起着至关重要的作用。假基因被定义为类似于其编码同源物但缺乏翻译成功能蛋白能力的基因组位点,一度被认为是进化过程中的非功能性遗迹,但目前也慢慢的成为人类肿瘤发生发展过程中的一类关键因素。
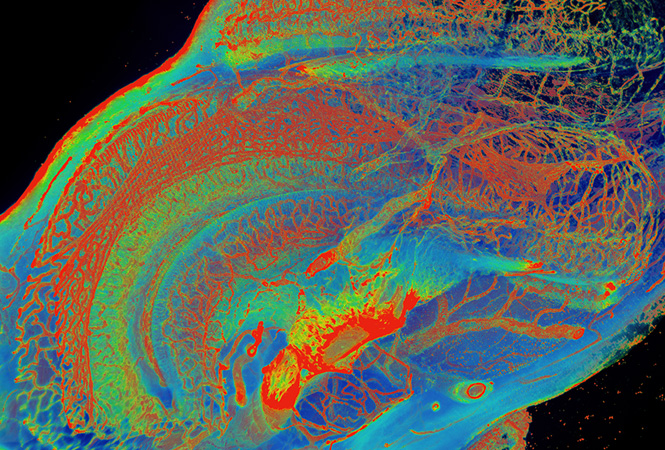
研究人员发现在神经胶质瘤中,PDIA3P1的表达水平与肿瘤等级、转录组亚型及预后密切相关。富集分析发现PDIA3P1高表达与上皮-间质转化、细胞外基质(ECM)分解及血管生成有关。体外研究进一步表明,过表达PDIA3P1能够增强胶质瘤细胞的迁移和侵袭能力,而敲低PDIA3P1可诱导相反的作用。进一步的研究表明,PDIA3P1可作为ceRNA行使功能作用,可作为miR-124-3p的海绵竞争性抑制其作用,进而调节RELA的表达,激活下游NF-κB信号通路,从而促进神经胶质瘤细胞-MES转化。此外,研究人员还发现缺氧诱导因子1(Hypoxia Inducible Factor 1)可以直接与PDIA3P1的启动子区域结合并激活其转录。
综上,PDIA3P1可以通过调节PDIA3P1/miR-124-3p/RELA通路将缺氧及神经胶质瘤-MES转化联系起来,说明其或可作为神经胶质瘤治疗的预后指标及潜在的治疗靶标。
原始出处:
Wang et al. Hypoxia-induced lncRNA PDIA3P1 promotes mesenchymal transition via sponging of miR-124-3p in glioma.Cell Death and Disease (2020) 11:168
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#CRN#
85
#EMS#
83
#Dis#
78
#PDIA3P1#
0
#Cell#
68