天津大学范华昊等在Clinical Microbiology Reviews发表新冠病毒引起的神经系统疾病长篇综述
16小时前 iNature iNature
该综述总结了目前已被报道的COVID-19患者出现的中枢神经系统和周围神经系统症状,分析SARS-CoV-2引起神经系统疾病的机制。
天津大学生命科学学院范华昊教授等于2024年9月18日在《Clinical Microbiology Reviews》(临床微生物学评论)杂志发表题目为《Neurological complications caused by SARS-CoV-2》(新冠病毒引起的神经系统疾病)的长篇综述文章。该综述总结了目前已被报道的COVID-19患者出现的中枢神经系统和周围神经系统症状,分析SARS-CoV-2引起神经系统疾病的机制。并进一步介绍长新冠中的神经系统症状,针对COVID-19流行期间的神经系统并发症提出了相关注意事项和护理建议。

新冠感染不仅会引起呼吸道症状,还会导致神经系统并发症。有研究表明,在新冠感染期间,超过30%的新冠患者被发现存在神经系统并发症状[1],SARS-CoV-2可同时入侵中枢神经系统(CNS)和周围神经系统(PNS),导致多种神经系统疾病。最常见的中枢神经系统症状包括脑病[2]、神经退行性疾病[3]等,最常见的周围神经系统症状包括嗅觉丧失、嗅觉或味觉障碍、肌无力和骨骼肌损伤等一些骨骼肌症状[4]。在长新冠患者中,主要的神经系统症状包括疲劳、肌无力、头痛、认知障碍或脑雾等[5]。
新冠患者出现神经系统症状可能有以下几种原因:病毒通过神经逆行途径或血源性途径进入大脑[6]、病毒感染引起的细胞因子风暴破坏中枢神经系统的正常功能[7]、病毒感染引起的大脑供血不足[8]或缺氧[9]等。
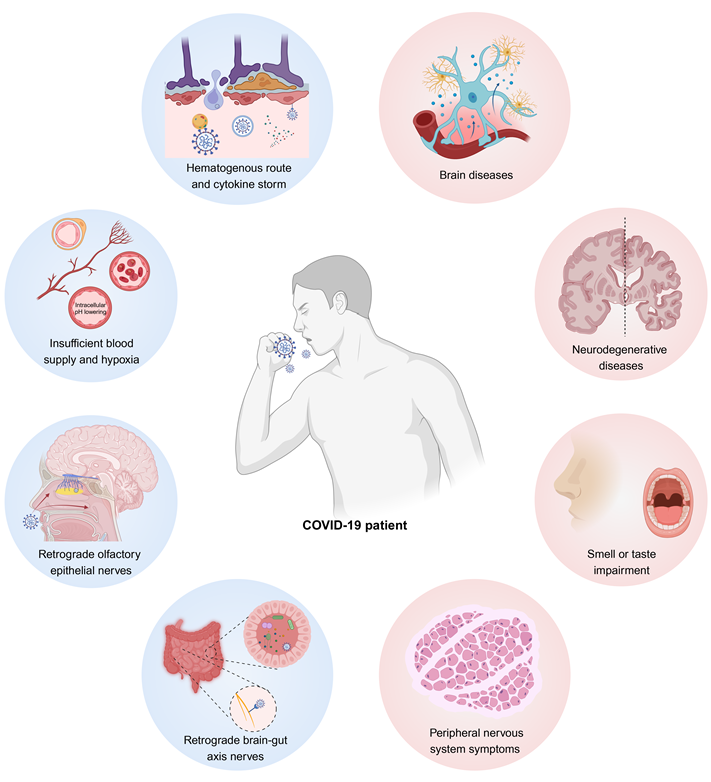
图形摘要:新冠病毒感染引起的中枢神经系统和周围神经系统并发症类型,及其导致神经系统并发症的潜在机制。
第一部分:中枢神经系统症状
现有证据表明,SARS-CoV-2感染与多种中枢神经系统并发症有关,如头痛、脑病、脑炎和脑血管疾病[10],在某些病例中可导致患者死亡[11]。即使是无症状或症状轻微的新冠患者也可能出现神经系统症状[12]。本文全面总结了由SARS-CoV-2感染引起的中枢神经系统疾病(表1)。
表1:新冠患者中枢神经系统症状一览表
第二部分:周围神经系统症状
SARS-CoV-2感染与多种PNS症状相关,包括嗅觉或味觉障碍[10]、骨骼肌损伤和炎症[13]、重症肌无力[14]和ICU获得性重症肌无力[15]。本文总结了SARS-CoV-2感染诱发的各种PNS症状(表2)。
表2:新冠患者周围神经系统症状一览表
第三部分:SARS-CoV-2感染导致神经系统疾病的机制
细胞表面的ACE2受体是SARS-CoV-2进入细胞的关键因子[16],并广泛存在于包括上呼吸道、口腔、肺、肠道和大脑在内的全身各组织和器官中[17],其在血管内皮细胞和星形胶质细胞等血脑屏障的关键组成成分中高度表达。入侵大脑的SARS-CoV-2可能通过激活这些细胞,引发神经炎症,并可能导致中枢神经系统功能严重受损[18]。
新冠患者出现神经系统症状的潜在机制包括:病毒通过神经元逆行(图1)或血源性途径(图2)进入大脑、病毒感染引发的细胞因子风暴对中枢神经系统功能产生破坏(图3)、病毒感染引发的脑缺血或缺氧以及病毒感染导致的神经元细胞融合(图4)。
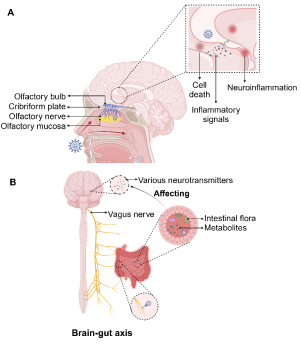
图1:SARS-CoV-2通过神经元逆行途径进入大脑
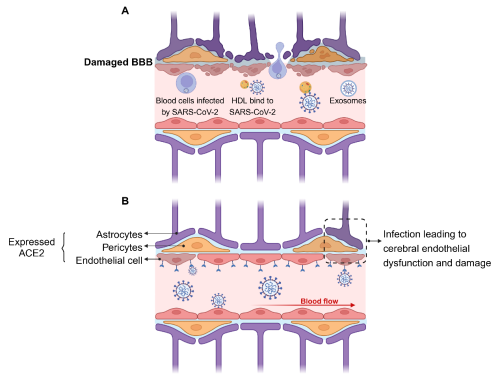
图2:SARS-CoV-2通过血源性途径进入大脑
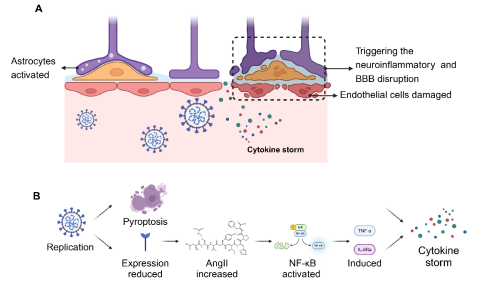
图3:SARS-CoV-2感染诱发的细胞因子风暴
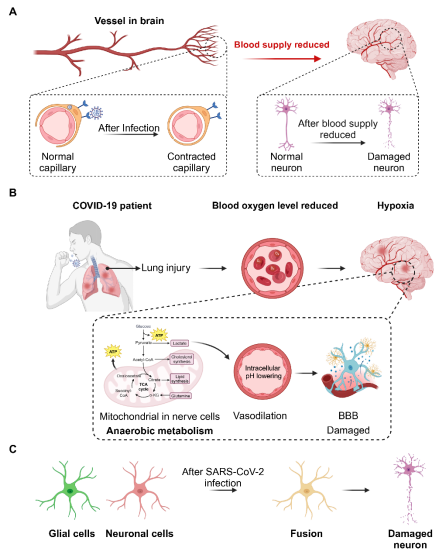
图4:SARS-CoV-2感染导致神经系统并发症的其他机制
第四部分:长新冠患者中的神经系统疾病
大多数新冠患者可以完全康复,但有一部分患者的症状会持续很长时间[19],如呼吸困难、疲劳、心悸和肌肉无力,女性患者更容易出现这些症状[20],这种现象被称为长新冠,表示新冠感染的长期后遗症[21]。长新冠在非住院患者中的发病率为10%至30%,而在住院患者中的发病率为50%至70%[22]。这一现象已引起越来越多的关注,嗅觉或味觉障碍已成为长新冠的主要症状[23],一项新冠病毒主动暴露试验结果表明,三分之二的感染者会表现出持续一到九个月的嗅觉和味觉异常[24]。此外,一些患者中还存在持续的神经系统并发症,从头痛、嗅觉障碍和疲劳等轻微症状,到睡眠障碍、疼痛、认知障碍、格林-巴利综合征[21]和帕金森症状等更严重的表现[25]。
第五部分:针对SARS-CoV-2引发的神经系统疾病的护理及治疗建议
自2020年以来,随着SARS-CoV-2在全球蔓延,嗅觉功能障碍已成为一种普遍的新冠后遗症[26],引发了人们对该病毒诱发的神经系统后遗症的高度关注。皮质类固醇[27]、格列本脲[28]、维生素B12[29]和益生菌[30]在缓解SARS-CoV-2诱发的神经系统症状方面具有潜在功效。
北京化工大学的庞泽涵(2022级硕博连读生)、汤傲(2019级本科生)、何钰洁(2019级本科生)和首都医科大学宣武医院的范俊芬为该文章的共同第一作者,范华昊教授和童贻刚教授为共同通讯作者。
原文连接:
https://doi.org/10.1128/cmr.00131-24
参考文献:
[1] Pezzini A, Padovani A. Lifting the mask on neurological manifestations of COVID-19. Nat Rev Neurol. 2020. 16(11): 636-644.
[2] Menni C, Sudre CH, Steves CJ, Ourselin S, Spector TD. Widespread smell testing for COVID-19 has limited application - Authors' reply. Lancet. 2020. 396(10263): 1630-1631.
[3] Xydakis MS, Albers MW, Holbrook EH, et al. Post-viral effects of COVID-19 in the olfactory system and their implications. Lancet Neurol. 2021. 20(9): 753-761.
[4] Soares MN, Eggelbusch M, Naddaf E, et al. Skeletal muscle alterations in patients with acute Covid-19 and post-acute sequelae of Covid-19. J Cachexia Sarcopenia Muscle. 2022. 13(1): 11-22.
[5] Desai AD, Lavelle M, Boursiquot BC, Wan EY. Long-term complications of COVID-19. Am J Physiol Cell Physiol. 2022. 322(1): C1-C11.
[6] Haidar MA, Jourdi H, Haj Hassan Z, et al. Neurological and Neuropsychological Changes Associated with SARS-CoV-2 Infection: New Observations, New Mechanisms. Neuroscientist. 2022. 28(6): 552-571.
[7] Aghagoli G, Gallo Marin B, Katchur NJ, Chaves-Sell F, Asaad WF, Murphy SA. Neurological Involvement in COVID-19 and Potential Mechanisms: A Review. Neurocrit Care. 2021. 34(3): 1062-1071.
[8] Hirunpattarasilp C, James G, Kwanthongdee J, et al. SARS-CoV-2 triggers pericyte-mediated cerebral capillary constriction. Brain. 2023. 146(2): 727-738.
[9] Sarubbo F, El Haji K, Vidal-Balle A, Bargay Lleonart J. Neurological consequences of COVID-19 and brain related pathogenic mechanisms: A new challenge for neuroscience. Brain Behav Immun Health. 2022. 19: 100399.
[10] Wesselingh, R. 2023. Prevalence, pathogenesis and spectrum of neurological symptoms in COVID-19 and post-COVID-19 syndrome: a narrative review. Med. J. Aust. 219:230-236.
[11] Hensley, M.K., D. Markantone and H.C. Prescott. 2022. Neurologic Manifestations and Complications of COVID-19. Annu. Rev. Med. 73:113-127.
[12] Vespignani, H., D. Colas, B.S. Lavin, C. Soufflet, L. Maillard, V. Pourcher, O. Paccoud, S. Medjebar and P.Y. Frouin. 2020. Report on Electroencephalographic Findings in Critically Ill Patients with COVID-19. Ann. Neurol. 88:626-630.
[13] Wan, D., T. Du, W. Hong, L. Chen, H. Que, S. Lu and X. Peng. 2021. Neurological complications and infection mechanism of SARS-COV-2. Signal Transduct Target Ther 6:406.
[14] Restivo, D.A., D. Centonze, A. Alesina and R. Marchese-Ragona. 2020. Myasthenia Gravis Associated With SARS-CoV-2 Infection. Ann. Intern. Med. 173:1027-1028.
[15] Van Aerde, N., G. Van den Berghe, A. Wilmer, R. Gosselink and G. Hermans. 2020. Intensive care unit acquired muscle weakness in COVID-19 patients. Intensive Care Med 46:2083-2085.
[16] Hoffmann, M., H. Kleine-Weber, S. Schroeder, N. Krüger, T. Herrler, S. Erichsen, T.S. Schiergens, G. Herrler, N.H. Wu, A. Nitsche, M.A. Müller, C. Drosten and S. Pöhlmann. 2020. SARS-CoV-2 Cell Entry Depends on ACE2 and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 181:271-280.e8.
[17] Trypsteen, W., J. Van Cleemput, W.V. Snippenberg, S. Gerlo and L. Vandekerckhove. 2020. On the whereabouts of SARS-CoV-2 in the human body: A systematic review. PLoS Pathog. 16:e1009037.
[18] Welcome, M.O.and N.E. Mastorakis. 2021. Neuropathophysiology of coronavirus disease 2019: neuroinflammation and blood brain barrier disruption are critical pathophysiological processes that contribute to the clinical symptoms of SARS-CoV-2 infection. Inflammopharmacology 29:939-963.
[19] Chen, B., B. Julg, S. Mohandas and S.B. Bradfute. 2023. Viral persistence, reactivation, and mechanisms of long COVID. Elife 12:e86015.
[20] Raman, B., D.A. Bluemke, T.F. Lüscher and S. Neubauer. 2022. Long COVID: post-acute sequelae of COVID-19 with a cardiovascular focus. Eur. Heart J. 43:1157-1172.
[21] Neurology, T.L. 2021. Long COVID: understanding the neurological effects. Lancet Neurol 20:247.
[22] Davis, H.E., L. McCorkell, J.M. Vogel and E.J. Topol. 2023. Long COVID: major findings, mechanisms and recommendations. Nat. Rev. Microbiol. 21:133-146.
[23] Stefanou, M.I., L. Palaiodimou, E. Bakola, N. Smyrnis, M. Papadopoulou, G.P. Paraskevas, E. Rizos, E. Boutati, N. Grigoriadis, C. Krogias, S. Giannopoulos, S. Tsiodras, M. Gaga and G. Tsivgoulis. 2022. Neurological manifestations of long-COVID syndrome: a narrative review. Ther Adv Chronic Dis 13:20406223221076890.
[24] Hopkins, C., D.L. Burges Watson, C. Kelly, V. Leary and B.C. Smith. 2020. Managing long covid: don't overlook olfactory dysfunction. BMJ (Clinical research ed.) 370:m3736.
[25] Leta, V., M. Rodríguez-Violante, A. Abundes, K. Rukavina, J.T. Teo, C. Falup-Pecurariu, L. Irincu, S. Rota, R. Bhidayasiri, A. Storch, P. Odin, A. Antonini and K. Ray Chaudhuri. 2021. Parkinson's Disease and Post-COVID-19 Syndrome: The Parkinson's Long-COVID Spectrum. Mov. Disord. 36:1287-1289.
[26] Walker, A., G. Pottinger, A. Scott and C. Hopkins. 2020. Anosmia and loss of smell in the era of covid-19. BMJ (Clinical research ed.) 370:m2808.
[27] Gust, J., R. Ponce, W.C. Liles, G.A. Garden and C.J. Turtle. 2020. Cytokines in CAR T Cell-Associated Neurotoxicity. Front Immunol 11:577027.
[28] Batiha, G.E., H.M. Al-Kuraishy, A.I. Al-Gareeb, M. Alruwaili, R. AlRuwaili, S.M. Albogami, M. Alorabi, H.M. Saad and J. Simal-Gandara. 2022. Targeting of neuroinflammation by glibenclamide in Covid-19: old weapon from arsenal. Inflammopharmacology :1-7.
[29] Batista, K.S., V.M. Cintra, P. Lucena, R. Manhães-de-Castro, A.E. Toscano, L.P. Costa, M. Queiroz, S.M. de Andrade, O. Guzman-Quevedo and J.S. Aquino. 2022. The role of vitamin B12 in viral infections: a comprehensive review of its relationship with the muscle-gut-brain axis and implications for SARS-CoV-2 infection. Nutr. Rev. 80:561-578.
[30] Shahbazi, R., H. Yasavoli-Sharahi, N. Alsadi, N. Ismail and C. Matar. 2020. Probiotics in Treatment of Viral Respiratory Infections and Neuroinflammatory Disorders. Molecules 25:4891.
作者:iNature
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










前往app查看评论内容
2 0