Sci Transl Med:以毒攻癌!蝎毒修饰的CAR-T免疫疗法精准对抗胶质母细胞瘤
2020-03-06 Walter 转化医学网
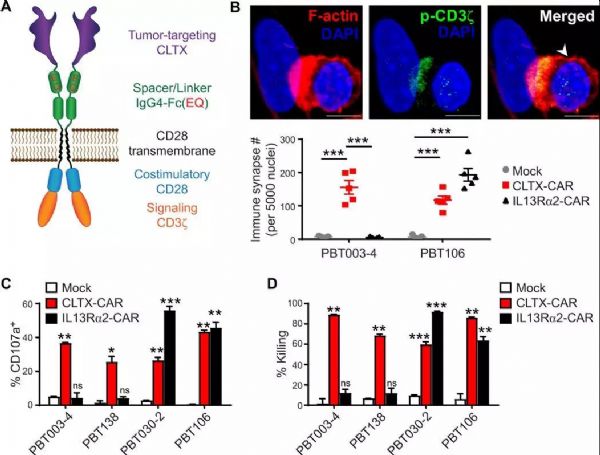
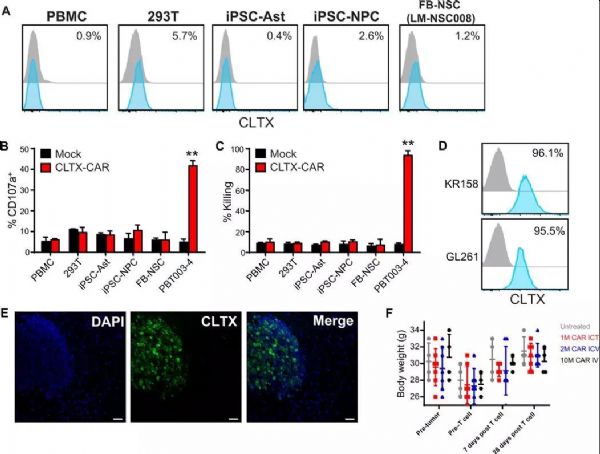
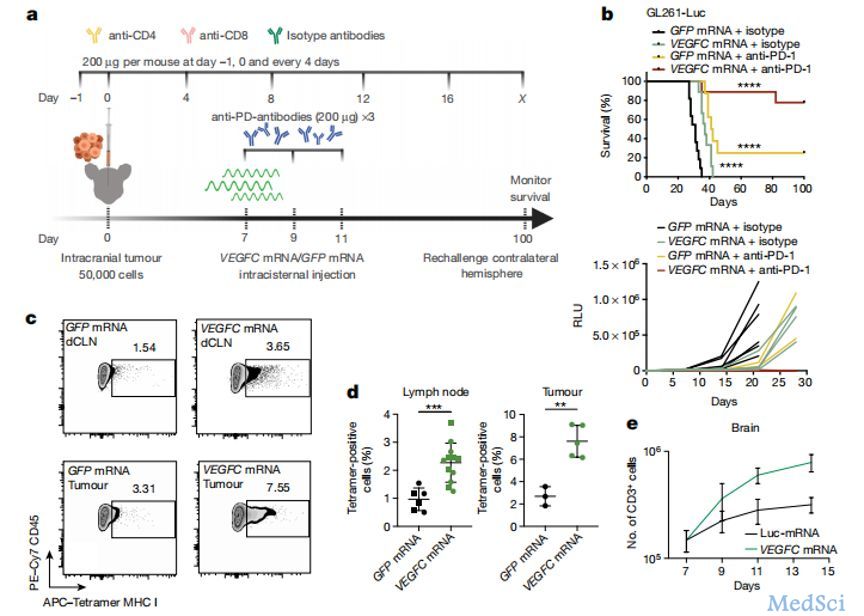
导读:CAR-T疗法,即嵌合抗原受体T细胞疗法,是目前有希望治愈癌症患者的手段之一:对患者体内分离出的T细胞进行基因改造和诱导增殖后,将其重新输入患者体内,大大提升抗癌效率和靶向性。然而,免疫疗法尚具有脱靶率高、副作用大、肿瘤类型特异性高等缺点,无法在临床上广泛应用。
作者:Walter
版权声明:
本网站所有注明“来源:梅斯医学”或“来源:MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明“来源:梅斯医学”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#Transl#
57
#CAR-#
67
#TRA#
85
#胶质母细胞#
48
#母细胞瘤#
47